Tên Gọi Của Axit là gì? Bạn đang muốn tìm hiểu về cách gọi tên các loại axit khác nhau? Hãy cùng Xe Tải Mỹ Đình khám phá chi tiết về tên gọi, phân loại, tính chất và ứng dụng của axit trong bài viết này. Chúng tôi sẽ cung cấp những thông tin hữu ích, giúp bạn hiểu rõ hơn về các loại axit thường gặp trong đời sống và công nghiệp.
1. Axit Là Gì? Định Nghĩa Tổng Quan
Axit là một hợp chất hóa học có khả năng hòa tan trong nước, mang vị chua đặc trưng và có công thức tổng quát là HxA. Dung dịch axit khi hòa tan trong nước sẽ có nồng độ pH nhỏ hơn 7. Độ pH càng thấp, tính axit càng mạnh mẽ.
Phân tử axit bao gồm một hoặc nhiều nguyên tử hydro liên kết với gốc axit. Các nguyên tử hydro này có thể được thay thế bởi các nguyên tử kim loại. Tại XETAIMYDINH.EDU.VN, chúng tôi cung cấp thông tin chi tiết và chính xác về cấu trúc và tính chất của axit, giúp bạn hiểu rõ hơn về loại hợp chất quan trọng này.
 Axit là gì?
Axit là gì?
2. Các Định Nghĩa Axit Theo Các Nhà Khoa Học
2.1. Axit Arrhenius
Năm 1884, nhà hóa học Svante Arrhenius người Thụy Điển định nghĩa axit dựa trên ion hydro (H+) hay proton. Theo đó, axit Arrhenius là chất khi thêm vào nước sẽ làm tăng nồng độ ion H+ trong dung dịch.
2.2. Axit Brønsted-Lowry
Năm 1923, hai nhà hóa học Julian Nicolaus Brønsted và Thomas Martin Lowry độc lập công nhận rằng phản ứng axit-bazơ liên quan đến việc chuyển một proton. Axit được định nghĩa là chất có khả năng cho proton (ion H+).
2.3. Axit Lewis
Khái niệm này được Gilbert N. Lewis đề xuất năm 1923, cho rằng phản ứng axit-bazơ không liên quan đến việc chuyển proton. Axit Lewis là chất chấp nhận một cặp electron từ chất khác, hay đơn giản là chất nhận cặp electron.
3. Chỉ Số Axit Là Gì?
Chỉ số axit được sử dụng để định lượng số lượng axit tồn tại trong một mẫu, ví dụ như dầu diesel sinh học. Đây là lượng bazơ, biểu thị bằng miligam kali hydroxit (KOH), cần thiết để trung hòa các thành phần axit trong 1 gam mẫu thử.
4. Công Thức Hóa Học Tổng Quát Của Axit
Axit có công thức hóa học tổng quát là HxA, trong đó:
- H là nguyên tử Hydro
- x là chỉ số của nguyên tử H
- A là gốc axit
Ví dụ:
- Axit nitric: HNO3
- Axit cacbonic: H2CO3
- Axit photphoric: H3PO4
5. Tính Chất Đặc Trưng Của Axit
5.1. Tính Chất Vật Lý
- Hòa tan trong nước và có vị chua.
- Gây cảm giác bỏng rát khi tiếp xúc (với axit mạnh).
- Có khả năng dẫn điện do là chất điện li.
5.2. Tính Chất Hóa Học
-
Làm đổi màu chất chỉ thị: Axit làm giấy quỳ tím chuyển sang màu đỏ hoặc hồng.
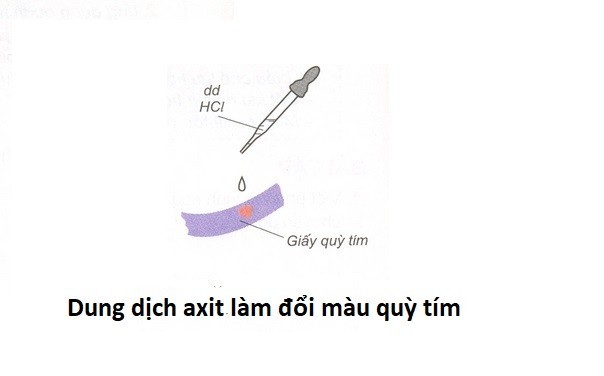 Axit làm đổi màu chất chỉ thị màu
Axit làm đổi màu chất chỉ thị màu -
Tác dụng với kim loại: Axit tác dụng với kim loại đứng trước H trong dãy hoạt động hóa học, tạo thành muối và giải phóng khí hidro. Axit đặc không giải phóng khí hidro.
Mg + H2SO4(loãng) → MgSO4 + H2 Fe + 2HCl → FeCl2 + H2 -
Tác dụng với bazơ: Axit tác dụng với bazơ tạo thành muối và nước.
Cu(OH)2 + H2SO4 → CuSO4 + 2H2O Mg(OH)2 + 2HCl → MgCl2 + 2H2O -
Tác dụng với oxit bazơ: Axit tác dụng với oxit bazơ tạo thành muối và nước.
Na2O + 2HCl → 2NaCl + H2O FeO + H2SO4(loãng) → FeSO4 + H2O -
Tác dụng với muối:
- Chất tạo thành từ phản ứng có ít nhất một kết tủa hoặc khí bay hơi.
- Nếu muối mới là muối tan thì axit mới là axit yếu và ngược lại.
H2SO4 + BaCl2 → BaSO4 + 2HCl KCO3 + 2HCl → 2KCl + H2O + CO2
5.3. Tính Điện Li
-
Axit (HA) và nước phản ứng theo phương trình:
HA + H2O ⇌ A- + H3O+ -
Hằng số axit (Ka) là hằng số cân bằng cho phản ứng của axit và nước:
Ka = [(A-).(H3O+)] / (HA) -
Axit mạnh có giá trị Ka lớn và axit yếu có giá trị Ka nhỏ.
-
Lưu ý:
- “Ion hydro” và “proton” được sử dụng tương đương để chỉ H+.
- Trong phản ứng hóa học thường viết H+ nhưng thực tế trong nước là H3O+.
- Cường độ axit đo bằng giá trị Ka và định nghĩa bằng pKa = -log(Ka).
5.4. Phản Ứng Trung Hòa
-
Axit tác dụng với bazơ tạo thành muối và nước, gọi là phản ứng trung hòa hay phản ứng tạo nước.
NaOH + HCl → NaCl + H2O -
Đây là cơ sở cho phương pháp chuẩn độ trong phân tích axit, trong đó chất chỉ thị pH đóng vai trò chỉ ra điểm trung hòa.
5.5. Bậc Điện Li Axit
Phân tử có khả năng cung cấp nhiều hơn 1 ion H+ (proton). Axit chỉ cho 1 ion H+ trên 1 phân tử gọi là axit monoproton, 2 ion H+ gọi là axit diproton và 3 ion H+ gọi là axit triproton.
-
Axit monoproton chỉ có 1 nấc điện li và 1 hằng số điện li:
HA + H2O ⇌ A- + H3O+ -
Axit diproton (H2A) có thể có 1 hoặc 2 nấc điện li tùy thuộc vào điều kiện môi trường (pH). Mỗi nấc điện li có hằng số điện li riêng (Ka1 và Ka2):
H2A + H2O ⇌ HA- + H3O+ (Ka1) HA- + H2O ⇌ A2- + H3O+ (Ka2)Thường thì Ka1 > Ka2.
-
Tương tự, axit triproton (H3A) có thể có 1, 2, 3 nấc điện li và 3 hằng số điện li (Ka1 > Ka2 > Ka3):
H3A + H2O ⇌ H2A- + H3O+ (Ka1) H2A- + H2O ⇌ HA2- + H3O+ (Ka2) HA2- + H2O ⇌ A3- + H3O+ (Ka3)
6. Cách Gọi Tên Axit Theo Danh Pháp Hóa Học
6.1. Axit Không Có Oxi
Tên axit = axit + tên Latin của phi kim + hiđric
Ví dụ: HCl – axit clohiđric
6.2. Axit Có Nhiều Oxi
Tên axit = axit + tên Latin của phi kim + ic
Ví dụ: HNO3 – axit nitric
6.3. Axit Có Ít Nguyên Tử Oxi
Tên axit = axit + tên Latin của phi kim + ơ
Ví dụ: HNO2 – axit nitrơ
7. Phân Loại Axit Dựa Trên Các Tiêu Chí
7.1. Dựa Vào Tính Chất Hóa Học
-
Axit mạnh: Phân li hoàn toàn thành ion khi tan trong nước.
HCl → H+ + Cl- HNO3 → H+ + NO3-Một số axit mạnh thường gặp: HCl, HNO3, H2SO4…
-
Axit yếu: Chỉ phân li một phần ra ion khi tan trong nước.
CH3COOH ⇌ H+ + CH3COO-Một số axit yếu thường gặp: H2S, H2CO3…
7.2. Dựa Vào Nguyên Tử Oxi
- Axit không có oxi: HCl, H2S, HI…
- Axit có oxi: H2SO4, H3PO4, H2CO3…
7.3. Dựa Theo Số Nguyên Tử H Trong Phân Tử
- Axit một nấc: Chỉ phân li một nấc ra ion H+ trong dung dịch nước.
- Axit nhiều nấc: Có khả năng phân li nhiều nấc ra ion H+ trong dung dịch nước.
7.4. Các Phân Loại Khác
- Axit vô cơ: HCl, HNO3…
- Axit hữu cơ: HCOOH, CH3COOH, CH3CH2COOH…
8. Các Axit Thường Gặp Trong Đời Sống Và Công Nghiệp
| Loại axit | Tên gọi | CTHH | Loại axit | Tên gọi | Ký hiệu |
|---|---|---|---|---|---|
| Axit vô cơ mạnh | Axit Clohydric | HCl | Axit trong chế biến thực phẩm | Axit axetic/Axit etanoic | E260 |
| Axit bromhydric | HBr | Axit adipic | E355 | ||
| Axit iodhydric | HI | Axit alginic | E400 | ||
| Axit nitric | HNO3 | Axit benzoic | E210 | ||
| Axit sulfuric | H2SO4 | Axit boric | E284 | ||
| Axit cloric | HClO3 | Axit ascorbic (Vit C) | E300 | ||
| Axit pecloric | HClO4 | Axit xitric | E330 | ||
| Axit selenic | H2SeO4 | Axit carbonic | E290 | ||
| Axit pemanganic | HMnO4 | Axit cacminic | E120 | ||
| Axit fluoroantimonic | H2FSbF6 | Axit xyclamic | E952 | ||
| Axit vô cơ yếu/trung bình | Axit boric | H3BO3 | Axit erythorbic | E315 | |
| Axit photphoric | H3PO4 | Axit erythorbin | E317 | ||
| Axit cacbonic | H2CO3 | Axit foócmic | E236 | ||
| Axit pyrophotphoric | H4P2O7 | Axit fumaric | E297 | ||
| Axit sunfurơ | H2SO3 | Axit gluconic | E754 | ||
| Axit selenơ | H2SeO3 | Axit glutamic | E620 | ||
| Axit nitrơ | HNO2 | Axit guanylic | E626 | ||
| Axit phosphorơ | H3PO3 | Axit clohiđric | E507 | ||
| Axit hipoclorơ | HClO | Axit inosinic | E630 | ||
| Axit clorơ | HClO2 | Axit lactic | E270 | ||
| Axit silicic | H2SiO3 | Axit malic | E296 | ||
| Axit xianhhidric | HCN | Axit metatartaric | E353 | ||
| Axit aluminic | HAlO2 | Axit nicôtinic | E375 | ||
| Axit au-clohidric | HAuCl4 | Axit ôxalic | |||
| Axit hữu cơ | Axit axêtic | C2H4O2 | Axit pectic | ||
| Axit oxalic | C2H2O4 | Axit phốtphoric | E338 | ||
| Axit benzôic | C7H6O2 | Axit prôpionic | E280 | ||
| Axit butyric | C4H8O2 | Axit soócbic | E200 | ||
| Axit xitric | C6H8O7 | Axit stêaric | E570 | ||
| Axit formic | CH2O2 | Axit sucxinic | E363 | ||
| Axit lactic | C3H6O3 | Axit sulfuric | E513 | ||
| Axit malic | C4H6O5 | Axit tannic | |||
| Axit prôpionic | C3H6O2 | Axit tartaric | E334 | ||
| Axit piruvic | C3H4O3 | ||||
| Axit valeric | C5H10O2 |
9. Cách Xác Định Độ Mạnh Yếu Của Axit
-
Dựa vào sự linh động của nguyên tử Hidro: Nguyên tử H càng linh động thì tính axit càng mạnh.
-
Đối với các axit có oxy trong cùng một nguyên tố: Càng ít oxy, axit càng yếu.
HClO4 > HClO3 > HClO2 > HClO -
Đối với các axit của nguyên tố trong cùng chu kỳ: Khi các nguyên tố ở hóa trị cao nhất mà nguyên tố trung tâm có tính phi kim càng yếu thì axit đó càng yếu.
HClO4 > H2SO4 > H3PO4 -
Đối với axit của nguyên tố trong cùng nhóm A:
- Axit có oxy: Tính axit tăng dần từ dưới lên: HIO4 < HBrO4 < HClO4
- Axit không có oxy: Tính axit giảm dần từ dưới lên: HI > HBr > HCl > HF
-
Đối với axit hữu cơ RCOOH:
-
Nếu R đẩy electron (gốc R no) thì tính axit giảm:
HCOOH > CH3COOH > CH3CH2COOH > CH3CH2CH2COOH > n-C4H9COOH -
Nếu R hút e (gốc R không no, thơm hay có nguyên tố halogen,…) thì tính axit mạnh.
-
10. Ứng Dụng Đa Dạng Của Axit Trong Đời Sống Và Sản Xuất
10.1. Trong Công Nghiệp
- Loại bỏ gỉ sét và ăn mòn từ kim loại.
- H2SO4 làm chất điện phân trong pin xe hơi.
- Axit mạnh dùng trong chế biến khoáng sản.
- Trong khai thác dầu, HCl dùng để bơm vào giếng dầu, hòa tan đá, tạo lỗ rỗng lớn hơn.
- Hỗn hợp HCl và HNO3 đặc (3:1) hòa tan vàng và bạch kim.
- Làm chất phụ gia trong chế biến và bảo quản đồ uống, thực phẩm.
- Sản xuất phân bón amoni nitrat từ axit nitric và ammoniac.
- Axit cacboxylic este hóa với rượu tạo este.
 Axit là gì? Axit sunfuric được ứng dụng trong nhiều lĩnh vực công nghiệp và đời sống
Axit là gì? Axit sunfuric được ứng dụng trong nhiều lĩnh vực công nghiệp và đời sống
10.2. Trong Y Học
- Axit acetylsalicylic (Aspirin) giảm đau và hạ sốt.
- Axit boric sát trùng vết bỏng, vết cắt nhỏ, rửa mắt và chống vi khuẩn.
10.3. Đối Với Cơ Thể Người
- Axit clohiđric trong dạ dày giúp tiêu hóa thức ăn.
- Amino axit tổng hợp protein cần thiết cho sự phát triển và sửa chữa mô.
- Axit nucleic sản xuất ADN, ARN và truyền đặc tính qua gen.
- Axit cacbon duy trì cân bằng pH trong cơ thể.
11. Axit Dùng Trong Công Nghiệp Thực Phẩm
Axit được sử dụng rộng rãi trong công nghiệp thực phẩm để bảo quản, tăng cường hương vị. Phổ biến nhất là axit nitric, axit axetic, axit fumaric, axit lactic, axit photphoric, axit malic và axit tartaric.
11.1. Axit Citric
- Axit yếu dùng nhiều nhất trong công nghiệp thực phẩm:
- Sản xuất phô mai: xúc tác để lên men sữa nhanh chóng, tăng hiệu suất.
- Kéo dài thời gian sử dụng thực phẩm: giảm độ pH đến mức vi khuẩn không thể tồn tại.
- Tăng hương vị và vị chua cho thực phẩm.
- Ứng dụng làm chất nhũ hóa.
- Tạo môi trường axit cho sản xuất rượu, bia.
11.2. Axit Axetic
- Dùng trong thực phẩm như chất tạo hương liệu.
- Thêm vào sản phẩm để bảo quản, kéo dài thời gian sử dụng và tạo vị chua.
- Thành phần trong sản phẩm tẩy rửa thiết bị và dụng cụ chế biến thực phẩm.
11.3. Axit Fumaric
- Ổn định và thêm vị chua cho thực phẩm chế biến, điều chỉnh độ axit.
- Bảo quản trứng và món tráng miệng từ trứng, thêm vào trái cây và rau quả chế biến.
11.4. Axit Lactic
- Dùng làm nguyên liệu sản xuất chất nhũ hóa cho ngành nướng bánh.
- Tham gia vào quá trình tạo hương liệu và hương vị thực phẩm.
- Ức chế vi sinh vật gây hại trong thực phẩm lên men, làm chất bảo quản.
11.5. Axit Photphoric
- Tạo hương vị đặc sắc cho đồ uống có ga.
- Làm chậm sự phát triển của nấm mốc và vi khuẩn trong công thức đường.
- Thay đổi protein, độ pH trong sản xuất sản phẩm từ sữa, cải thiện chất lượng.
- Ứng dụng làm chất phụ gia thực phẩm.
11.6. Axit Malic
- Tăng cường và cải thiện hương vị trong thực phẩm chế biến.
- Bảo quản hương vị nhất định trong thực phẩm.
11.7. Axit Tartaric
- Sử dụng làm chất phụ gia và hương liệu.
- Nguyên liệu trong sản xuất chất nhũ hóa bánh mì.
- Tạo gel và bảo quản thực phẩm.
FAQ: Giải Đáp Các Câu Hỏi Thường Gặp Về Tên Gọi Của Axit
-
Tên gọi của axit clohiđric là gì?
Axit clohiđric có công thức hóa học là HCl. Tên gọi khác của nó là hydro clorua.
-
Axit sunfuric có tên gọi khác không?
Axit sunfuric (H2SO4) còn được gọi là hydro sunfat.
-
Tại sao axit axetic còn được gọi là axit etanoic?
Axit axetic (CH3COOH) có tên gọi IUPAC là axit etanoic, dựa trên danh pháp hệ thống của hóa học hữu cơ.
-
Làm thế nào để phân biệt axit mạnh và axit yếu qua tên gọi?
Thường thì tên gọi không trực tiếp chỉ ra độ mạnh của axit. Cần dựa vào kiến thức về hóa học hoặc tra cứu thông tin để biết độ mạnh của axit.
-
Tên gọi của các axit có oxi thường kết thúc bằng đuôi gì?
Tên gọi của các axit có nhiều oxi thường kết thúc bằng đuôi “-ic”, ví dụ: axit nitric (HNO3).
-
Axit photphoric có bao nhiêu tên gọi khác?
Axit photphoric (H3PO4) còn được gọi là axit orthophotphoric.
-
Tên gọi của axit carbonic là gì và nó có mạnh không?
Axit carbonic (H2CO3) là một axit yếu và thường được tạo ra khi CO2 hòa tan trong nước.
-
Axit nitric có ứng dụng gì quan trọng trong công nghiệp?
Axit nitric (HNO3) được sử dụng rộng rãi trong sản xuất phân bón, thuốc nổ và nhiều hợp chất hóa học khác.
-
Tại sao việc hiểu rõ tên gọi của axit lại quan trọng?
Hiểu rõ tên gọi giúp nhận biết, phân biệt và sử dụng axit một cách an toàn và hiệu quả trong các ứng dụng khác nhau.
-
Ở đâu có thể tìm hiểu thêm thông tin chi tiết về các loại axit và tên gọi của chúng?
Bạn có thể tìm hiểu thêm thông tin chi tiết tại các trang web chuyên về hóa học, sách giáo khoa, hoặc các nguồn tài liệu uy tín khác. Xe Tải Mỹ Đình cũng cung cấp thông tin hữu ích và đáng tin cậy về các hợp chất hóa học.
Tại Xe Tải Mỹ Đình, chúng tôi cam kết cung cấp những thông tin chính xác và hữu ích nhất về các loại xe tải và các kiến thức liên quan đến kỹ thuật, hóa học và đời sống. Hy vọng bài viết này đã giúp bạn hiểu rõ hơn về tên gọi của axit và những ứng dụng quan trọng của chúng.
Bạn vẫn còn thắc mắc về tên gọi và ứng dụng của axit? Hãy truy cập ngay XETAIMYDINH.EDU.VN hoặc liên hệ hotline 0247 309 9988 để được tư vấn và giải đáp mọi thắc mắc!
Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội.

