Bạn đang gặp khó khăn trong việc xác định Số Oxi Hoá Của No3 và muốn tìm hiểu sâu hơn về nó? Đừng lo lắng, XETAIMYDINH.EDU.VN sẽ giúp bạn giải đáp thắc mắc này một cách chi tiết và dễ hiểu nhất. Chúng tôi sẽ cung cấp thông tin về cấu tạo, tính chất hóa học, nguồn gốc phát sinh và những ứng dụng quan trọng của NO3. Qua bài viết này, bạn không chỉ nắm vững kiến thức về số oxi hoá mà còn hiểu rõ hơn về vai trò của nó trong nhiều lĩnh vực. Cùng khám phá những điều thú vị về NO3 ngay bây giờ nhé, từ đó mở ra những cơ hội mới trong công việc và học tập liên quan đến xe tải và các ứng dụng công nghiệp.
1. NO3 Là Gì Và Cấu Trúc Như Thế Nào?
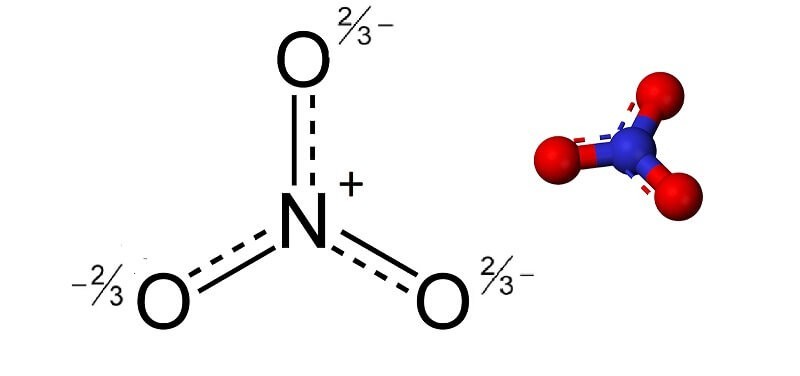
NO3 là gì và cấu trúc của nó ra sao? NO3, hay còn gọi là ion nitrat, là một anion đa nguyên tử bao gồm một nguyên tử nitơ (N) trung tâm liên kết với ba nguyên tử oxy (O) xung quanh. Ion nitrat có công thức hóa học là NO3-. Cấu trúc của ion nitrat là một mặt phẳng tam giác đều, với nguyên tử nitơ nằm ở trung tâm và ba nguyên tử oxy nằm ở ba đỉnh của tam giác. Tất cả các liên kết N-O đều có độ dài tương đương nhau và góc liên kết giữa chúng là 120 độ.
Ion nitrat là bazơ liên hợp của axit nitric (HNO3) và thường tồn tại trong các hợp chất muối nitrat. Các muối nitrat này rất phổ biến trong tự nhiên và có nhiều ứng dụng quan trọng trong nông nghiệp, công nghiệp và đời sống hàng ngày. Để hiểu rõ hơn về vai trò của NO3, chúng ta cần xem xét chi tiết cấu trúc và tính chất hóa học của nó.
 no3-hoa-tri-may-0
no3-hoa-tri-may-0
2. Số Oxi Hoá Của N Trong NO3 Là Bao Nhiêu?
Số oxi hoá của N trong NO3 là bao nhiêu và cách xác định như thế nào? Để xác định số oxi hoá của nitơ (N) trong ion nitrat (NO3-), ta cần tuân theo các quy tắc sau:
- Số oxi hoá của oxy (O) thường là -2.
- Tổng số oxi hoá của tất cả các nguyên tử trong một ion bằng điện tích của ion đó.
Trong ion NO3-, có một nguyên tử nitơ và ba nguyên tử oxy. Gọi số oxi hoá của nitơ là x, ta có phương trình:
x + 3(-2) = -1
Giải phương trình trên, ta được:
x – 6 = -1
x = +5
Vậy, số oxi hoá của nitơ (N) trong ion nitrat (NO3-) là +5. Điều này có nghĩa là nitơ đã nhường 5 electron trong quá trình hình thành ion nitrat. Việc xác định số oxi hoá này rất quan trọng để hiểu rõ các phản ứng hóa học mà NO3- tham gia.
3. Tại Sao Cần Xác Định Số Oxi Hoá Của NO3?
Tại sao việc xác định số oxi hoá của NO3 lại quan trọng và nó có ý nghĩa gì trong hóa học? Việc xác định số oxi hoá của NO3 và các nguyên tố trong ion nitrat là vô cùng quan trọng vì nó giúp chúng ta:
- Hiểu rõ bản chất các phản ứng oxy hóa – khử: Số oxi hoá cho biết mức độ oxy hóa của một nguyên tố trong hợp chất. Khi số oxi hoá thay đổi, ta có thể xác định được chất nào bị oxy hóa (tăng số oxi hoá) và chất nào bị khử (giảm số oxi hoá).
- Cân bằng phương trình hóa học: Xác định đúng số oxi hoá giúp cân bằng chính xác các phương trình phản ứng oxy hóa – khử, đảm bảo tuân thủ định luật bảo toàn electron và bảo toàn khối lượng.
- Dự đoán khả năng phản ứng: Số oxi hoá có thể giúp dự đoán khả năng tham gia phản ứng của một chất. Ví dụ, các chất có số oxi hoá cao thường có xu hướng nhận electron và ngược lại.
- Phân loại các hợp chất: Dựa vào số oxi hoá, ta có thể phân loại các hợp chất thành các nhóm khác nhau, ví dụ như các hợp chất chứa nitơ ở các trạng thái oxi hoá khác nhau (NH3, N2, NO, NO2, NO3-).
Tóm lại, việc xác định số oxi hoá của NO3 không chỉ là một bài toán hóa học mà còn là công cụ quan trọng để hiểu và dự đoán các quá trình hóa học diễn ra xung quanh chúng ta.
4. Hóa Trị Của NO3 Là Bao Nhiêu?
Hóa trị của NO3 là bao nhiêu và nó khác gì so với số oxi hoá? Hóa trị của NO3 là 1. Hóa trị là số liên kết mà một nguyên tử hoặc nhóm nguyên tử có thể tạo thành với các nguyên tử khác. Trong trường hợp ion nitrat (NO3-), nó mang một điện tích âm, cho thấy nó có khả năng tạo một liên kết ion với một ion dương khác.
Sự khác biệt giữa hóa trị và số oxi hoá:
- Hóa trị: Là một số nguyên dương biểu thị số liên kết mà một nguyên tử hoặc nhóm nguyên tử có thể tạo thành.
- Số oxi hoá: Là một số đại số (có thể dương, âm hoặc bằng không) biểu thị điện tích mà một nguyên tử sẽ có nếu tất cả các liên kết của nó là liên kết ion.
Trong ion nitrat, nitơ có số oxi hoá là +5, nhưng ion nitrat (NO3-) có hóa trị là 1, vì nó có thể kết hợp với một ion dương có điện tích +1 để tạo thành một hợp chất ổn định.
5. Nguồn Gốc Phát Sinh NO3 Trong Tự Nhiên?
NO3 phát sinh từ đâu trong tự nhiên và quá trình hình thành như thế nào? NO3 có thể phát sinh từ nhiều nguồn khác nhau trong tự nhiên, bao gồm:
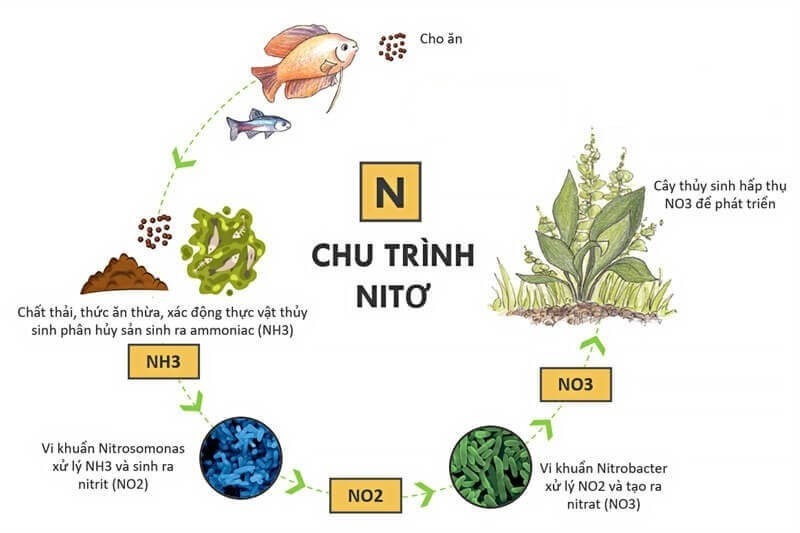
- Quá trình cố định nitơ: Các vi sinh vật trong đất có khả năng chuyển đổi nitơ tự do (N2) từ khí quyển thành các hợp chất chứa nitơ như amoniac (NH3). Sau đó, amoniac có thể bị oxy hóa thành nitrit (NO2-) và cuối cùng là nitrat (NO3-) thông qua quá trình nitrat hóa. Theo nghiên cứu của Trường Đại học Nông nghiệp Hà Nội, quá trình này đóng vai trò quan trọng trong việc cung cấp nitơ cho cây trồng (Nguồn: Khoa Nông học, Đại học Nông nghiệp Hà Nội, 2023).
- Phân hủy chất hữu cơ: Khi các chất hữu cơ như lá cây, xác động vật phân hủy, các hợp chất chứa nitơ trong chúng sẽ được giải phóng và chuyển đổi thành amoniac. Amoniac này sau đó cũng trải qua quá trình nitrat hóa để tạo thành NO3-.
- Sấm sét: Tia sét có thể cung cấp năng lượng để nitơ và oxy trong không khí kết hợp với nhau tạo thành oxit nitơ (NO). Oxit nitơ này sau đó có thể chuyển đổi thành NO2 và cuối cùng là NO3- khi hòa tan trong nước mưa.
- Hoạt động của con người: Các hoạt động nông nghiệp như sử dụng phân bón chứa nitơ, chăn nuôi gia súc cũng góp phần làm tăng lượng NO3- trong môi trường.
 no3-hoa-tri-may-4
no3-hoa-tri-may-4
6. Các Tính Chất Hóa Học Đặc Trưng Của NO3?
Những tính chất hóa học nào làm cho NO3 trở nên đặc biệt và quan trọng trong các phản ứng? NO3 có một số tính chất hóa học đặc trưng quan trọng:
-
Tính oxy hóa: Ion nitrat là một chất oxy hóa mạnh, đặc biệt trong môi trường axit. Nó có thể oxy hóa nhiều kim loại và hợp chất khác. Ví dụ, trong môi trường axit, NO3- có thể oxy hóa đồng (Cu) thành ion đồng (Cu2+).
3Cu + 2NO3- + 8H+ → 3Cu2+ + 2NO + 4H2O
-
Phản ứng nhiệt phân: Các muối nitrat có thể bị nhiệt phân để tạo ra các sản phẩm khác nhau tùy thuộc vào kim loại trong muối. Ví dụ:
-
Muối nitrat của kim loại kiềm (NaNO3, KNO3) bị nhiệt phân tạo ra muối nitrit và oxy:
2KNO3 → 2KNO2 + O2
-
Muối nitrat của kim loại kém hoạt động (AgNO3) bị nhiệt phân tạo ra kim loại, khí nitơ dioxit và oxy:
2AgNO3 → 2Ag + 2NO2 + O2
-
Muối nitrat của kim loại trung bình (Cu(NO3)2) bị nhiệt phân tạo ra oxit kim loại, khí nitơ dioxit và oxy:
2Cu(NO3)2 → 2CuO + 4NO2 + O2
-
-
Phản ứng với axit: Ion nitrat có thể phản ứng với axit để tạo ra axit nitric (HNO3), một axit mạnh có nhiều ứng dụng trong công nghiệp.
-
Tính tan: Hầu hết các muối nitrat đều tan tốt trong nước, điều này làm cho chúng dễ dàng di chuyển trong môi trường và tham gia vào các quá trình sinh học và hóa học.
7. Ứng Dụng Quan Trọng Của NO3 Trong Đời Sống Và Sản Xuất?
NO3 được ứng dụng như thế nào trong đời sống hàng ngày và trong các ngành sản xuất khác nhau? NO3 có rất nhiều ứng dụng quan trọng trong đời sống và sản xuất:
- Phân bón: Các muối nitrat như amoni nitrat (NH4NO3), kali nitrat (KNO3) và natri nitrat (NaNO3) được sử dụng rộng rãi làm phân bón trong nông nghiệp. Chúng cung cấp nguồn nitơ cần thiết cho sự phát triển của cây trồng, giúp tăng năng suất và chất lượng nông sản. Theo số liệu thống kê của Tổng cục Thống kê, việc sử dụng phân bón nitrat đã góp phần quan trọng vào sự tăng trưởng của ngành nông nghiệp Việt Nam (Nguồn: Tổng cục Thống kê, 2024).
- Chất bảo quản thực phẩm: Natri nitrat (NaNO3) và kali nitrat (KNO3) được sử dụng làm chất bảo quản trong các sản phẩm thịt chế biến như xúc xích, thịt xông khói. Chúng giúp ngăn chặn sự phát triển của vi khuẩn Clostridium botulinum, một loại vi khuẩn gây ngộ độc thực phẩm nguy hiểm.
- Thuốc nổ: Amoni nitrat (NH4NO3) là thành phần chính trong nhiều loại thuốc nổ sử dụng trong khai thác mỏ và xây dựng. Khi được kích nổ, nó phân hủy nhanh chóng tạo ra một lượng lớn khí và nhiệt, gây ra vụ nổ.
- Sản xuất axit nitric: NO3 là nguyên liệu quan trọng để sản xuất axit nitric (HNO3), một axit mạnh có nhiều ứng dụng trong công nghiệp hóa chất, sản xuất phân bón và thuốc nổ.
- Y học: Một số hợp chất chứa nitrat được sử dụng trong y học để điều trị các bệnh tim mạch. Chúng có tác dụng giãn mạch, giúp cải thiện lưu lượng máu và giảm huyết áp.
- Xử lý nước thải: Trong một số hệ thống xử lý nước thải, nitrat được sử dụng để loại bỏ các chất ô nhiễm hữu cơ thông qua quá trình khử nitrat hóa.
8. Ảnh Hưởng Của NO3 Đến Sức Khỏe Con Người Và Môi Trường?
NO3 có thể gây ra những tác động tiêu cực nào đến sức khỏe và môi trường xung quanh chúng ta? Mặc dù NO3 có nhiều ứng dụng hữu ích, nhưng nó cũng có thể gây ra những ảnh hưởng tiêu cực đến sức khỏe con người và môi trường nếu không được quản lý và sử dụng đúng cách:
-
Sức khỏe con người:
- Hội chứng Methemoglobinemia: Trẻ sơ sinh và trẻ nhỏ đặc biệt nhạy cảm với nitrat trong nước uống. Khi nitrat xâm nhập vào cơ thể, nó có thể chuyển đổi thành nitrit, chất này có thể oxy hóa hemoglobin trong máu thành methemoglobin, làm giảm khả năng vận chuyển oxy của máu. Điều này có thể gây ra tình trạng thiếu oxy, da xanh tím và thậm chí tử vong ở trẻ nhỏ.
- Nguy cơ ung thư: Một số nghiên cứu đã chỉ ra rằng việc tiêu thụ quá nhiều nitrat và nitrit có thể làm tăng nguy cơ mắc một số loại ung thư, đặc biệt là ung thư dạ dày và ung thư ruột kết. Tuy nhiên, cần có thêm nhiều nghiên cứu để xác nhận mối liên hệ này.
-
Môi trường:
- Ô nhiễm nguồn nước: Sự gia tăng nồng độ nitrat trong nước ngầm và nước mặt có thể gây ra ô nhiễm nguồn nước. Nitrat có thể xâm nhập vào nguồn nước từ phân bón nông nghiệp, nước thải sinh hoạt và công nghiệp.
- Eutrophication (Phú dưỡng): Khi nồng độ nitrat trong nước quá cao, nó có thể gây ra hiện tượng phú dưỡng, làm cho tảo và các loài thực vật thủy sinh phát triển quá mức. Sự phát triển này có thể làm cạn kiệt oxy trong nước, gây chết ngạt cho các loài động vật thủy sinh và làm suy thoái hệ sinh thái.
- Ô nhiễm không khí: Trong một số điều kiện nhất định, nitrat có thể chuyển đổi thành các oxit nitơ (NOx), là những chất gây ô nhiễm không khí và góp phần vào sự hình thành mưa axit và sương mù quang hóa.
 no3-hoa-tri-may-6
no3-hoa-tri-may-6
9. Các Biện Pháp Giảm Thiểu Tác Động Tiêu Cực Của NO3?
Làm thế nào để giảm thiểu những tác động xấu mà NO3 có thể gây ra cho sức khỏe và môi trường? Để giảm thiểu tác động tiêu cực của NO3 đến sức khỏe con người và môi trường, chúng ta có thể áp dụng một số biện pháp sau:
-
Quản lý sử dụng phân bón hợp lý:
- Sử dụng phân bón đúng liều lượng và thời điểm, tránh bón quá nhiều phân đạm.
- Sử dụng các loại phân bón có hiệu suất sử dụng nitơ cao, giúp giảm thiểu lượng nitrat thất thoát vào môi trường.
- Áp dụng các biện pháp canh tác bền vững như luân canh cây trồng, trồng cây che phủ để cải thiện khả năng hấp thụ nitơ của đất.
-
Xử lý nước thải hiệu quả:
- Xây dựng và vận hành các hệ thống xử lý nước thải sinh hoạt và công nghiệp đạt tiêu chuẩn, đảm bảo loại bỏ nitrat trước khi xả thải ra môi trường.
- Sử dụng các công nghệ xử lý nitrat tiên tiến như khử nitrat hóa sinh học, hấp phụ, trao đổi ion.
-
Kiểm soát ô nhiễm từ chăn nuôi:
- Xây dựng các hệ thống thu gom và xử lý chất thải chăn nuôi, ngăn chặn sự rò rỉ nitrat vào nguồn nước.
- Sử dụng các biện pháp giảm thiểu phát thải amoniac từ chuồng trại chăn nuôi.
-
Giám sát chất lượng nước:
- Thường xuyên kiểm tra và đánh giá chất lượng nước ngầm và nước mặt để phát hiện sớm các dấu hiệu ô nhiễm nitrat.
- Áp dụng các biện pháp xử lý nước uống để loại bỏ nitrat nếu nồng độ vượt quá tiêu chuẩn cho phép.
-
Nâng cao nhận thức cộng đồng:
- Tuyên truyền, giáo dục cộng đồng về tác hại của nitrat và các biện pháp giảm thiểu ô nhiễm nitrat.
- Khuyến khích người dân sử dụng nước sạch và thực phẩm an toàn, tuân thủ các quy định về sử dụng phân bón và xử lý chất thải.
10. Các Câu Hỏi Thường Gặp Về Số Oxi Hóa Của NO3 (FAQ)?
Dưới đây là một số câu hỏi thường gặp liên quan đến số oxi hóa của NO3, giúp bạn hiểu rõ hơn về vấn đề này:
Câu hỏi 1: Số oxi hóa của N trong NO3- luôn luôn là +5 phải không?
Đúng vậy, số oxi hóa của N trong ion nitrat (NO3-) luôn luôn là +5. Điều này là do cấu trúc và điện tích của ion nitrat, như đã giải thích ở phần trên.
Câu hỏi 2: Tại sao NO3- lại có tính oxi hóa?
NO3- có tính oxi hóa vì nitơ trong ion nitrat đang ở trạng thái oxi hóa cao nhất (+5). Do đó, nó có xu hướng nhận thêm electron để giảm số oxi hóa của mình, và quá trình này làm cho NO3- trở thành chất oxi hóa.
Câu hỏi 3: NO3- có thể bị khử thành những chất nào?
NO3- có thể bị khử thành nhiều chất khác nhau, tùy thuộc vào điều kiện phản ứng. Một số sản phẩm khử phổ biến của NO3- bao gồm:
- Nitrit (NO2-)
- Oxit nitric (NO)
- Nitơ oxit (N2O)
- Nitơ (N2)
- Amoniac (NH3)
Câu hỏi 4: Làm thế nào để phân biệt NO3- với các ion khác trong dung dịch?
Có nhiều phương pháp để phân biệt NO3- với các ion khác trong dung dịch, một trong số đó là sử dụng phản ứng với vụn đồng và axit sunfuric loãng. Khi đun nóng dung dịch chứa NO3- với vụn đồng và axit sunfuric loãng, sẽ tạo ra khí nitơ oxit (NO) không màu, hóa nâu trong không khí.
Câu hỏi 5: NO3- có vai trò gì trong chu trình nitơ?
NO3- đóng vai trò quan trọng trong chu trình nitơ, là sản phẩm cuối cùng của quá trình nitrat hóa và là nguồn cung cấp nitơ cho cây trồng. Nó cũng tham gia vào quá trình khử nitrat hóa, trong đó nitrat bị chuyển đổi thành khí nitơ và trả lại vào khí quyển.
Câu hỏi 6: Nồng độ NO3- bao nhiêu trong nước uống là an toàn?
Theo quy định của Tổ chức Y tế Thế giới (WHO), nồng độ nitrat trong nước uống không nên vượt quá 50 mg/l (tính theo NO3-) hoặc 10 mg/l (tính theo N).
Câu hỏi 7: Làm thế nào để loại bỏ NO3- khỏi nước uống?
Có nhiều phương pháp để loại bỏ NO3- khỏi nước uống, bao gồm:
- Đun sôi nước (chỉ giảm một phần nhỏ)
- Sử dụng hệ thống lọc nước có chứa than hoạt tính
- Sử dụng hệ thống trao đổi ion
- Sử dụng hệ thống thẩm thấu ngược (RO)
Câu hỏi 8: NO3- có ảnh hưởng đến xe tải và ngành vận tải không?
Mặc dù NO3- không trực tiếp ảnh hưởng đến xe tải và ngành vận tải, nhưng việc sử dụng phân bón chứa nitrat trong nông nghiệp có thể ảnh hưởng gián tiếp. Việc sản xuất và vận chuyển phân bón đòi hỏi sự tham gia của ngành vận tải, và các quy định về bảo vệ môi trường liên quan đến nitrat có thể ảnh hưởng đến hoạt động của các doanh nghiệp vận tải.
Câu hỏi 9: Làm thế nào để kiểm tra nồng độ NO3- trong đất?
Có nhiều phương pháp để kiểm tra nồng độ NO3- trong đất, bao gồm sử dụng bộ kiểm tra nhanh tại hiện trường hoặc gửi mẫu đất đến phòng thí nghiệm để phân tích.
Câu hỏi 10: Tại sao cần kiểm soát nồng độ NO3- trong đất nông nghiệp?
Việc kiểm soát nồng độ NO3- trong đất nông nghiệp là rất quan trọng để đảm bảo cung cấp đủ nitơ cho cây trồng, đồng thời giảm thiểu ô nhiễm môi trường và nguy cơ ảnh hưởng đến sức khỏe con người.
Bạn đang tìm kiếm thêm thông tin chi tiết và đáng tin cậy về xe tải ở Mỹ Đình? Hãy truy cập XETAIMYDINH.EDU.VN ngay hôm nay để khám phá những thông tin hữu ích nhất! Chúng tôi cung cấp thông tin chi tiết về các loại xe tải, so sánh giá cả và thông số kỹ thuật, tư vấn lựa chọn xe phù hợp, và giải đáp mọi thắc mắc liên quan đến thủ tục mua bán, đăng ký và bảo dưỡng xe tải. Đừng bỏ lỡ cơ hội được tư vấn và giải đáp mọi thắc mắc ngay lập tức. Liên hệ với chúng tôi ngay hôm nay để được hỗ trợ tốt nhất! Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội. Hotline: 0247 309 9988. Trang web: XETAIMYDINH.EDU.VN.