Quy tắc octet là một nguyên lý quan trọng trong hóa học, giúp dự đoán khả năng hình thành liên kết hóa học giữa các nguyên tử. Bạn muốn hiểu rõ hơn về quy tắc này, các ứng dụng và những trường hợp ngoại lệ của nó? Hãy cùng Xe Tải Mỹ Đình khám phá chi tiết ngay sau đây, đồng thời tìm hiểu cách quy tắc này giúp chúng ta hiểu rõ hơn về cấu trúc và tính chất của các phân tử.
1. Quy Tắc Octet Là Gì Và Tại Sao Nó Quan Trọng Trong Hóa Học?
Quy tắc octet, hay còn gọi là quy tắc bát tử, phát biểu rằng các nguyên tử có xu hướng liên kết với nhau để đạt được cấu hình electron bền vững với 8 electron ở lớp vỏ ngoài cùng, tương tự như khí hiếm. Theo nghiên cứu của Linus Pauling, người đoạt giải Nobel Hóa học, quy tắc octet là nền tảng để hiểu sự hình thành liên kết hóa học và cấu trúc phân tử.
-
Tại sao quy tắc octet quan trọng?
- Dự đoán khả năng liên kết: Quy tắc này giúp dự đoán liệu các nguyên tử có khả năng liên kết với nhau hay không.
- Giải thích tính chất hóa học: Nó giải thích tại sao một số hợp chất lại bền vững, trong khi những hợp chất khác lại dễ phản ứng.
- Xây dựng cấu trúc Lewis: Quy tắc octet là cơ sở để vẽ cấu trúc Lewis, mô tả sự phân bố electron trong phân tử.
- Ứng dụng trong thiết kế vật liệu: Các nhà khoa học sử dụng quy tắc octet để thiết kế các vật liệu mới với các tính chất mong muốn.
-
Cơ sở của quy tắc octet:
- Cấu hình electron bền vững: Các khí hiếm (trừ Heli) có 8 electron ở lớp vỏ ngoài cùng (ns²np⁶), tạo nên sự ổn định cao.
- Xu hướng đạt cấu hình bền vững: Các nguyên tử khác có xu hướng đạt được cấu hình electron này thông qua việc nhường, nhận hoặc góp chung electron.
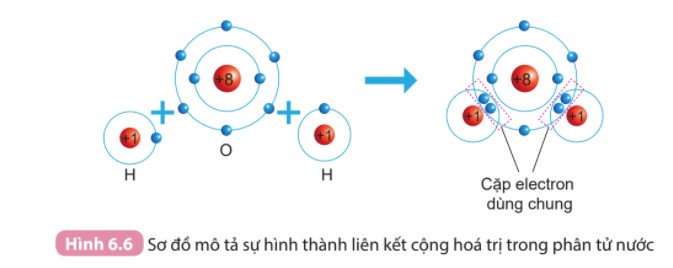 Mô hình cấu trúc electron của nguyên tử Oxy tuân theo quy tắc octet
Mô hình cấu trúc electron của nguyên tử Oxy tuân theo quy tắc octet
2. Lịch Sử Ra Đời Của Quy Tắc Octet?
Quy tắc octet không phải là một phát hiện đơn lẻ mà là kết quả của quá trình nghiên cứu và phát triển dần dần của các nhà khoa học vào đầu thế kỷ 20.
- Gilbert N. Lewis (1916): Đề xuất rằng các nguyên tử có xu hướng đạt được cấu hình electron giống như khí hiếm bằng cách chia sẻ electron. Ông cũng đưa ra khái niệm về liên kết cộng hóa trị.
- Walther Kossel (1916): Đề xuất một lý thuyết tương tự, tập trung vào sự hình thành ion bằng cách chuyển electron giữa các nguyên tử.
- Linus Pauling (những năm 1930): Phát triển lý thuyết liên kết hóa học hiện đại, trong đó quy tắc octet đóng vai trò quan trọng. Ông đưa ra khái niệm về độ âm điện và sử dụng nó để giải thích sự phân cực của liên kết.
3. Các Loại Liên Kết Hóa Học Tuân Theo Quy Tắc Octet?
Quy tắc octet thường được áp dụng cho hai loại liên kết hóa học chính:
-
Liên kết cộng hóa trị:
- Định nghĩa: Liên kết được hình thành do sự góp chung electron giữa các nguyên tử.
- Cơ chế: Các nguyên tử chia sẻ electron để đạt được cấu hình octet bền vững.
- Ví dụ: Liên kết trong phân tử nước (H₂O), methane (CH₄), carbon dioxide (CO₂).
-
Liên kết ion:
- Định nghĩa: Liên kết được hình thành do lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
- Cơ chế: Một nguyên tử nhường electron để trở thành cation (ion dương), và nguyên tử khác nhận electron để trở thành anion (ion âm). Cả hai ion đều đạt được cấu hình octet bền vững.
- Ví dụ: Liên kết trong natri clorua (NaCl), magie oxit (MgO).
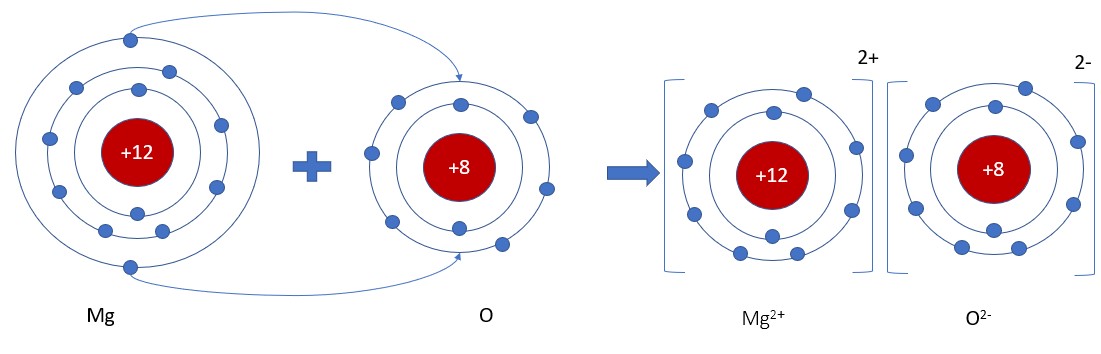 Sơ đồ hình thành liên kết ion trong phân tử NaCl, tuân theo quy tắc octet
Sơ đồ hình thành liên kết ion trong phân tử NaCl, tuân theo quy tắc octet
4. Các Bước Áp Dụng Quy Tắc Octet Để Vẽ Cấu Trúc Lewis?
Cấu trúc Lewis là một công cụ hữu ích để biểu diễn sự phân bố electron trong phân tử và giúp chúng ta hiểu rõ hơn về liên kết hóa học. Để vẽ cấu trúc Lewis dựa trên quy tắc octet, bạn có thể làm theo các bước sau:
- Bước 1: Xác định tổng số electron hóa trị: Cộng số electron hóa trị của tất cả các nguyên tử trong phân tử hoặc ion.
- Bước 2: Xác định nguyên tử trung tâm: Thường là nguyên tử có độ âm điện thấp hơn hoặc nguyên tử có khả năng tạo nhiều liên kết hơn.
- Bước 3: Vẽ liên kết đơn giữa nguyên tử trung tâm và các nguyên tử xung quanh: Mỗi liên kết đơn biểu diễn một cặp electron được chia sẻ.
- Bước 4: Phân phối các electron còn lại thành các cặp electron cô lập: Bắt đầu từ các nguyên tử xung quanh, sao cho mỗi nguyên tử (trừ hydro) có 8 electron xung quanh nó.
- Bước 5: Nếu nguyên tử trung tâm chưa có đủ 8 electron: Tạo liên kết bội (liên kết đôi hoặc liên kết ba) bằng cách chuyển các cặp electron cô lập từ các nguyên tử xung quanh.
- Bước 6: Kiểm tra điện tích hình thức: Tính điện tích hình thức của mỗi nguyên tử để xác định cấu trúc Lewis ưu việt nhất.
Ví dụ: Vẽ cấu trúc Lewis của CO₂
- Bước 1: C có 4 electron hóa trị, O có 6 electron hóa trị. Tổng số electron hóa trị = 4 + 2(6) = 16.
- Bước 2: C là nguyên tử trung tâm.
- Bước 3: Vẽ liên kết đơn giữa C và mỗi O (O-C-O). Sử dụng 4 electron.
- Bước 4: Phân phối 12 electron còn lại thành các cặp electron cô lập xung quanh mỗi O.
- Bước 5: C vẫn thiếu 4 electron. Tạo liên kết đôi giữa C và mỗi O (O=C=O).
- Bước 6: Kiểm tra điện tích hình thức. Cấu trúc này có điện tích hình thức bằng 0 cho tất cả các nguyên tử.
5. Các Trường Hợp Ngoại Lệ Của Quy Tắc Octet?
Mặc dù quy tắc octet rất hữu ích, nhưng nó không phải là một quy tắc tuyệt đối và có một số trường hợp ngoại lệ quan trọng:
-
Phân tử thiếu electron:
- Định nghĩa: Các phân tử trong đó nguyên tử trung tâm có ít hơn 8 electron xung quanh nó.
- Ví dụ: Boron trifluoride (BF₃), beryllium chloride (BeCl₂). Boron chỉ có 6 electron xung quanh nó trong BF₃.
- Giải thích: Các nguyên tử như B và Be có kích thước nhỏ và độ âm điện thấp, nên chúng không nhất thiết phải có 8 electron để đạt được sự ổn định.
-
Phân tử có số electron lẻ:
- Định nghĩa: Các phân tử có tổng số electron hóa trị là số lẻ.
- Ví dụ: Nitrogen monoxide (NO), chlorine dioxide (ClO₂).
- Giải thích: Trong các phân tử này, ít nhất một nguyên tử phải có một electron độc thân, không tuân theo quy tắc octet. Các phân tử này thường là các gốc tự do và có tính phản ứng cao.
-
Phân tử mở rộng octet:
- Định nghĩa: Các phân tử trong đó nguyên tử trung tâm có nhiều hơn 8 electron xung quanh nó.
- Ví dụ: Sulfur hexafluoride (SF₆), phosphorus pentachloride (PCl₅). Sulfur có 12 electron xung quanh nó trong SF₆.
- Giải thích: Điều này xảy ra với các nguyên tố ở chu kỳ 3 trở xuống, vì chúng có các orbital d trống có thể tham gia vào liên kết.
6. Ứng Dụng Thực Tế Của Quy Tắc Octet Trong Đời Sống Và Công Nghiệp?
Quy tắc octet không chỉ là một khái niệm lý thuyết mà còn có nhiều ứng dụng thực tế quan trọng trong đời sống và công nghiệp:
-
Thiết kế thuốc:
- Ứng dụng: Các nhà hóa học sử dụng quy tắc octet để thiết kế các phân tử thuốc có khả năng tương tác với các protein mục tiêu trong cơ thể.
- Ví dụ: Thiết kế các chất ức chế enzyme, các chất chủ vận hoặc đối kháng thụ thể.
-
Phát triển vật liệu mới:
- Ứng dụng: Quy tắc octet giúp dự đoán cấu trúc và tính chất của các vật liệu mới, từ đó tạo ra các vật liệu có tính chất đặc biệt như độ bền cao, khả năng dẫn điện tốt, hoặc khả năng hấp thụ ánh sáng.
- Ví dụ: Phát triển các loại polymer, vật liệu bán dẫn, vật liệu nano.
-
Tổng hợp hóa học:
- Ứng dụng: Các nhà hóa học sử dụng quy tắc octet để dự đoán sản phẩm của các phản ứng hóa học và tối ưu hóa quá trình tổng hợp.
- Ví dụ: Tổng hợp các hợp chất hữu cơ, các hợp chất vô cơ, các phức chất.
-
Nghiên cứu môi trường:
- Ứng dụng: Quy tắc octet giúp hiểu rõ hơn về cấu trúc và tính chất của các chất ô nhiễm trong môi trường, từ đó phát triển các phương pháp xử lý hiệu quả.
- Ví dụ: Nghiên cứu các chất gây hiệu ứng nhà kính, các chất gây ô nhiễm nguồn nước, các chất gây suy giảm tầng ozone.
-
Sản xuất phân bón:
- Ứng dụng: Hiểu rõ quy tắc octet giúp tối ưu hóa quá trình sản xuất các hợp chất phân bón, đảm bảo cung cấp đầy đủ dưỡng chất cho cây trồng.
- Ví dụ: Sản xuất phân đạm (NH₄NO₃), phân lân (Ca(H₂PO₄)₂), phân kali (KCl).
7. Mối Liên Hệ Giữa Quy Tắc Octet Và Độ Âm Điện?
Độ âm điện là khả năng của một nguyên tử hút electron về phía nó trong một liên kết hóa học. Độ âm điện có vai trò quan trọng trong việc xác định loại liên kết hóa học và sự phân cực của liên kết.
-
Liên kết cộng hóa trị:
- Không cực: Khi hai nguyên tử có độ âm điện tương đương liên kết với nhau, electron được chia sẻ đều và liên kết không cực.
- Có cực: Khi hai nguyên tử có độ âm điện khác nhau, electron bị hút lệch về phía nguyên tử có độ âm điện lớn hơn, tạo ra một liên kết có cực.
-
Liên kết ion:
- Khi độ âm điện giữa hai nguyên tử rất lớn, electron sẽ bị chuyển hoàn toàn từ nguyên tử này sang nguyên tử khác, tạo thành ion và hình thành liên kết ion.
-
Ảnh hưởng đến quy tắc octet:
- Độ âm điện ảnh hưởng đến khả năng của một nguyên tử trong việc đạt được cấu hình octet bền vững. Các nguyên tử có độ âm điện cao có xu hướng hút electron để đạt được octet, trong khi các nguyên tử có độ âm điện thấp có xu hướng nhường electron.
8. So Sánh Quy Tắc Octet Với Các Quy Tắc Hóa Học Khác?
Ngoài quy tắc octet, còn có một số quy tắc khác trong hóa học giúp giải thích sự hình thành liên kết và cấu trúc phân tử. Dưới đây là so sánh giữa quy tắc octet và một số quy tắc phổ biến khác:
| Quy tắc | Mô tả | Ưu điểm | Nhược điểm |
|---|---|---|---|
| Quy tắc octet | Các nguyên tử có xu hướng đạt được 8 electron ở lớp vỏ ngoài cùng để đạt được cấu hình bền vững. | Đơn giản, dễ áp dụng, giải thích được nhiều trường hợp liên kết. | Có nhiều trường hợp ngoại lệ, không giải thích được các phân tử mở rộng octet. |
| Quy tắc duet | Hydro và các nguyên tố nhẹ khác có xu hướng đạt được 2 electron ở lớp vỏ ngoài cùng. | Giải thích được sự ổn định của các phân tử chứa hydro. | Không áp dụng được cho các nguyên tố nặng hơn. |
| Thuyết VSEPR | Các cặp electron xung quanh nguyên tử trung tâm đẩy nhau và sắp xếp sao cho khoảng cách giữa chúng là lớn nhất. | Dự đoán được hình dạng phân tử một cách chính xác. | Không giải thích được sự hình thành liên kết. |
| Thuyết MO | Các electron được phân bố trong các orbital phân tử, là sự kết hợp của các orbital nguyên tử. | Giải thích được các tính chất phức tạp của phân tử, như tính từ và năng lượng liên kết. | Phức tạp, khó áp dụng cho các phân tử lớn. |
| Lý thuyết VB | Liên kết hóa học được hình thành do sự xen phủ của các orbital nguyên tử. | Giải thích được sự hình thành liên kết sigma và pi. | Khó áp dụng cho các phân tử phức tạp, không giải thích được tính chất từ của phân tử một cách đầy đủ. |
9. Giải Thích Quy Tắc Octet Dưới Góc Độ Năng Lượng?
Từ góc độ năng lượng, quy tắc octet có thể được giải thích như sau:
- Trạng thái năng lượng thấp: Các nguyên tử có cấu hình electron giống như khí hiếm có trạng thái năng lượng thấp nhất, tức là bền vững nhất.
- Xu hướng giảm năng lượng: Các nguyên tử có xu hướng liên kết với nhau để đạt được cấu hình electron bền vững này, do đó làm giảm năng lượng tổng thể của hệ thống.
- Liên kết hóa học: Quá trình hình thành liên kết hóa học giải phóng năng lượng, làm cho hệ thống trở nên ổn định hơn. Năng lượng giải phóng này được gọi là năng lượng liên kết.
- Ví dụ: Khi natri (Na) và clo (Cl) phản ứng với nhau để tạo thành natri clorua (NaCl), natri nhường một electron cho clo, tạo thành các ion Na⁺ và Cl⁻. Cả hai ion này đều có cấu hình electron octet bền vững. Quá trình này giải phóng một lượng lớn năng lượng, làm cho NaCl trở thành một hợp chất rất bền vững.
10. Các Câu Hỏi Thường Gặp Về Quy Tắc Octet (FAQ)?
-
Câu hỏi 1: Quy tắc octet có áp dụng cho tất cả các nguyên tố không?
- Trả lời: Không, quy tắc octet không áp dụng cho tất cả các nguyên tố. Nó thường áp dụng tốt nhất cho các nguyên tố ở chu kỳ 2 và 3 của bảng tuần hoàn.
-
Câu hỏi 2: Tại sao hydro chỉ cần 2 electron để đạt được cấu hình bền vững?
- Trả lời: Hydro chỉ có một orbital 1s, orbital này chỉ có thể chứa tối đa 2 electron. Khi có 2 electron, hydro đạt được cấu hình electron giống như heli, là một khí hiếm bền vững.
-
Câu hỏi 3: Điện tích hình thức là gì và tại sao nó quan trọng trong việc vẽ cấu trúc Lewis?
- Trả lời: Điện tích hình thức là điện tích mà một nguyên tử sẽ có nếu tất cả các electron liên kết được chia sẻ đều giữa các nguyên tử. Nó giúp xác định cấu trúc Lewis ưu việt nhất, là cấu trúc có điện tích hình thức nhỏ nhất trên tất cả các nguyên tử.
-
Câu hỏi 4: Làm thế nào để xác định nguyên tử trung tâm trong một phân tử?
- Trả lời: Nguyên tử trung tâm thường là nguyên tử có độ âm điện thấp hơn hoặc nguyên tử có khả năng tạo nhiều liên kết hơn. Trong nhiều trường hợp, nó cũng là nguyên tử ít xuất hiện nhất trong công thức phân tử.
-
Câu hỏi 5: Quy tắc octet có thể giúp dự đoán hình dạng của phân tử không?
- Trả lời: Không trực tiếp, nhưng nó là cơ sở để áp dụng thuyết VSEPR (Valence Shell Electron Pair Repulsion), giúp dự đoán hình dạng phân tử dựa trên sự đẩy nhau giữa các cặp electron xung quanh nguyên tử trung tâm.
-
Câu hỏi 6: Tại sao một số phân tử lại mở rộng octet?
- Trả lời: Các nguyên tố ở chu kỳ 3 trở xuống có các orbital d trống có thể tham gia vào liên kết, cho phép chúng có nhiều hơn 8 electron xung quanh.
-
Câu hỏi 7: Quy tắc octet có liên quan gì đến tính chất hóa học của một chất?
- Trả lời: Quy tắc octet giúp giải thích tính chất hóa học của một chất bằng cách dự đoán khả năng tạo liên kết và độ bền của các liên kết đó. Các chất có cấu trúc bền vững, tuân theo quy tắc octet thường ít phản ứng hơn.
-
Câu hỏi 8: Có phần mềm nào giúp vẽ cấu trúc Lewis và kiểm tra quy tắc octet không?
- Trả lời: Có, nhiều phần mềm hóa học như ChemDraw, MarvinSketch và các công cụ trực tuyến như VSEPR Model Explorer có thể giúp bạn vẽ cấu trúc Lewis và kiểm tra quy tắc octet.
-
Câu hỏi 9: Tại sao quy tắc octet lại quan trọng trong việc thiết kế thuốc?
- Trả lời: Quy tắc octet giúp các nhà hóa học hiểu rõ hơn về cấu trúc và tính chất của các phân tử thuốc, từ đó thiết kế các phân tử có khả năng tương tác với các protein mục tiêu trong cơ thể một cách hiệu quả.
-
Câu hỏi 10: Làm thế nào để học tốt hơn về quy tắc octet và các khái niệm liên quan?
- Trả lời: Bạn có thể tham khảo sách giáo trình hóa học, các trang web giáo dục uy tín, và các khóa học trực tuyến. Thực hành vẽ cấu trúc Lewis và giải các bài tập liên quan cũng là một cách hiệu quả để nắm vững kiến thức.
Bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải ở Mỹ Đình? XETAIMYDINH.EDU.VN là nguồn tài nguyên bạn không thể bỏ qua. Chúng tôi cung cấp thông tin cập nhật về các loại xe tải, so sánh giá cả, tư vấn lựa chọn xe phù hợp và giải đáp mọi thắc mắc liên quan đến thủ tục mua bán, đăng ký và bảo dưỡng xe tải.
Liên hệ ngay với Xe Tải Mỹ Đình để được tư vấn và giải đáp mọi thắc mắc!
- Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội
- Hotline: 0247 309 9988
- Trang web: XETAIMYDINH.EDU.VN
Hãy để Xe Tải Mỹ Đình giúp bạn đưa ra quyết định thông minh nhất cho nhu cầu vận tải của bạn!