Nh3 Có Tính Oxi Hóa Không? Câu trả lời ngắn gọn là có, nhưng rất yếu và không đáng kể so với tính khử mạnh của nó. Cùng Xe Tải Mỹ Đình tìm hiểu chi tiết về tính chất đặc biệt này của amoniac và những ứng dụng thực tế trong ngành vận tải nhé. Bài viết này sẽ cung cấp cho bạn cái nhìn toàn diện về amoniac, từ đó giúp bạn hiểu rõ hơn về các ứng dụng tiềm năng của nó trong ngành xe tải.
1. Amoniac (NH3) Là Gì?
Amoniac là một hợp chất vô cơ với công thức phân tử NH3, bao gồm một nguyên tử nitơ (N) liên kết với ba nguyên tử hydro (H). Ở điều kiện thường, amoniac là một chất khí không màu, có mùi khai đặc trưng và tan nhiều trong nước.
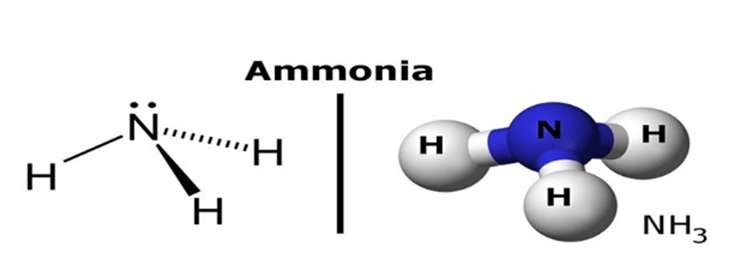 Công thức cấu tạo của amoniac NH3 với liên kết cộng hóa trị phân cực, thể hiện tính bazơ do cặp electron tự do trên nitơ
Công thức cấu tạo của amoniac NH3 với liên kết cộng hóa trị phân cực, thể hiện tính bazơ do cặp electron tự do trên nitơ
1.1. Cấu Trúc Phân Tử Amoniac
Phân tử NH3 có cấu trúc hình chóp tam giác, với nguyên tử nitơ ở đỉnh và ba nguyên tử hydro ở đáy. Do sự khác biệt về độ âm điện giữa nitơ và hydro, các liên kết N-H là liên kết cộng hóa trị phân cực, tạo ra một phần điện tích âm trên nitơ và một phần điện tích dương trên hydro. Nguyên tử nitơ còn có một cặp electron tự do, đây là nguyên nhân chính gây ra tính bazơ của amoniac.
2. Tính Chất Vật Lý Của Amoniac
Amoniac có những tính chất vật lý đặc trưng sau:
- Trạng thái: Khí không màu ở điều kiện thường.
- Mùi: Mùi khai đặc trưng, nồng độ cao có thể gây khó chịu và nguy hiểm.
- Độ tan: Tan rất tốt trong nước, tạo thành dung dịch amoniac (NH4OH).
- Tính hóa lỏng: Dễ hóa lỏng ở nhiệt độ thấp và áp suất cao.
- Khối lượng riêng: Nhẹ hơn không khí.
 Hình ảnh bình chứa amoniac lỏng, minh họa tính chất dễ hóa lỏng và khả năng ứng dụng trong làm lạnh
Hình ảnh bình chứa amoniac lỏng, minh họa tính chất dễ hóa lỏng và khả năng ứng dụng trong làm lạnh
3. Tính Chất Hóa Học Của Amoniac: Oxi Hóa, Khử và Bazơ
Amoniac có ba tính chất hóa học chính: tính bazơ yếu, tính khử mạnh và tính oxi hóa rất yếu.
3.1. Tính Bazơ Yếu Của Amoniac
Do có cặp electron tự do trên nguyên tử nitơ, amoniac có khả năng nhận proton (H+) từ axit, thể hiện tính bazơ. Tuy nhiên, tính bazơ của amoniac yếu hơn so với các bazơ mạnh như NaOH hay KOH.
-
Phản ứng với nước:
NH3 + H2O ⇌ NH4+ + OH-
Dung dịch amoniac làm quỳ tím chuyển sang màu xanh và phenolphtalein chuyển sang màu hồng.
-
Phản ứng với axit:
NH3 + HCl → NH4Cl (khói trắng)
3.2. Tính Khử Mạnh Của Amoniac
Trong phân tử NH3, nitơ có số oxi hóa thấp nhất là -3, do đó amoniac có tính khử mạnh, dễ bị oxi hóa thành các hợp chất khác.
-
Phản ứng với oxi:
-
Khi đốt cháy không có xúc tác:
4NH3 + 3O2 → 2N2 + 6H2O
-
Khi đốt cháy có xúc tác Pt, nhiệt độ cao:
4NH3 + 5O2 → 4NO + 6H2O
Phản ứng này là cơ sở của quá trình sản xuất axit nitric trong công nghiệp.
-
-
Phản ứng với clo:
8NH3 + 3Cl2 → N2 + 6NH4Cl
-
Phản ứng với oxit kim loại:
3CuO + 2NH3 → 3Cu + N2 + 3H2O
3.3. NH3 Có Tính Oxi Hóa Không?
Như đã đề cập, NH3 có tính oxi hóa, nhưng rất yếu. Tính oxi hóa của amoniac chỉ thể hiện trong một số ít trường hợp đặc biệt, khi nó tác dụng với các kim loại mạnh ở nhiệt độ cao. Trong các phản ứng này, nitơ trong NH3 nhận electron để giảm số oxi hóa.
-
Phản ứng với kim loại mạnh (ví dụ: Natri, Kali):
2Na + 2NH3 → 2NaNH2 + H2
Trong phản ứng này, nitơ trong NH3 (số oxi hóa -3) nhận electron và chuyển thành NH2- (số oxi hóa -3), hydro bị oxi hóa thành H2. Tuy nhiên, phản ứng này chỉ xảy ra ở điều kiện khắc nghiệt và không phổ biến.
Kết luận: So với tính khử mạnh mẽ và tính bazơ đặc trưng, tính oxi hóa của NH3 là không đáng kể và ít được ứng dụng trong thực tế.
4. Ứng Dụng Quan Trọng Của Amoniac (NH3) Trong Thực Tế
Amoniac là một hợp chất hóa học quan trọng với nhiều ứng dụng rộng rãi trong các lĩnh vực khác nhau:
4.1. Sản Xuất Phân Bón
Đây là ứng dụng lớn nhất của amoniac, chiếm khoảng 80% tổng sản lượng amoniac trên toàn thế giới. Amoniac được sử dụng để sản xuất các loại phân đạm như ure [(NH2)2CO], amoni nitrat (NH4NO3), amoni sunfat [(NH4)2SO4],… Các loại phân này cung cấp nitơ, một dưỡng chất thiết yếu cho sự phát triển của cây trồng.
4.2. Sản Xuất Axit Nitric (HNO3)
Amoniac là nguyên liệu quan trọng trong quá trình sản xuất axit nitric, một hóa chất công nghiệp quan trọng được sử dụng để sản xuất phân bón, thuốc nổ, sợi tổng hợp và nhiều sản phẩm khác.
4.3. Sản Xuất Sợi Tổng Hợp
Amoniac được sử dụng trong sản xuất các loại sợi tổng hợp như nylon và rayon, được sử dụng rộng rãi trong ngành dệt may.
4.4. Chất Làm Lạnh
Amoniac lỏng được sử dụng làm chất làm lạnh trong các hệ thống làm lạnh công nghiệp lớn, như trong các nhà máy chế biến thực phẩm, kho lạnh và hệ thống điều hòa không khí trung tâm.
4.5. Xử Lý Nước
Amoniac được sử dụng để khử trùng nước và kiểm soát độ pH trong các hệ thống xử lý nước thải.
4.6. Trong Ngành Vận Tải và Xe Tải
- Chất khử NOx trong khí thải động cơ diesel: Amoniac được sử dụng trong hệ thống xử lý khí thải của động cơ diesel (SCR – Selective Catalytic Reduction) để khử các oxit nitơ (NOx), là các chất gây ô nhiễm không khí.
- Nhiên liệu tiềm năng: Amoniac đang được nghiên cứu như một loại nhiên liệu thay thế cho động cơ đốt trong và pin nhiên liệu, đặc biệt là trong lĩnh vực vận tải biển và xe tải hạng nặng, nhằm giảm phát thải khí nhà kính.
5. Amoniac (NH3) trong Xe Tải: Giải Pháp Xanh Cho Vận Tải Bền Vững
Với những ưu điểm vượt trội về khả năng giảm phát thải và tiềm năng thay thế nhiên liệu hóa thạch, amoniac đang ngày càng được quan tâm trong ngành xe tải.
5.1. Amoniac – Giải Pháp Thay Thế Diesel Tiềm Năng
Trong bối cảnh giá nhiên liệu tăng cao và các quy định về khí thải ngày càng khắt khe, amoniac nổi lên như một ứng cử viên sáng giá để thay thế dầu diesel trong tương lai.
- Ưu điểm của amoniac:
- Giảm phát thải: Khi đốt cháy, amoniac không tạo ra khí CO2, góp phần giảm hiệu ứng nhà kính.
- Nguồn cung dồi dào: Amoniac có thể được sản xuất từ các nguồn năng lượng tái tạo như điện gió và điện mặt trời, đảm bảo nguồn cung bền vững.
- Hiệu suất cao: Động cơ amoniac có thể đạt hiệu suất tương đương với động cơ diesel.
- Thách thức:
- Độc tính: Amoniac là chất độc hại, cần có biện pháp an toàn trong quá trình vận chuyển và sử dụng.
- Phát thải NOx: Động cơ amoniac có thể phát thải NOx, cần có hệ thống xử lý khí thải hiệu quả.
- Hạ tầng: Cần xây dựng hạ tầng sản xuất, lưu trữ và phân phối amoniac.
5.2. Ứng Dụng Thực Tế Của Amoniac Trong Ngành Xe Tải
- Động cơ đốt trong sử dụng amoniac: Các nhà sản xuất động cơ đang nghiên cứu và phát triển động cơ đốt trong sử dụng amoniac làm nhiên liệu.
- Pin nhiên liệu amoniac: Pin nhiên liệu amoniac có thể chuyển đổi trực tiếp amoniac thành điện năng, cung cấp năng lượng cho xe tải điện.
- Hệ thống SCR cải tiến: Nghiên cứu cải tiến hệ thống SCR để sử dụng hiệu quả hơn amoniac trong việc khử NOx.
Theo nghiên cứu của Trường Đại học Bách Khoa Hà Nội, việc sử dụng amoniac làm nhiên liệu cho xe tải có thể giảm tới 90% lượng khí thải CO2 so với dầu diesel.
6. So Sánh Tính Chất Hóa Học Giữa Amoniac (NH3) và Các Hợp Chất Khác
Để hiểu rõ hơn về tính chất hóa học của amoniac, chúng ta hãy so sánh nó với một số hợp chất khác:
| Tính Chất | Amoniac (NH3) | Nước (H2O) | Metan (CH4) |
|---|---|---|---|
| Công thức hóa học | NH3 | H2O | CH4 |
| Tính bazơ | Yếu | Rất yếu | Không |
| Tính khử | Mạnh | Rất yếu | Mạnh |
| Tính oxi hóa | Rất yếu | Mạnh (oxi) | Mạnh (oxi) |
| Độ phân cực | Phân cực | Phân cực | Không phân cực |
Nhận xét:
- Amoniac có tính bazơ mạnh hơn nước và không có tính bazơ như metan.
- Amoniac và metan đều có tính khử, nhưng amoniac có tính khử chọn lọc hơn.
- Tính oxi hóa của amoniac rất yếu so với nước (oxi) và metan (oxi).
7. Những Lưu Ý Quan Trọng Khi Sử Dụng Amoniac (NH3)
Amoniac là một hóa chất có tính ăn mòn và độc hại, do đó cần tuân thủ các biện pháp an toàn sau khi sử dụng:
- Sử dụng thiết bị bảo hộ: Đeo kính bảo hộ, găng tay và quần áo bảo hộ khi tiếp xúc với amoniac.
- Thông gió tốt: Làm việc trong khu vực thông gió tốt để tránh hít phải khí amoniac.
- Tránh tiếp xúc với da và mắt: Nếu amoniac tiếp xúc với da hoặc mắt, rửa ngay lập tức bằng nhiều nước và đến cơ sở y tế gần nhất.
- Bảo quản đúng cách: Bảo quản amoniac trong thùng chứa kín, ở nơi khô ráo, thoáng mát và tránh xa nguồn nhiệt và chất dễ cháy.
- Xử lý sự cố: Trong trường hợp rò rỉ amoniac, sử dụng mặt nạ phòng độc và sơ tán người khỏi khu vực nguy hiểm.
8. Câu Hỏi Thường Gặp Về Amoniac (NH3) (FAQ)
-
NH3 có độc không?
Có, NH3 là chất độc hại, có thể gây kích ứng da, mắt và đường hô hấp. Nồng độ cao có thể gây bỏng và tử vong.
-
NH3 tác dụng với chất nào?
NH3 tác dụng với nước, axit, oxi, clo, oxit kim loại và một số kim loại mạnh.
-
NH3 được điều chế như thế nào?
Trong công nghiệp, NH3 được điều chế bằng phản ứng Haber-Bosch giữa nitơ và hydro ở nhiệt độ và áp suất cao, có xúc tác.
-
NH3 có làm cháy được không?
Có, NH3 có thể cháy trong oxi, tạo ra nitơ và nước.
-
NH3 có tác dụng gì trong nông nghiệp?
NH3 là nguyên liệu để sản xuất các loại phân đạm, cung cấp nitơ cho cây trồng.
-
NH3 có ăn mòn kim loại không?
NH3 có thể ăn mòn một số kim loại, đặc biệt là đồng và kẽm, khi có mặt hơi ẩm.
-
NH3 có ảnh hưởng đến môi trường không?
NH3 có thể gây ô nhiễm môi trường nếu không được sử dụng và xử lý đúng cách. Nó có thể gây mưa axit và phú dưỡng nguồn nước.
-
NH3 có thể dùng làm nhiên liệu cho xe tải không?
Có, NH3 đang được nghiên cứu và phát triển như một loại nhiên liệu thay thế cho xe tải, giúp giảm phát thải khí nhà kính.
-
Tại sao NH3 lại có mùi khai?
Mùi khai của NH3 là do các phân tử NH3 bay hơi và kích thích các thụ thể khứu giác trong mũi.
-
NH3 có tính axit hay bazơ?
NH3 có tính bazơ yếu.
9. Tại Sao Nên Tìm Hiểu Về Xe Tải Tại XETAIMYDINH.EDU.VN?
Bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải ở Mỹ Đình, Hà Nội? Hãy truy cập ngay XETAIMYDINH.EDU.VN! Chúng tôi cung cấp:
- Thông tin đa dạng: Cập nhật đầy đủ về các loại xe tải, giá cả, thông số kỹ thuật, địa điểm mua bán và dịch vụ sửa chữa uy tín.
- Tư vấn chuyên nghiệp: Đội ngũ chuyên gia giàu kinh nghiệm sẵn sàng tư vấn và giải đáp mọi thắc mắc của bạn.
- Tin tức mới nhất: Cập nhật liên tục về thị trường xe tải, các quy định mới và công nghệ tiên tiến.
10. Lời Kêu Gọi Hành Động (CTA)
Bạn còn bất kỳ thắc mắc nào về xe tải ở Mỹ Đình? Đừng ngần ngại liên hệ với Xe Tải Mỹ Đình ngay hôm nay!
- Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội.
- Hotline: 0247 309 9988
- Trang web: XETAIMYDINH.EDU.VN
Hãy để Xe Tải Mỹ Đình đồng hành cùng bạn trên mọi nẻo đường! Chúng tôi cam kết mang đến cho bạn những thông tin chính xác và hữu ích nhất, giúp bạn đưa ra quyết định sáng suốt khi lựa chọn xe tải phù hợp.