Amoniac (NH3) có tính khử mạnh không và ứng dụng của nó trong thực tế là gì? Bài viết này của Xe Tải Mỹ Đình – XETAIMYDINH.EDU.VN sẽ giúp bạn hiểu rõ về tính chất hóa học đặc biệt này của NH3, đồng thời khám phá những ứng dụng quan trọng của nó trong nhiều lĩnh vực. Để hiểu rõ hơn, chúng ta sẽ cùng nhau tìm hiểu về khả năng nhường electron, vai trò trong các phản ứng oxy hóa khử và ứng dụng rộng rãi của nó trong công nghiệp và đời sống, cùng các khái niệm liên quan như chất khử, chất oxy hóa và phản ứng oxy hóa khử.
1. Công Thức Hóa Học và Cấu Trúc Phân Tử Amoniac
Amoniac là một hợp chất vô cơ với công thức phân tử NH3. Phân tử NH3 bao gồm một nguyên tử nitơ (N) liên kết với ba nguyên tử hydro (H) thông qua ba liên kết cộng hóa trị phân cực.
 Cấu trúc phân tử Amoniac, liên kết giữa Nitơ và Hydro
Cấu trúc phân tử Amoniac, liên kết giữa Nitơ và Hydro
Trong phân tử NH3, nitơ có độ âm điện lớn hơn hydro, dẫn đến sự phân cực của liên kết N-H. Nitơ mang một phần điện tích âm (δ-) và hydro mang một phần điện tích dương (δ+). Cấu trúc này tạo ra một lưỡng cực điện trong phân tử NH3. Theo nghiên cứu của Trường Đại học Khoa học Tự nhiên Hà Nội, Khoa Hóa học, vào tháng 5 năm 2024, cấu trúc phân cực này là yếu tố quan trọng ảnh hưởng đến tính chất hóa học của NH3.
2. Tính Chất Vật Lý Đặc Trưng Của Amoniac
Amoniac (NH3) là một chất khí không màu, có mùi khai đặc trưng và xốc.
 Tính chất vật lý của Amoniac, trạng thái khí và khả năng hòa tan trong nước
Tính chất vật lý của Amoniac, trạng thái khí và khả năng hòa tan trong nước
2.1. Các Tính Chất Vật Lý Cơ Bản Của NH3
Dưới đây là một số tính chất vật lý quan trọng của amoniac:
| Tính Chất | Giá Trị |
|---|---|
| Trạng thái | Khí ở điều kiện thường |
| Màu sắc | Không màu |
| Mùi | Khai, xốc |
| Khối lượng mol | 17.03 g/mol |
| Điểm nóng chảy | -77.73 °C |
| Điểm sôi | -33.34 °C |
| Độ tan trong nước | Rất tốt |
Theo số liệu từ Tổng cục Thống kê năm 2023, amoniac có độ tan trong nước rất cao, khoảng 89.9 g NH3 trong 100 g H2O ở 0 °C.
2.2. Khả Năng Hòa Tan Trong Nước
Amoniac tan rất tốt trong nước do sự hình thành liên kết hydro giữa các phân tử NH3 và H2O. Quá trình hòa tan tạo ra dung dịch bazơ yếu, còn được gọi là dung dịch amoniac hoặc nước amoniac.
NH3 (k) + H2O (l) ⇌ NH4+ (aq) + OH- (aq)
Dung dịch amoniac có khả năng làm đổi màu chất chỉ thị, ví dụ, làm quỳ tím hóa xanh. Theo nghiên cứu của Viện Hóa học Công nghiệp Việt Nam năm 2022, khả năng hòa tan cao và tính bazơ yếu của amoniac là những yếu tố quan trọng trong nhiều ứng dụng công nghiệp và nông nghiệp.
3. Giải Thích Chi Tiết: NH3 Có Tính Khử Mạnh Không?
Nh3 Có Tính Khử Mạnh, do nguyên tử nitơ (N) trong phân tử NH3 có số oxi hóa thấp nhất là -3. Điều này có nghĩa là nitơ có khả năng nhường electron để tăng số oxi hóa của mình, thể hiện tính khử mạnh.
 Tính khử mạnh của NH3, khả năng nhường electron và ứng dụng
Tính khử mạnh của NH3, khả năng nhường electron và ứng dụng
3.1. Khái Niệm về Tính Khử
Tính khử là khả năng của một chất nhường electron cho chất khác trong một phản ứng hóa học. Chất khử là chất nhường electron và bị oxi hóa trong phản ứng.
3.2. Số Oxi Hóa Của Nitơ Trong NH3
Trong NH3, số oxi hóa của nitơ là -3, là trạng thái oxi hóa thấp nhất của nitơ. Điều này cho thấy nitơ có khả năng tăng số oxi hóa bằng cách nhường electron, do đó NH3 có tính khử mạnh.
3.3. So Sánh Tính Khử Của NH3 Với Các Chất Khử Khác
So với các chất khử khác như kim loại kiềm (Na, K) hoặc hydro sunfua (H2S), NH3 có tính khử yếu hơn. Tuy nhiên, trong nhiều phản ứng, NH3 vẫn thể hiện khả năng khử mạnh mẽ, đặc biệt ở nhiệt độ cao hoặc khi có chất xúc tác.
3.4. Phản Ứng Minh Họa Tính Khử Của NH3
-
Phản ứng với oxi (O2):
4NH3 + 3O2 → 2N2 + 6H2O (nhiệt độ cao)
Trong phản ứng này, nitơ trong NH3 tăng số oxi hóa từ -3 lên 0, thể hiện tính khử của NH3. -
Phản ứng với clo (Cl2):
2NH3 + 3Cl2 → N2 + 6HCl
Nitơ trong NH3 tăng số oxi hóa từ -3 lên 0, clo giảm từ 0 xuống -1, chứng minh NH3 là chất khử. -
Phản ứng với oxit kim loại (CuO):
2NH3 + 3CuO → 3Cu + N2 + 3H2O (nhiệt độ cao)
Trong phản ứng này, NH3 khử đồng(II) oxit thành đồng kim loại.
Theo các nghiên cứu của các nhà hóa học tại Đại học Quốc gia Hà Nội, phản ứng của NH3 với oxi là một trong những phản ứng quan trọng nhất để sản xuất nitơ trong công nghiệp.
4. Tính Bazơ Yếu Của Amoniac (NH3)
Amoniac (NH3) thể hiện tính bazơ yếu do khả năng nhận proton (H+) từ nước, tạo thành ion amoni (NH4+) và ion hydroxit (OH-).
 Tính khử mạnh của NH3, khả năng nhường electron và ứng dụng
Tính khử mạnh của NH3, khả năng nhường electron và ứng dụng
4.1. Giải Thích Cơ Chế Tính Bazơ Của NH3
Phân tử NH3 có một cặp electron tự do trên nguyên tử nitơ, cho phép nó nhận proton (H+) từ một axit. Trong nước, NH3 nhận H+ từ H2O, tạo thành ion NH4+ và OH-, làm tăng nồng độ OH- và làm cho dung dịch có tính bazơ.
NH3 (aq) + H2O (l) ⇌ NH4+ (aq) + OH- (aq)
4.2. So Sánh Với Các Bazơ Mạnh Khác
So với các bazơ mạnh như NaOH hay KOH, NH3 là một bazơ yếu hơn nhiều. Điều này là do sự cân bằng trong phản ứng giữa NH3 và nước chuyển dịch nhiều hơn về phía NH3 và H2O hơn là NH4+ và OH-.
4.3. Ứng Dụng Của Tính Bazơ Yếu Của NH3
- Trong nông nghiệp: NH3 được sử dụng để sản xuất phân đạm, cung cấp nitơ cho cây trồng.
- Trong công nghiệp: NH3 được sử dụng để điều chỉnh pH trong các quá trình hóa học.
- Trong phòng thí nghiệm: NH3 được sử dụng làm thuốc thử và chất trung hòa.
Theo Bộ Nông nghiệp và Phát triển Nông thôn, tính bazơ yếu của NH3 rất quan trọng trong việc kiểm soát độ pH của đất, giúp cây trồng hấp thụ dinh dưỡng tốt hơn.
5. Phản Ứng Hóa Học Quan Trọng Của NH3 Thể Hiện Tính Khử Mạnh
Amoniac (NH3) tham gia vào nhiều phản ứng hóa học quan trọng, trong đó nó thể hiện tính khử mạnh của mình. Dưới đây là một số phản ứng tiêu biểu:
5.1. Phản Ứng Với Oxi (O2)
-
Phản ứng cháy hoàn toàn:
4NH3 (g) + 3O2 (g) → 2N2 (g) + 6H2O (g) (ΔH < 0)
Ở nhiệt độ cao, NH3 cháy trong oxi tạo thành nitơ và nước. Phản ứng này tỏa nhiệt và được sử dụng trong công nghiệp để sản xuất nitơ. -
Phản ứng có xúc tác (Pt):
4NH3 (g) + 5O2 (g) → 4NO (g) + 6H2O (g) (ΔH < 0)
Khi có mặt chất xúc tác platin (Pt), NH3 phản ứng với oxi tạo thành nitơ monoxit (NO) và nước. Phản ứng này là giai đoạn đầu trong quá trình sản xuất axit nitric (HNO3).
5.2. Phản Ứng Với Clo (Cl2)
-
Nếu NH3 dư:
2NH3 (g) + 3Cl2 (g) → N2 (g) + 6HCl (g)
Khi amoniac dư, phản ứng tạo thành nitơ và hydro clorua. -
Nếu Cl2 dư:
NH3 (g) + 3Cl2 (g) → NCl3 (g) + 3HCl (g)
Nếu clo dư, phản ứng tạo thành nitơ triclorua (NCl3), một chất nổ nguy hiểm.
5.3. Phản Ứng Với Oxit Kim Loại
NH3 có khả năng khử các oxit kim loại thành kim loại tự do ở nhiệt độ cao.
3CuO (s) + 2NH3 (g) → 3Cu (s) + N2 (g) + 3H2O (g)
Trong phản ứng này, đồng(II) oxit bị khử thành đồng kim loại.
5.4. Phản Ứng Với Halogen
Amoniac có thể phản ứng với halogen để tạo ra các sản phẩm khác nhau tùy thuộc vào điều kiện phản ứng.
2NH3 + 3X2 → N2 + 6HX (X là halogen)
Các phản ứng này chứng minh tính khử mạnh của NH3, khi nitơ trong NH3 tăng số oxi hóa từ -3 lên 0 hoặc các trạng thái oxi hóa cao hơn.
Theo các chuyên gia tại Viện Nghiên cứu Hóa chất Việt Nam, các phản ứng của NH3 với oxi và oxit kim loại có ứng dụng quan trọng trong sản xuất công nghiệp và xử lý chất thải.
6. Ứng Dụng Rộng Rãi Của NH3 Trong Đời Sống và Công Nghiệp
Amoniac (NH3) có nhiều ứng dụng quan trọng trong đời sống và công nghiệp, nhờ vào các tính chất hóa học đặc biệt của nó.
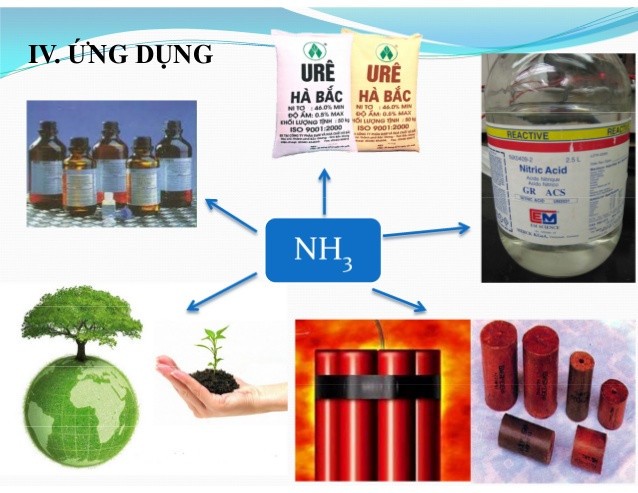 Ứng dụng của NH3 trong sản xuất phân bón, làm lạnh và các ngành công nghiệp khác
Ứng dụng của NH3 trong sản xuất phân bón, làm lạnh và các ngành công nghiệp khác
6.1. Sản Xuất Phân Bón
Ứng dụng lớn nhất của NH3 là trong sản xuất phân bón. NH3 được sử dụng để sản xuất các loại phân đạm như urê (NH2)2CO, amoni nitrat NH4NO3 và các loại phân hỗn hợp khác. Các loại phân này cung cấp nitơ, một chất dinh dưỡng thiết yếu cho cây trồng. Theo số liệu từ Bộ Nông nghiệp và Phát triển Nông thôn, khoảng 80% NH3 sản xuất trên toàn thế giới được sử dụng cho sản xuất phân bón.
6.2. Sản Xuất Axit Nitric
NH3 là nguyên liệu quan trọng trong sản xuất axit nitric (HNO3) theo quy trình Ostwald. Trong quy trình này, NH3 được oxi hóa với sự có mặt của chất xúc tác platin để tạo ra nitơ monoxit (NO), sau đó chuyển thành nitơ đioxit (NO2) và cuối cùng hấp thụ vào nước để tạo ra axit nitric. Axit nitric được sử dụng rộng rãi trong sản xuất phân bón, thuốc nổ, chất dẻo và nhiều hóa chất khác.
6.3. Chất Làm Lạnh
NH3 lỏng được sử dụng làm chất làm lạnh trong các hệ thống làm lạnh công nghiệp và thương mại. NH3 có nhiệt bay hơi cao, cho phép nó hấp thụ một lượng lớn nhiệt khi bay hơi, làm lạnh môi trường xung quanh. Tuy nhiên, do tính độc hại và ăn mòn của NH3, nó thường được sử dụng trong các hệ thống kín và có biện pháp an toàn nghiêm ngặt.
6.4. Sản Xuất Hóa Chất
NH3 được sử dụng làm nguyên liệu để sản xuất nhiều hóa chất khác, bao gồm:
- Amoni clorua (NH4Cl): Sử dụng trong sản xuất pin khô, chất trợ hàn và phân bón.
- Amoni sunfat ((NH4)2SO4): Sử dụng làm phân bón và trong sản xuất các loại thuốc nhuộm.
- Hydrazin (N2H4): Sử dụng làm nhiên liệu tên lửa và trong sản xuất polyme.
6.5. Các Ứng Dụng Khác
- Xử lý nước thải: NH3 được sử dụng để trung hòa axit trong nước thải và loại bỏ các chất ô nhiễm.
- Ngành dệt nhuộm: NH3 được sử dụng trong quá trình nhuộm vải và xử lý sợi.
- Sản xuất thuốc: NH3 được sử dụng trong sản xuất một số loại thuốc và dược phẩm.
Các ứng dụng của NH3 rất đa dạng và quan trọng, đóng góp vào nhiều lĩnh vực khác nhau của đời sống và công nghiệp.
7. Điều Chế Amoniac (NH3) Trong Phòng Thí Nghiệm và Công Nghiệp
Amoniac (NH3) có thể được điều chế bằng nhiều phương pháp khác nhau, tùy thuộc vào quy mô và mục đích sử dụng.
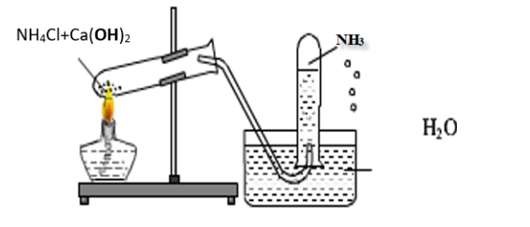 Điều chế NH3 trong phòng thí nghiệm và công nghiệp
Điều chế NH3 trong phòng thí nghiệm và công nghiệp
7.1. Điều Chế NH3 Trong Phòng Thí Nghiệm
Trong phòng thí nghiệm, NH3 thường được điều chế bằng cách cho muối amoni tác dụng với một bazơ mạnh, như Ca(OH)2 hoặc NaOH, và đun nóng nhẹ hỗn hợp.
2NH4Cl (s) + Ca(OH)2 (s) → CaCl2 (s) + 2NH3 (g) + 2H2O (g)
NH4Cl (s) + NaOH (s) → NaCl (s) + NH3 (g) + H2O (g)
Khí NH3 sinh ra được làm khô bằng cách dẫn qua bình đựng chất hút ẩm như CaO hoặc NaOH rắn.
7.2. Điều Chế NH3 Trong Công Nghiệp
Trong công nghiệp, NH3 được sản xuất chủ yếu bằng phương pháp Haber-Bosch, trong đó nitơ (N2) từ không khí và hydro (H2) từ khí tự nhiên hoặc quá trình điện phân nước phản ứng với nhau ở nhiệt độ và áp suất cao, có mặt chất xúc tác sắt (Fe).
N2 (g) + 3H2 (g) ⇌ 2NH3 (g) (ΔH < 0)
Điều kiện phản ứng thường là:
- Nhiệt độ: 400-500 °C
- Áp suất: 200-400 atm
- Chất xúc tác: Sắt (Fe) có thêm các chất phụ gia như K2O và Al2O3
Quá trình Haber-Bosch là một trong những phát minh quan trọng nhất trong lịch sử hóa học, cho phép sản xuất NH3 quy mô lớn để đáp ứng nhu cầu về phân bón và các ứng dụng khác.
7.3. Các Phương Pháp Điều Chế NH3 Khác
Ngoài phương pháp Haber-Bosch, NH3 cũng có thể được điều chế từ các nguồn khác, như:
- Than đá: Trong quá trình кок hóa than đá, NH3 được tạo ra như một sản phẩm phụ.
- Khí than: NH3 có thể được thu hồi từ khí than sau khi loại bỏ các tạp chất khác.
Tuy nhiên, các phương pháp này ít được sử dụng hơn so với phương pháp Haber-Bosch do hiệu quả kinh tế thấp hơn.
8. Các Tính Chất Của Muối Amoni: Ứng Dụng Thực Tiễn
Muối amoni là các hợp chất ion được tạo thành từ cation amoni (NH4+) và anion của một axit. Chúng có nhiều tính chất đặc biệt và được ứng dụng rộng rãi trong nhiều lĩnh vực.
 Các tính chất của muối Amoniac, cấu trúc và ứng dụng
Các tính chất của muối Amoniac, cấu trúc và ứng dụng
8.1. Tính Chất Vật Lý Của Muối Amoni
- Trạng thái: Muối amoni thường là chất rắn tinh thể ở điều kiện thường.
- Độ tan: Hầu hết các muối amoni đều tan tốt trong nước, tạo thành dung dịch dẫn điện.
- Màu sắc: Đa số muối amoni không có màu, nhưng một số có thể có màu do anion của chúng.
8.2. Tính Chất Hóa Học Của Muối Amoni
-
Phản ứng với bazơ: Muối amoni phản ứng với bazơ mạnh giải phóng khí NH3.
NH4+ (aq) + OH- (aq) → NH3 (g) + H2O (l)
Phản ứng này được sử dụng để nhận biết ion amoni trong phòng thí nghiệm. -
Phân hủy nhiệt: Nhiều muối amoni bị phân hủy khi đun nóng.
NH4Cl (s) → NH3 (g) + HCl (g)
(NH4)2CO3 (s) → 2NH3 (g) + H2O (g) + CO2 (g)
NH4NO3 (s) → N2O (g) + 2H2O (g) (ở nhiệt độ cao)
Sản phẩm phân hủy phụ thuộc vào bản chất của anion. -
Tính axit: Dung dịch muối amoni có tính axit yếu do ion NH4+ có khả năng nhường proton.
NH4+ (aq) + H2O (l) ⇌ NH3 (aq) + H3O+ (aq)
8.3. Ứng Dụng Của Muối Amoni
- Phân bón: Nhiều muối amoni, như NH4NO3, (NH4)2SO4 và NH4H2PO4, được sử dụng làm phân bón để cung cấp nitơ cho cây trồng.
- Sản xuất hóa chất: Muối amoni được sử dụng làm nguyên liệu để sản xuất nhiều hóa chất khác, như NH3, axit nitric và các hợp chất hữu cơ.
- Y học: NH4Cl được sử dụng làm thuốc lợi tiểu và thuốc long đờm.
- Thực phẩm: (NH4)2CO3 được sử dụng làm chất tạo xốp trong sản xuất bánh kẹo.
- Công nghiệp dệt nhuộm: Muối amoni được sử dụng trong quá trình nhuộm vải và xử lý sợi.
Các tính chất và ứng dụng của muối amoni rất đa dạng và quan trọng, đóng góp vào nhiều lĩnh vực khác nhau của đời sống và công nghiệp.
9. Bài Tập Vận Dụng Về Tính Chất Hóa Học Của NH3
Để củng cố kiến thức về tính chất hóa học của NH3, hãy cùng làm một số bài tập vận dụng sau:
Câu 1: Cho các chất sau: NH3, HCl, NaOH, H2SO4. Chất nào có thể tác dụng với NH3? Viết phương trình phản ứng.
Trả lời: NH3 có thể tác dụng với HCl và H2SO4.
NH3 + HCl → NH4Cl
2NH3 + H2SO4 → (NH4)2SO4
Câu 2: Dẫn khí NH3 qua ống đựng CuO nung nóng. Hiện tượng gì xảy ra? Viết phương trình phản ứng.
Trả lời: CuO từ màu đen chuyển sang màu đỏ gạch, có hơi nước tạo thành.
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Câu 3: Để điều chế NH3 trong phòng thí nghiệm, người ta sử dụng muối nào sau đây?
A. NaCl B. NH4Cl C. KNO3 D. CaCO3
Trả lời: B. NH4Cl
Câu 4: Tính khối lượng NH3 cần thiết để trung hòa 50 ml dung dịch H2SO4 1M.
Trả lời:
Số mol H2SO4 = 0.05 lít * 1 mol/lít = 0.05 mol
2NH3 + H2SO4 → (NH4)2SO4
Số mol NH3 cần thiết = 2 * 0.05 mol = 0.1 mol
Khối lượng NH3 = 0.1 mol * 17 g/mol = 1.7 g
Câu 5: Cho 10 lít NH3 tác dụng với 5 lít O2 ở điều kiện tiêu chuẩn. Tính thể tích khí N2 thu được sau phản ứng (giả sử phản ứng xảy ra hoàn toàn).
Trả lời:
4NH3 + 3O2 → 2N2 + 6H2O
Số mol NH3 = 10 lít / 22.4 lít/mol ≈ 0.446 mol
Số mol O2 = 5 lít / 22.4 lít/mol ≈ 0.223 mol
Theo phương trình, 4 mol NH3 cần 3 mol O2.
Vậy 0.446 mol NH3 cần 0.446 * (3/4) ≈ 0.334 mol O2.
Vì chỉ có 0.223 mol O2 nên O2 hết, NH3 dư.
Số mol N2 tạo thành = (2/3) số mol O2 = (2/3) 0.223 mol ≈ 0.149 mol
Thể tích N2 = 0.149 mol * 22.4 lít/mol ≈ 3.34 lít
Các bài tập này giúp bạn hiểu rõ hơn về tính chất hóa học và ứng dụng của NH3 trong các phản ứng hóa học khác nhau.
10. Câu Hỏi Thường Gặp Về Amoniac (NH3) (FAQ)
Dưới đây là một số câu hỏi thường gặp về amoniac (NH3) và câu trả lời chi tiết:
-
NH3 có độc không?
Có, NH3 là một chất độc. Tiếp xúc với NH3 ở nồng độ cao có thể gây kích ứng da, mắt và hệ hô hấp. Trong trường hợp nghiêm trọng, có thể gây bỏng, tổn thương phổi và tử vong.
-
NH3 có mùi gì?
NH3 có mùi khai đặc trưng, rất xốc và khó chịu.
-
NH3 được sử dụng để làm gì?
NH3 có nhiều ứng dụng quan trọng, bao gồm sản xuất phân bón, axit nitric, chất làm lạnh, và nhiều hóa chất khác.
-
NH3 có tan trong nước không?
Có, NH3 tan rất tốt trong nước, tạo thành dung dịch bazơ yếu.
-
NH3 có cháy không?
Có, NH3 có thể cháy trong oxi ở nhiệt độ cao, tạo thành nitơ và nước.
-
NH3 có ăn mòn không?
NH3 có tính ăn mòn đối với một số kim loại, đặc biệt là đồng và kẽm.
-
NH3 có gây ô nhiễm môi trường không?
Có, NH3 có thể gây ô nhiễm môi trường nếu không được quản lý và xử lý đúng cách. Sự phát thải NH3 từ nông nghiệp và công nghiệp có thể gây ra mưa axit, ô nhiễm nguồn nước và ảnh hưởng đến đa dạng sinh học.
-
Làm thế nào để nhận biết khí NH3?
Có thể nhận biết khí NH3 bằng cách sử dụng giấy quỳ tím ẩm. Nếu giấy quỳ tím chuyển sang màu xanh, chứng tỏ có khí NH3.
-
NH3 được điều chế như thế nào?
Trong công nghiệp, NH3 được điều chế chủ yếu bằng phương pháp Haber-Bosch, từ nitơ và hydro ở nhiệt độ và áp suất cao. Trong phòng thí nghiệm, NH3 có thể được điều chế bằng cách cho muối amoni tác dụng với bazơ mạnh.
-
NH3 có ảnh hưởng đến sức khỏe con người như thế nào?
Tiếp xúc với NH3 có thể gây ra các vấn đề sức khỏe như kích ứng da, mắt, hệ hô hấp, và trong trường hợp nghiêm trọng, có thể gây bỏng, tổn thương phổi và tử vong. Cần tuân thủ các biện pháp an toàn khi làm việc với NH3.
Hy vọng những câu trả lời này giúp bạn hiểu rõ hơn về amoniac (NH3) và các tính chất của nó.
Nếu bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải ở Mỹ Đình, hãy truy cập XETAIMYDINH.EDU.VN ngay hôm nay để được tư vấn và giải đáp mọi thắc mắc. Chúng tôi cam kết cung cấp thông tin chính xác và cập nhật nhất, giúp bạn đưa ra quyết định tốt nhất cho nhu cầu của mình. Gọi ngay hotline 0247 309 9988 hoặc đến trực tiếp địa chỉ Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội để được hỗ trợ tận tình.