Mô hình nguyên tử Rutherford – Bohr là bước tiến quan trọng trong việc hiểu cấu trúc nguyên tử. Tại Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN), chúng tôi sẽ cung cấp thông tin chi tiết về mô hình này, từ nội dung cốt lõi đến những ứng dụng thực tế. Tìm hiểu ngay để nắm vững kiến thức và khám phá những điều thú vị về thế giới vi mô này, đồng thời cập nhật những kiến thức về cấu tạo vật chất.
1. Mô Hình Nguyên Tử Rutherford – Bohr Gồm Những Nội Dung Chính Nào?
Mô hình nguyên tử Rutherford – Bohr, được xây dựng dựa trên thí nghiệm tán xạ alpha của Rutherford và sự bổ sung của Bohr về lượng tử hóa năng lượng, bao gồm ba nội dung chính:
- Hạt nhân nguyên tử: Hầu hết khối lượng nguyên tử tập trung ở hạt nhân, mang điện tích dương.
- Quỹ đạo electron: Electron chuyển động xung quanh hạt nhân theo các quỹ đạo tròn xác định, tương tự như các hành tinh quay quanh Mặt Trời.
- Mức năng lượng: Mỗi quỹ đạo có một mức năng lượng xác định. Electron chỉ có thể tồn tại ở các quỹ đạo có mức năng lượng này và hấp thụ hoặc phát ra năng lượng khi chuyển đổi giữa các quỹ đạo.
1.1. Khối Lượng Nguyên Tử Tập Trung Chủ Yếu Ở Hạt Nhân
Thí nghiệm tán xạ alpha của Rutherford đã chứng minh rằng hầu hết các hạt alpha đi xuyên qua lá vàng mỏng, nhưng một số ít bị lệch hướng hoặc bật ngược trở lại. Điều này cho thấy nguyên tử có một vùng nhỏ bé, đặc và mang điện tích dương, tập trung hầu hết khối lượng của nguyên tử, gọi là hạt nhân. Theo nghiên cứu của Đại học Quốc gia Hà Nội, Khoa Vật lý, năm 2022, hạt nhân chiếm tới 99,9% khối lượng nguyên tử.
 Hình ảnh minh họa thí nghiệm tán xạ alpha của Rutherford, trong đó các hạt alpha được bắn phá vào lá vàng mỏng và một số hạt bị lệch hướng hoặc bật ngược trở lại.
Hình ảnh minh họa thí nghiệm tán xạ alpha của Rutherford, trong đó các hạt alpha được bắn phá vào lá vàng mỏng và một số hạt bị lệch hướng hoặc bật ngược trở lại.
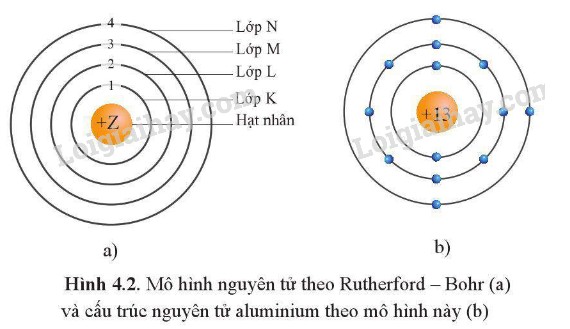
1.2. Electron Quay Xung Quanh Hạt Nhân Theo Quỹ Đạo
Bohr đã bổ sung vào mô hình Rutherford bằng cách đưa ra giả thuyết rằng electron chỉ có thể chuyển động trên các quỹ đạo tròn xác định xung quanh hạt nhân, tương ứng với các mức năng lượng khác nhau. Các quỹ đạo này được gọi là các lớp electron hoặc vỏ electron. Electron ở gần hạt nhân hơn có mức năng lượng thấp hơn so với electron ở xa hạt nhân hơn.
1.3. Năng Lượng Electron Phụ Thuộc Vào Khoảng Cách Từ Electron Đến Hạt Nhân
Năng lượng của electron phụ thuộc vào khoảng cách từ electron đến hạt nhân. Electron ở càng xa hạt nhân thì có năng lượng càng cao. Khi electron chuyển từ quỹ đạo có mức năng lượng cao xuống quỹ đạo có mức năng lượng thấp hơn, nó sẽ phát ra một photon mang năng lượng tương ứng với sự chênh lệch năng lượng giữa hai quỹ đạo. Ngược lại, khi electron hấp thụ một photon có năng lượng phù hợp, nó có thể chuyển lên quỹ đạo có mức năng lượng cao hơn.
2. Phân Chia Lớp Electron Như Thế Nào?
Các lớp electron được đánh số từ 1 trở đi, bắt đầu từ lớp gần hạt nhân nhất. Lớp thứ nhất được gọi là lớp K, lớp thứ hai là lớp L, lớp thứ ba là lớp M, và lớp thứ tư là lớp N, và cứ tiếp tục như vậy. Mỗi lớp electron có thể chứa một số lượng electron tối đa nhất định, được tính theo công thức 2n², trong đó n là số thứ tự của lớp.
Dưới đây là số lượng electron tối đa mà mỗi lớp có thể chứa:
| Lớp electron | Số thứ tự (n) | Số electron tối đa (2n²) |
|---|---|---|
| K | 1 | 2 |
| L | 2 | 8 |
| M | 3 | 18 |
| N | 4 | 32 |
Ví dụ: Lớp K (n=1) có thể chứa tối đa 2 electron, lớp L (n=2) có thể chứa tối đa 8 electron, lớp M (n=3) có thể chứa tối đa 18 electron, và lớp N (n=4) có thể chứa tối đa 32 electron.
3. Sự Khác Biệt Giữa Mô Hình Nguyên Tử Hiện Đại Và Mô Hình Nguyên Tử Rutherford – Bohr Là Gì?
Mô hình nguyên tử hiện đại khác biệt so với mô hình nguyên tử Rutherford – Bohr ở một số điểm quan trọng:
- Quỹ đạo electron: Trong mô hình Rutherford – Bohr, electron chuyển động xung quanh hạt nhân theo các quỹ đạo tròn xác định. Tuy nhiên, mô hình hiện đại cho thấy electron chuyển động trong các orbital, là các vùng không gian xung quanh hạt nhân nơi xác suất tìm thấy electron là cao nhất.
- Hình dạng orbital: Các orbital không phải là các đường tròn đơn giản như trong mô hình Rutherford – Bohr. Chúng có các hình dạng phức tạp khác nhau, chẳng hạn như hình cầu (orbital s), hình quả tạ (orbital p), và các hình dạng phức tạp hơn (orbital d và f).
- Tính chất sóng – hạt của electron: Mô hình hiện đại xem xét electron vừa là hạt vừa là sóng, trong khi mô hình Rutherford – Bohr chỉ xem electron là hạt.
3.1. Electron Chuyển Động Xung Quanh Hạt Nhân Không Theo Quỹ Đạo Xác Định
Trong mô hình hiện đại, electron không chuyển động theo các quỹ đạo xác định như trong mô hình Rutherford – Bohr. Thay vào đó, electron tồn tại trong các orbital, là các vùng không gian xung quanh hạt nhân nơi xác suất tìm thấy electron là cao nhất. Hình dạng và kích thước của các orbital được xác định bởi các hàm sóng toán học.
3.2. Electron Chuyển Động Rất Nhanh Trong Khu Vực Không Gian Tạo Thành Đám Mây Electron
Electron chuyển động rất nhanh trong khu vực không gian xung quanh hạt nhân, tạo thành một đám mây electron. Mật độ của đám mây electron biểu thị xác suất tìm thấy electron ở một vị trí nhất định. Những khu vực có mật độ đám mây electron cao hơn có nghĩa là electron có nhiều khả năng được tìm thấy ở đó hơn.
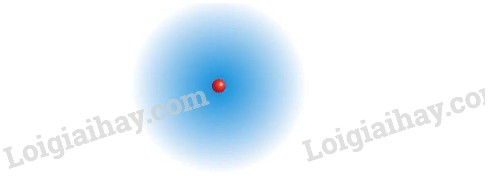 Hình ảnh minh họa đám mây electron xung quanh hạt nhân, cho thấy xác suất tìm thấy electron ở các vị trí khác nhau.
Hình ảnh minh họa đám mây electron xung quanh hạt nhân, cho thấy xác suất tìm thấy electron ở các vị trí khác nhau.
4. Ưu Điểm Và Hạn Chế Của Mô Hình Rutherford-Bohr Là Gì?
Mô hình Rutherford-Bohr, mặc dù là một bước tiến lớn trong việc hiểu cấu trúc nguyên tử, vẫn tồn tại những ưu điểm và hạn chế nhất định.
Ưu điểm:
- Giải thích sự ổn định của nguyên tử: Mô hình Bohr giải thích tại sao electron không rơi vào hạt nhân, một vấn đề mà mô hình Rutherford không thể giải quyết.
- Giải thích quang phổ vạch của nguyên tử hydro: Mô hình Bohr có thể dự đoán chính xác các vạch quang phổ phát xạ của nguyên tử hydro, dựa trên sự chuyển đổi giữa các mức năng lượng khác nhau.
- Đơn giản và dễ hiểu: Mô hình Rutherford-Bohr tương đối đơn giản và dễ hiểu, giúp học sinh và nhà khoa học dễ dàng hình dung cấu trúc của nguyên tử.
Hạn chế:
- Không giải thích được quang phổ của các nguyên tử phức tạp hơn: Mô hình Bohr chỉ hoạt động tốt với nguyên tử hydro (có một electron). Nó không thể giải thích quang phổ của các nguyên tử có nhiều electron.
- Không giải thích được hiệu ứng Zeeman: Mô hình Bohr không thể giải thích sự phân tách của các vạch quang phổ khi nguyên tử được đặt trong từ trường.
- Không phù hợp với nguyên lý bất định Heisenberg: Mô hình Bohr cho rằng electron có quỹ đạo và vận tốc xác định, điều này mâu thuẫn với nguyên lý bất định Heisenberg, một nguyên lý cơ bản của cơ học lượng tử.
5. Mô Hình Rutherford-Bohr Đã Đóng Góp Như Thế Nào Vào Sự Phát Triển Của Vật Lý Hiện Đại?
Mô hình Rutherford-Bohr đóng vai trò quan trọng trong sự phát triển của vật lý hiện đại, cụ thể:
- Đặt nền móng cho cơ học lượng tử: Mặc dù có những hạn chế, mô hình Rutherford-Bohr đã đưa ra những khái niệm quan trọng như lượng tử hóa năng lượng và quỹ đạo electron, đặt nền móng cho sự phát triển của cơ học lượng tử.
- Thúc đẩy nghiên cứu về cấu trúc nguyên tử: Mô hình Rutherford-Bohr đã thúc đẩy các nhà khoa học tiếp tục nghiên cứu về cấu trúc nguyên tử, dẫn đến sự ra đời của mô hình nguyên tử hiện đại, chính xác và đầy đủ hơn.
- Ứng dụng trong nhiều lĩnh vực: Các khái niệm và nguyên lý từ mô hình Rutherford-Bohr vẫn được sử dụng trong nhiều lĩnh vực của vật lý, hóa học, và kỹ thuật, chẳng hạn như quang phổ học, hóa học lượng tử, và thiết kế vật liệu.
6. Ứng Dụng Thực Tế Của Mô Hình Nguyên Tử Rutherford – Bohr Là Gì?
Mặc dù đã được thay thế bởi mô hình nguyên tử hiện đại, mô hình Rutherford – Bohr vẫn có những ứng dụng thực tế nhất định:
- Giáo dục: Mô hình Rutherford – Bohr vẫn được sử dụng rộng rãi trong giáo dục để giới thiệu cho học sinh và sinh viên về cấu trúc nguyên tử và các khái niệm cơ bản của cơ học lượng tử.
- Quang phổ học: Mô hình Rutherford – Bohr có thể được sử dụng để giải thích một số đặc điểm cơ bản của quang phổ nguyên tử, chẳng hạn như vị trí của các vạch quang phổ.
- Hóa học: Mô hình Rutherford – Bohr có thể được sử dụng để giải thích một số tính chất hóa học của các nguyên tố, chẳng hạn như khả năng tạo liên kết hóa học.
7. Các Thí Nghiệm Nào Đã Dẫn Đến Sự Ra Đời Của Mô Hình Rutherford – Bohr?
Mô hình Rutherford – Bohr được xây dựng dựa trên hai thí nghiệm quan trọng:
- Thí nghiệm tán xạ alpha của Rutherford: Thí nghiệm này đã chứng minh rằng nguyên tử có một hạt nhân nhỏ bé, đặc và mang điện tích dương, tập trung hầu hết khối lượng của nguyên tử.
- Nghiên cứu quang phổ của Bohr: Bohr đã nghiên cứu quang phổ của nguyên tử hydro và nhận thấy rằng quang phổ này bao gồm các vạch rời rạc, cho thấy năng lượng của electron trong nguyên tử bị lượng tử hóa.
8. Tại Sao Mô Hình Rutherford Ban Đầu Lại Không Ổn Định?
Mô hình Rutherford ban đầu, trong đó electron quay xung quanh hạt nhân như các hành tinh quay quanh Mặt Trời, gặp phải một vấn đề lớn: theo lý thuyết điện từ cổ điển, một electron chuyển động có gia tốc (trong trường hợp này là chuyển động tròn) sẽ bức xạ năng lượng dưới dạng sóng điện từ. Điều này có nghĩa là electron sẽ mất dần năng lượng, chuyển động xoắn ốc vào hạt nhân, và cuối cùng nguyên tử sẽ sụp đổ. Tuy nhiên, trên thực tế, nguyên tử lại rất ổn định.
9. Những Nhà Khoa Học Nào Đã Đóng Góp Vào Sự Phát Triển Của Mô Hình Nguyên Tử?
Nhiều nhà khoa học đã đóng góp vào sự phát triển của mô hình nguyên tử, bao gồm:
- John Dalton: Đề xuất mô hình nguyên tử đầu tiên, cho rằng nguyên tử là những hạt nhỏ bé, không thể phân chia.
- J.J. Thomson: Phát hiện ra electron và đề xuất mô hình “bánh pudding mận”, trong đó electron nằm rải rác trong một khối tích điện dương.
- Ernest Rutherford: Thực hiện thí nghiệm tán xạ alpha và đề xuất mô hình hạt nhân, trong đó hầu hết khối lượng và điện tích dương của nguyên tử tập trung ở hạt nhân.
- Niels Bohr: Bổ sung vào mô hình Rutherford bằng cách đưa ra giả thuyết về lượng tử hóa năng lượng và quỹ đạo electron.
- Erwin Schrödinger và Werner Heisenberg: Phát triển cơ học lượng tử, mô tả electron như một sóng và đưa ra khái niệm orbital.
10. Mô Hình Rutherford – Bohr Có Liên Quan Đến Bảng Tuần Hoàn Các Nguyên Tố Hóa Học Như Thế Nào?
Mô hình Rutherford – Bohr có liên quan mật thiết đến bảng tuần hoàn các nguyên tố hóa học. Số lượng electron trong nguyên tử (số hiệu nguyên tử) xác định vị trí của nguyên tố trong bảng tuần hoàn. Các nguyên tố trong cùng một nhóm (cột) có số lượng electron hóa trị (electron ở lớp ngoài cùng) giống nhau, do đó có tính chất hóa học tương tự.
11. Nguyên Tắc Bất Định Heisenberg Ảnh Hưởng Đến Mô Hình Nguyên Tử Như Thế Nào?
Nguyên tắc bất định Heisenberg, một trong những nguyên lý cơ bản của cơ học lượng tử, nói rằng không thể xác định đồng thời chính xác cả vị trí và động lượng của một hạt. Điều này có nghĩa là mô hình Rutherford – Bohr, trong đó electron có quỹ đạo và vận tốc xác định, không hoàn toàn chính xác. Thay vào đó, electron tồn tại trong các orbital, là các vùng không gian xung quanh hạt nhân nơi xác suất tìm thấy electron là cao nhất.
12. Các Mức Năng Lượng Trong Nguyên Tử Được Lượng Tử Hóa Như Thế Nào?
Các mức năng lượng trong nguyên tử được lượng tử hóa, có nghĩa là electron chỉ có thể tồn tại ở các mức năng lượng nhất định, rời rạc, chứ không phải bất kỳ mức năng lượng nào. Các mức năng lượng này tương ứng với các quỹ đạo electron khác nhau xung quanh hạt nhân. Khi electron chuyển từ một mức năng lượng này sang một mức năng lượng khác, nó sẽ hấp thụ hoặc phát ra một photon mang năng lượng tương ứng với sự chênh lệch năng lượng giữa hai mức.
13. Quang Phổ Hấp Thụ Và Quang Phổ Phát Xạ Liên Quan Đến Mô Hình Rutherford – Bohr Như Thế Nào?
Quang phổ hấp thụ và quang phổ phát xạ là hai loại quang phổ nguyên tử liên quan mật thiết đến mô hình Rutherford – Bohr.
- Quang phổ hấp thụ: Khi ánh sáng trắng (chứa tất cả các màu) đi qua một chất khí, các nguyên tử trong chất khí sẽ hấp thụ các photon có năng lượng tương ứng với sự chênh lệch năng lượng giữa các mức năng lượng của electron. Kết quả là, quang phổ thu được sau khi ánh sáng đi qua chất khí sẽ có các vạch tối tại các bước sóng mà các photon đã bị hấp thụ.
- Quang phổ phát xạ: Khi các nguyên tử bị kích thích (ví dụ, bằng nhiệt hoặc điện), các electron sẽ chuyển lên các mức năng lượng cao hơn. Khi các electron trở lại các mức năng lượng thấp hơn, chúng sẽ phát ra các photon có năng lượng tương ứng với sự chênh lệch năng lượng giữa các mức. Quang phổ thu được từ ánh sáng phát ra này sẽ có các vạch sáng tại các bước sóng tương ứng với các photon đã được phát ra.
Mô hình Rutherford – Bohr có thể giải thích sự tồn tại của các vạch quang phổ hấp thụ và phát xạ, cũng như mối liên hệ giữa chúng với các mức năng lượng của electron trong nguyên tử.
14. Mô Hình Rutherford – Bohr Có Thể Giải Thích Các Liên Kết Hóa Học Như Thế Nào?
Mô hình Rutherford – Bohr có thể được sử dụng để giải thích một số khía cạnh cơ bản của liên kết hóa học. Các nguyên tử có xu hướng tạo liên kết với nhau để đạt được cấu hình electron bền vững, thường là cấu hình có lớp vỏ ngoài cùng đầy đủ electron (8 electron, trừ hydro và heli có 2 electron). Các nguyên tử có thể đạt được cấu hình này bằng cách chia sẻ electron (liên kết cộng hóa trị) hoặc chuyển electron cho nhau (liên kết ion).
Ví dụ, nguyên tử natri (Na) có 1 electron ở lớp ngoài cùng, trong khi nguyên tử clo (Cl) có 7 electron ở lớp ngoài cùng. Natri có thể dễ dàng mất 1 electron để đạt được cấu hình bền vững, trong khi clo có thể dễ dàng nhận 1 electron để đạt được cấu hình bền vững. Do đó, natri và clo có thể tạo thành liên kết ion bằng cách natri chuyển electron cho clo, tạo thành ion natri dương (Na+) và ion clo âm (Cl-).
15. Những Khái Niệm Nào Từ Mô Hình Rutherford – Bohr Vẫn Được Sử Dụng Trong Vật Lý Hiện Đại?
Mặc dù đã được thay thế bởi mô hình nguyên tử hiện đại, một số khái niệm từ mô hình Rutherford – Bohr vẫn được sử dụng trong vật lý hiện đại:
- Hạt nhân nguyên tử: Khái niệm về hạt nhân nguyên tử, nơi tập trung hầu hết khối lượng và điện tích dương của nguyên tử, vẫn là một khái niệm cơ bản trong vật lý hạt nhân.
- Quỹ đạo electron: Mặc dù electron không chuyển động theo các quỹ đạo xác định như trong mô hình Rutherford – Bohr, khái niệm về các mức năng lượng electron và các orbital vẫn được sử dụng để mô tả sự phân bố electron trong nguyên tử.
- Lượng tử hóa năng lượng: Khái niệm về lượng tử hóa năng lượng, trong đó electron chỉ có thể tồn tại ở các mức năng lượng nhất định, rời rạc, là một khái niệm cơ bản của cơ học lượng tử.
FAQ Về Mô Hình Nguyên Tử Rutherford – Bohr
Câu hỏi 1: Mô hình Rutherford – Bohr là gì?
Mô hình Rutherford – Bohr là một mô hình cấu trúc nguyên tử, trong đó electron quay xung quanh hạt nhân theo các quỹ đạo tròn xác định, tương ứng với các mức năng lượng khác nhau.
Câu hỏi 2: Ai là người đề xuất mô hình Rutherford – Bohr?
Mô hình Rutherford – Bohr được đề xuất bởi Ernest Rutherford và Niels Bohr.
Câu hỏi 3: Nội dung chính của mô hình Rutherford – Bohr là gì?
Mô hình Rutherford – Bohr có ba nội dung chính: hạt nhân nguyên tử, quỹ đạo electron và mức năng lượng.
Câu hỏi 4: Mô hình Rutherford – Bohr khác với mô hình hiện đại như thế nào?
Mô hình hiện đại khác với mô hình Rutherford – Bohr ở chỗ electron không chuyển động theo các quỹ đạo xác định mà tồn tại trong các orbital, là các vùng không gian xung quanh hạt nhân nơi xác suất tìm thấy electron là cao nhất.
Câu hỏi 5: Ưu điểm của mô hình Rutherford – Bohr là gì?
Mô hình Rutherford – Bohr giải thích sự ổn định của nguyên tử, giải thích quang phổ vạch của nguyên tử hydro, đơn giản và dễ hiểu.
Câu hỏi 6: Hạn chế của mô hình Rutherford – Bohr là gì?
Mô hình Rutherford – Bohr không giải thích được quang phổ của các nguyên tử phức tạp hơn, không giải thích được hiệu ứng Zeeman, không phù hợp với nguyên lý bất định Heisenberg.
Câu hỏi 7: Mô hình Rutherford – Bohr đã đóng góp như thế nào vào sự phát triển của vật lý hiện đại?
Mô hình Rutherford – Bohr đặt nền móng cho cơ học lượng tử, thúc đẩy nghiên cứu về cấu trúc nguyên tử, ứng dụng trong nhiều lĩnh vực.
Câu hỏi 8: Mô hình Rutherford – Bohr có liên quan đến bảng tuần hoàn các nguyên tố hóa học như thế nào?
Số lượng electron trong nguyên tử xác định vị trí của nguyên tố trong bảng tuần hoàn.
Câu hỏi 9: Nguyên tắc bất định Heisenberg ảnh hưởng đến mô hình nguyên tử như thế nào?
Nguyên tắc bất định Heisenberg nói rằng không thể xác định đồng thời chính xác cả vị trí và động lượng của một hạt, điều này làm cho mô hình Rutherford – Bohr không hoàn toàn chính xác.
Câu hỏi 10: Các mức năng lượng trong nguyên tử được lượng tử hóa như thế nào?
Các mức năng lượng trong nguyên tử được lượng tử hóa, có nghĩa là electron chỉ có thể tồn tại ở các mức năng lượng nhất định, rời rạc.
Bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải ở Mỹ Đình? Đừng ngần ngại truy cập XETAIMYDINH.EDU.VN ngay hôm nay để khám phá thế giới xe tải đa dạng và nhận được sự tư vấn chuyên nghiệp từ đội ngũ chuyên gia của chúng tôi. Tại Xe Tải Mỹ Đình, chúng tôi cam kết cung cấp cho bạn những thông tin cập nhật nhất, giúp bạn đưa ra quyết định thông minh và phù hợp nhất với nhu cầu của bạn. Liên hệ ngay với chúng tôi qua hotline 0247 309 9988 hoặc đến trực tiếp địa chỉ Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội để được hỗ trợ tận tình.