Dung dịch có độ pH lớn hơn 7 có môi trường bazơ, còn được gọi là kiềm. Xe Tải Mỹ Đình sẽ giúp bạn khám phá chi tiết về đặc điểm, ứng dụng quan trọng của dung dịch này trong đời sống và công nghiệp. Hãy cùng XETAIMYDINH.EDU.VN tìm hiểu ngay để nắm vững kiến thức về hóa học và ứng dụng thực tế nhé, đồng thời khám phá thêm về các giải pháp vận tải tối ưu.
1. Dung Dịch pH > 7 Là Gì Và Tính Chất Cơ Bản Của Môi Trường Kiềm?
Dung dịch có độ pH lớn hơn 7 là dung dịch bazơ hay còn gọi là kiềm, thể hiện tính chất hóa học đặc trưng bởi khả năng nhận proton (H+) hoặc giải phóng ion hydroxide (OH-) trong nước.
Môi trường kiềm có những tính chất cơ bản sau:
- Độ pH lớn hơn 7: Đây là đặc điểm quan trọng nhất, phân biệt môi trường kiềm với môi trường axit (pH < 7) và trung tính (pH = 7).
- Vị đắng: Nhiều chất kiềm có vị đắng đặc trưng.
- Cảm giác trơn: Khi tiếp xúc với da, dung dịch kiềm thường tạo cảm giác trơn do phản ứng xà phòng hóa với chất béo trên da.
- Ăn mòn: Kiềm mạnh có khả năng ăn mòn các vật liệu hữu cơ và một số kim loại.
- Khả năng trung hòa axit: Kiềm có khả năng trung hòa axit, tạo thành muối và nước.
Ví dụ về các chất kiềm phổ biến:
- Natri hydroxit (NaOH): Còn gọi là xút ăn da, được sử dụng rộng rãi trong công nghiệp sản xuất giấy, xà phòng, chất tẩy rửa.
- Kali hydroxit (KOH): Tương tự NaOH, KOH cũng là một bazơ mạnh, được dùng trong sản xuất xà phòng lỏng và chất điện giải trong pin kiềm.
- Amoniac (NH3): Một bazơ yếu, được sử dụng trong phân bón, chất tẩy rửa và sản xuất nhựa.
- Canxi hydroxit (Ca(OH)2): Hay vôi tôi, được dùng trong xây dựng, xử lý nước và nông nghiệp.
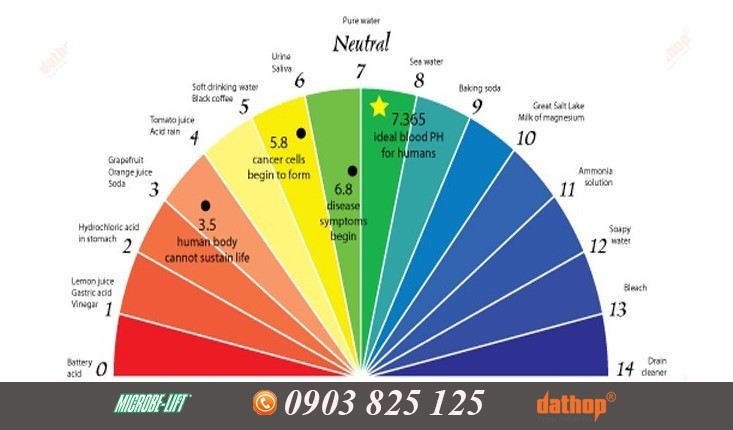 Thang đo pH cho biết tính axit và bazơ của các chất
Thang đo pH cho biết tính axit và bazơ của các chất
2. Thang Đo pH Và Cách Xác Định Môi Trường Kiềm
Thang đo pH là một шкала logarit được sử dụng để xác định độ axit hoặc bazơ của một dung dịch. Thang đo này dao động từ 0 đến 14, với 7 là điểm trung tính. Các giá trị pH nhỏ hơn 7 cho biết tính axit, trong khi các giá trị lớn hơn 7 cho biết tính bazơ (kiềm).
2.1. Các Mức Độ pH Và Tính Chất Tương Ứng
- pH = 7: Môi trường trung tính. Ví dụ: nước tinh khiết ở 25°C.
- pH < 7: Môi trường axit. Giá trị pH càng nhỏ, tính axit càng mạnh. Ví dụ: nước chanh (pH ≈ 2), giấm (pH ≈ 3).
- pH > 7: Môi trường bazơ (kiềm). Giá trị pH càng lớn, tính bazơ càng mạnh. Ví dụ: xà phòng (pH ≈ 9-10), thuốc tẩy (pH ≈ 12-13).
2.2. Phương Pháp Xác Định pH Của Dung Dịch
Có hai phương pháp chính để xác định pH của dung dịch:
-
Sử dụng chất chỉ thị pH:
- Chất chỉ thị pH là gì: Là các chất hóa học có khả năng thay đổi màu sắc tùy thuộc vào độ pH của môi trường.
- Quỳ tím: Chuyển sang màu đỏ trong môi trường axit, màu xanh trong môi trường kiềm và giữ nguyên màu tím ở môi trường trung tính.
- Giấy pH: Là giấy được tẩm chất chỉ thị pH, khi nhúng vào dung dịch sẽ đổi màu và so sánh với bảng màu chuẩn để xác định giá trị pH gần đúng.
- Dung dịch chỉ thị pH: Ví dụ như phenolphthalein (không màu trong môi trường axit và trung tính, chuyển sang màu hồng trong môi trường kiềm) và methyl orange (đỏ trong môi trường axit, vàng trong môi trường kiềm).
-
Sử dụng máy đo pH:
- Nguyên tắc hoạt động: Máy đo pH hoạt động dựa trên nguyên tắc đo điện thế giữa hai điện cực, một điện cực tham chiếu và một điện cực đo pH, nhúng trong dung dịch cần đo. Điện thế này thay đổi theo nồng độ ion H+ trong dung dịch, từ đó xác định được giá trị pH.
- Ưu điểm: Cho kết quả đo chính xác và nhanh chóng.
- Ứng dụng: Được sử dụng rộng rãi trong các phòng thí nghiệm, công nghiệp và các lĩnh vực cần kiểm soát độ pH chặt chẽ.
3. Ứng Dụng Quan Trọng Của Dung Dịch pH > 7 Trong Đời Sống Và Công Nghiệp
Dung dịch có pH lớn hơn 7, hay môi trường kiềm, đóng vai trò quan trọng và có nhiều ứng dụng rộng rãi trong đời sống hàng ngày cũng như trong các ngành công nghiệp khác nhau. Dưới đây là một số ứng dụng tiêu biểu:
3.1. Trong Đời Sống Hàng Ngày
-
Sản xuất xà phòng và chất tẩy rửa:
- Vai trò của kiềm: Các chất kiềm như natri hydroxit (NaOH) và kali hydroxit (KOH) là thành phần chính trong quá trình sản xuất xà phòng. Chúng phản ứng với chất béo để tạo thành xà phòng thông qua phản ứng xà phòng hóa.
- Ứng dụng: Xà phòng được sử dụng để làm sạch da, quần áo và các bề mặt khác. Chất tẩy rửa cũng chứa các chất kiềm để tăng cường khả năng làm sạch và loại bỏ dầu mỡ.
-
Chăm sóc sức khỏe và vệ sinh cá nhân:
- Kem đánh răng: Chứa các chất kiềm nhẹ để trung hòa axit trong miệng, giúp ngăn ngừa sâu răng và bảo vệ men răng.
- Thuốc kháng axit: Được sử dụng để giảm triệu chứng ợ nóng và khó tiêu do dư thừa axit trong dạ dày. Các thuốc này thường chứa các bazơ như magie hydroxit (Mg(OH)2) hoặc nhôm hydroxit (Al(OH)3) để trung hòa axit.
-
Nấu ăn:
- Baking soda (NaHCO3): Được sử dụng làm chất tạo nở trong nhiều công thức làm bánh. Khi nướng, baking soda phân hủy tạo ra khí CO2, giúp bánh nở phồng.
- Ngâm rau củ: Một số loại rau củ như măng tây và đậu que được ngâm trong dung dịch kiềm nhẹ để làm mềm và giảm vị đắng.
3.2. Trong Nông Nghiệp
-
Điều chỉnh độ pH của đất:
- Vôi (CaCO3): Được sử dụng để cải tạo đất chua, nâng cao độ pH của đất, tạo điều kiện thuận lợi cho sự phát triển của cây trồng.
- Ảnh hưởng đến dinh dưỡng: Độ pH của đất ảnh hưởng đến khả năng hấp thụ các chất dinh dưỡng của cây trồng. Đất có độ pH phù hợp giúp cây trồng hấp thụ tốt hơn các chất dinh dưỡng cần thiết như nitơ, photpho và kali.
-
Sản xuất phân bón:
- Amoniac (NH3): Là một thành phần quan trọng trong sản xuất phân đạm. Amoniac được chuyển đổi thành các dạng phân bón khác nhau như ure và amoni nitrat.
3.3. Trong Công Nghiệp
-
Xử lý nước:
- Trung hòa axit: Các chất kiềm như natri hydroxit (NaOH) và canxi hydroxit (Ca(OH)2) được sử dụng để trung hòa axit trong nước thải công nghiệp và nước cấp, đảm bảo nước đạt tiêu chuẩn pH an toàn cho môi trường và sức khỏe con người.
- Loại bỏ kim loại nặng: Kiềm cũng được sử dụng để kết tủa và loại bỏ các kim loại nặng như chì, cadmium và thủy ngân từ nước thải.
-
Sản xuất giấy:
- Tách lignin: Natri hydroxit (NaOH) được sử dụng trong quá trình sản xuất giấy để tách lignin khỏi cellulose, giúp tạo ra giấy trắng và mịn.
-
Công nghiệp dệt nhuộm:
- Nhuộm vải: Các chất kiềm được sử dụng để điều chỉnh độ pH của dung dịch nhuộm, giúp thuốc nhuộm bám màu tốt hơn vào sợi vải.
- Xử lý vải: Kiềm cũng được sử dụng trong quá trình xử lý vải để loại bỏ các tạp chất và làm mềm vải.
-
Sản xuất hóa chất:
- Nhiều quy trình sản xuất hóa chất: Sử dụng các chất kiềm làm chất xúc tác hoặc chất phản ứng để tạo ra các sản phẩm hóa học khác nhau.
-
Công nghiệp khai khoáng:
- Tách kim loại: Các chất kiềm được sử dụng để tách kim loại từ quặng thông qua quá trình hòa tan chọn lọc. Ví dụ, natri hydroxit (NaOH) được sử dụng trong quá trình Bayer để sản xuất nhôm từ quặng bauxite.
4. Ảnh Hưởng Của Độ pH Đến Đời Sống Và Môi Trường
Độ pH là một yếu tố quan trọng ảnh hưởng đến nhiều khía cạnh của đời sống và môi trường. Sự thay đổi độ pH có thể gây ra những tác động tiêu cực đến sức khỏe con người, hệ sinh thái và các hoạt động sản xuất.
4.1. Ảnh Hưởng Đến Sức Khỏe Con Người
-
Da:
- Độ pH tự nhiên của da: Da có độ pH tự nhiên khoảng 4.5 – 5.5, tạo thành một lớp màng axit bảo vệ da khỏi vi khuẩn và các tác nhân gây hại từ môi trường.
- Tác động của kiềm: Sử dụng các sản phẩm có tính kiềm cao (như xà phòng có độ pH > 7) có thể làm mất lớp màng bảo vệ này, gây khô da, kích ứng, viêm da và làm tăng nguy cơ nhiễm trùng.
-
Mắt:
- Độ pH lý tưởng của nước mắt: Nước mắt có độ pH khoảng 7.4, giúp duy trì môi trường ổn định cho mắt.
- Tác động của kiềm: Tiếp xúc với các chất kiềm mạnh có thể gây tổn thương nghiêm trọng cho mắt, dẫn đến bỏng giác mạc, sẹo và thậm chí mù lòa.
-
Hệ tiêu hóa:
- Độ pH trong dạ dày: Dạ dày có độ pH rất thấp (1.5 – 3.5) do chứa axit hydrochloric (HCl), giúp tiêu hóa thức ăn và tiêu diệt vi khuẩn.
- Tác động của kiềm: Sử dụng quá nhiều thuốc kháng axit (chứa các bazơ) có thể làm tăng độ pH trong dạ dày, ảnh hưởng đến quá trình tiêu hóa và hấp thụ chất dinh dưỡng.
-
Máu:
- Độ pH của máu: Máu có độ pH ổn định từ 7.35 – 7.45, rất quan trọng cho các chức năng sinh lý của cơ thể.
- Tác động của sự thay đổi pH: Sự thay đổi độ pH của máu (nhiễm toan hoặc nhiễm kiềm) có thể gây ra các vấn đề sức khỏe nghiêm trọng, ảnh hưởng đến hoạt động của các enzyme và quá trình trao đổi chất.
4.2. Ảnh Hưởng Đến Môi Trường
-
Hệ sinh thái nước:
- Độ pH lý tưởng cho sinh vật thủy sinh: Hầu hết các sinh vật thủy sinh (cá, tôm, thực vật) phát triển tốt nhất trong môi trường nước có độ pH gần trung tính (6.5 – 8.5).
- Tác động của axit hóa: Nước bị axit hóa (do mưa axit hoặc ô nhiễm công nghiệp) có thể gây hại hoặc giết chết các sinh vật thủy sinh, làm suy giảm đa dạng sinh học và ảnh hưởng đến chuỗi thức ăn.
- Tác động của kiềm hóa: Nước bị kiềm hóa (do xả thải công nghiệp hoặc nông nghiệp) cũng có thể gây hại cho sinh vật thủy sinh, làm thay đổi thành phần hóa học của nước và ảnh hưởng đến quá trình sinh sản và phát triển của chúng.
-
Đất:
- Độ pH lý tưởng cho cây trồng: Độ pH của đất ảnh hưởng đến khả năng hấp thụ các chất dinh dưỡng của cây trồng. Hầu hết các loại cây trồng phát triển tốt nhất trong đất có độ pH từ 6.0 – 7.5.
- Tác động của đất chua: Đất chua (pH < 6.0) có thể gây ra các vấn đề như ngộ độc nhôm, thiếu hụt canxi và magie, làm giảm năng suất cây trồng.
- Tác động của đất kiềm: Đất kiềm (pH > 7.5) có thể gây ra các vấn đề như thiếu hụt sắt, mangan và kẽm, làm giảm khả năng sinh trưởng của cây trồng.
-
Khí quyển:
- Mưa axit: Phát thải các khí như sulfur dioxide (SO2) và nitrogen oxides (NOx) từ các hoạt động công nghiệp và giao thông vận tải có thể gây ra mưa axit, làm giảm độ pH của nước mưa và gây hại cho rừng, hồ và các công trình xây dựng.
4.3. Ảnh Hưởng Đến Các Hoạt Động Sản Xuất
-
Nông nghiệp:
- Năng suất cây trồng: Độ pH của đất ảnh hưởng trực tiếp đến năng suất và chất lượng cây trồng. Đất có độ pH không phù hợp có thể làm giảm khả năng hấp thụ chất dinh dưỡng của cây, gây ra các vấn đề về sinh trưởng và phát triển.
-
Công nghiệp:
- Ăn mòn thiết bị: Môi trường có độ pH quá thấp hoặc quá cao có thể gây ăn mòn các thiết bị và công trình xây dựng, làm giảm tuổi thọ và tăng chi phí bảo trì.
- Chất lượng sản phẩm: Độ pH ảnh hưởng đến chất lượng và tính ổn định của nhiều sản phẩm công nghiệp, như dược phẩm, thực phẩm và hóa chất.
5. Các Yếu Tố Ảnh Hưởng Đến Độ pH Của Môi Trường
Độ pH của môi trường có thể bị ảnh hưởng bởi nhiều yếu tố khác nhau, bao gồm cả tự nhiên và nhân tạo. Dưới đây là một số yếu tố chính:
5.1. Yếu Tố Tự Nhiên
-
Mưa axit:
- Nguyên nhân: Mưa axit hình thành do sự hòa tan của các khí như sulfur dioxide (SO2) và nitrogen oxides (NOx) trong nước mưa. Các khí này có nguồn gốc từ các hoạt động núi lửa, cháy rừng và phân hủy chất hữu cơ.
- Tác động: Mưa axit làm giảm độ pH của đất và nước, gây hại cho cây trồng, sinh vật thủy sinh và các công trình xây dựng.
-
Địa chất:
- Thành phần khoáng chất: Thành phần khoáng chất của đất và đá có thể ảnh hưởng đến độ pH của môi trường. Ví dụ, đất giàu đá vôi (CaCO3) thường có độ pH cao hơn so với đất giàu silic.
- Quá trình phong hóa: Quá trình phong hóa của đá và khoáng chất có thể giải phóng các ion H+ hoặc OH- vào môi trường, làm thay đổi độ pH.
-
Hoạt động sinh học:
- Quá trình phân hủy: Quá trình phân hủy chất hữu cơ bởi vi sinh vật có thể tạo ra các axit hữu cơ, làm giảm độ pH của đất.
- Quá trình quang hợp: Quá trình quang hợp của thực vật tiêu thụ CO2, làm tăng độ pH của nước.
5.2. Yếu Tố Nhân Tạo
-
Ô nhiễm công nghiệp:
- Khí thải: Các nhà máy và khu công nghiệp thải ra các khí như SO2, NOx và HCl, gây ra mưa axit và làm giảm độ pH của môi trường.
- Nước thải: Nước thải công nghiệp chứa nhiều hóa chất và chất ô nhiễm, có thể làm thay đổi đáng kể độ pH của nguồn nước.
-
Hoạt động nông nghiệp:
- Sử dụng phân bón: Sử dụng quá nhiều phân bón hóa học, đặc biệt là phân đạm, có thể làm giảm độ pH của đất.
- Sử dụng thuốc trừ sâu: Một số loại thuốc trừ sâu có thể chứa các chất axit hoặc bazơ, làm thay đổi độ pH của đất và nước.
-
Khai thác khoáng sản:
- Nước thải mỏ: Quá trình khai thác khoáng sản có thể tạo ra nước thải mỏ có độ pH rất thấp do chứa axit sulfuric (H2SO4), gây ô nhiễm nghiêm trọng cho môi trường.
- Phá rừng: Phá rừng làm giảm khả năng hấp thụ CO2 của thực vật, góp phần vào sự gia tăng nồng độ CO2 trong khí quyển và làm giảm độ pH của nước mưa.
-
Đô thị hóa:
- Nước thải sinh hoạt: Nước thải sinh hoạt chứa nhiều chất thải hữu cơ và hóa chất, có thể làm thay đổi độ pH của nguồn nước.
- Giao thông vận tải: Khí thải từ các phương tiện giao thông vận tải chứa NOx và các chất ô nhiễm khác, góp phần vào sự hình thành mưa axit.
6. Biện Pháp Kiểm Soát Và Điều Chỉnh Độ pH Của Môi Trường
Để giảm thiểu những tác động tiêu cực của sự thay đổi độ pH và bảo vệ môi trường, cần áp dụng các biện pháp kiểm soát và điều chỉnh độ pH một cách hiệu quả. Dưới đây là một số biện pháp quan trọng:
6.1. Kiểm Soát Ô Nhiễm Công Nghiệp
-
Xử lý khí thải:
- Công nghệ lọc khí: Sử dụng các công nghệ lọc khí như hấp thụ, hấp phụ, xúc tác và màng lọc để loại bỏ các khí SO2, NOx và các chất ô nhiễm khác từ khí thải công nghiệp trước khi thải ra môi trường.
- Sử dụng nhiên liệu sạch: Chuyển đổi sang sử dụng các nguồn nhiên liệu sạch hơn như khí tự nhiên, năng lượng tái tạo (mặt trời, gió, thủy điện) để giảm thiểu phát thải các khí gây ô nhiễm.
-
Xử lý nước thải:
- Hệ thống xử lý nước thải: Xây dựng và vận hành hiệu quả các hệ thống xử lý nước thải công nghiệp để loại bỏ các chất ô nhiễm và điều chỉnh độ pH trước khi thải ra môi trường.
- Công nghệ xử lý nước thải tiên tiến: Áp dụng các công nghệ xử lý nước thải tiên tiến như quá trình oxy hóa nâng cao (AOPs), màng lọc (UF, RO) và hấp phụ để loại bỏ các chất ô nhiễm khó phân hủy và đảm bảo nước thải đạt tiêu chuẩn môi trường.
6.2. Quản Lý Hoạt Động Nông Nghiệp
-
Sử dụng phân bón hợp lý:
- Phân tích đất: Thực hiện phân tích đất để xác định nhu cầu dinh dưỡng của cây trồng và sử dụng phân bón với liều lượng và tỷ lệ phù hợp.
- Sử dụng phân hữu cơ: Tăng cường sử dụng phân hữu cơ (phân chuồng, phân xanh, phân compost) để cải tạo đất, cung cấp dinh dưỡng cho cây trồng một cách tự nhiên và giảm thiểu tác động tiêu cực đến độ pH của đất.
-
Quản lý thuốc trừ sâu:
- Sử dụng thuốc trừ sâu sinh học: Ưu tiên sử dụng các loại thuốc trừ sâu sinh học có nguồn gốc tự nhiên và ít gây ảnh hưởng đến môi trường.
- Áp dụng biện pháp phòng trừ tổng hợp (IPM): Áp dụng các biện pháp phòng trừ tổng hợp để giảm thiểu việc sử dụng thuốc trừ sâu hóa học và bảo vệ hệ sinh thái nông nghiệp.
6.3. Cải Tạo Đất
-
Bón vôi:
- Sử dụng vôi: Sử dụng vôi (CaCO3) để cải tạo đất chua, nâng cao độ pH của đất và cải thiện khả năng hấp thụ chất dinh dưỡng của cây trồng.
- Liều lượng vôi: Xác định liều lượng vôi cần bón dựa trên kết quả phân tích đất và nhu cầu của cây trồng.
-
Bón phân hữu cơ:
- Cải thiện cấu trúc đất: Bón phân hữu cơ giúp cải thiện cấu trúc đất, tăng khả năng giữ nước và chất dinh dưỡng, và tạo điều kiện thuận lợi cho sự phát triển của vi sinh vật có lợi trong đất.
- Ổn định độ pH: Phân hữu cơ có khả năng ổn định độ pH của đất, giúp duy trì môi trường thuận lợi cho cây trồng.
6.4. Bảo Vệ Rừng Và Phát Triển Cây Xanh
-
Trồng rừng và phục hồi rừng:
- Tăng cường trồng rừng: Tăng cường trồng rừng và phục hồi rừng để tăng khả năng hấp thụ CO2 từ khí quyển, giảm thiểu tác động của mưa axit và bảo vệ nguồn nước.
- Lựa chọn loài cây phù hợp: Lựa chọn các loài cây phù hợp với điều kiện địa phương và có khả năng hấp thụ CO2 cao.
-
Phát triển cây xanh đô thị:
- Trồng cây xanh: Trồng cây xanh trong các khu đô thị giúp cải thiện chất lượng không khí, giảm thiểu hiệu ứng đảo nhiệt đô thị và tạo môi trường sống xanh, sạch, đẹp.
- Bảo vệ cây xanh: Bảo vệ và chăm sóc cây xanh hiện có để đảm bảo chúng phát triển khỏe mạnh và có khả năng hấp thụ CO2 tốt nhất.
6.5. Nâng Cao Nhận Thức Cộng Đồng
-
Tuyên truyền và giáo dục:
- Tổ chức các chương trình tuyên truyền: Tổ chức các chương trình tuyên truyền và giáo dục về tầm quan trọng của việc kiểm soát và điều chỉnh độ pH của môi trường, tác động của ô nhiễm và các biện pháp bảo vệ môi trường.
- Xây dựng ý thức: Xây dựng ý thức trách nhiệm của cộng đồng trong việc bảo vệ môi trường và thực hiện các hành động cụ thể để giảm thiểu ô nhiễm và bảo vệ nguồn tài nguyên.
-
Khuyến khích sử dụng sản phẩm thân thiện với môi trường:
- Sản phẩm thân thiện: Khuyến khích người dân sử dụng các sản phẩm thân thiện với môi trường như chất tẩy rửa sinh học, phân bón hữu cơ và các sản phẩm có chứng nhận xanh.
- Tiết kiệm năng lượng: Tiết kiệm năng lượng và sử dụng các nguồn năng lượng tái tạo để giảm thiểu phát thải khí gây ô nhiễm.
7. Các Câu Hỏi Thường Gặp Về Dung Dịch pH > 7 (FAQ)
-
Dung dịch có pH lớn hơn 7 được gọi là gì?
Dung dịch có pH lớn hơn 7 được gọi là dung dịch bazơ hoặc dung dịch kiềm.
-
Làm thế nào để nhận biết một dung dịch có tính bazơ?
Bạn có thể nhận biết bằng cách sử dụng giấy quỳ tím (chuyển sang màu xanh), giấy pH (so màu với bảng chuẩn) hoặc máy đo pH (hiển thị giá trị > 7).
-
Những chất nào thường có tính bazơ?
Xà phòng, nước tro, dung dịch amoniac, và các chất tẩy rửa thường có tính bazơ.
-
Tại sao độ pH lại quan trọng trong nông nghiệp?
Độ pH ảnh hưởng đến khả năng hấp thụ chất dinh dưỡng của cây trồng. Đất có độ pH phù hợp giúp cây phát triển tốt hơn.
-
Kiềm có gây hại cho sức khỏe không?
Kiềm mạnh có thể gây ăn mòn và kích ứng da, mắt và hệ hô hấp. Cần sử dụng cẩn thận và tuân thủ các biện pháp an toàn.
-
Ứng dụng của dung dịch pH > 7 trong công nghiệp là gì?
Được sử dụng trong sản xuất giấy, xử lý nước thải, công nghiệp dệt nhuộm và nhiều quy trình hóa học khác.
-
Làm thế nào để điều chỉnh độ pH của đất nếu nó quá chua?
Có thể bón vôi (CaCO3) để nâng độ pH của đất.
-
Mưa axit ảnh hưởng đến độ pH của môi trường như thế nào?
Mưa axit làm giảm độ pH của đất và nước, gây hại cho sinh vật và cây trồng.
-
Tại sao xà phòng lại có tính bazơ?
Xà phòng được tạo ra thông qua phản ứng xà phòng hóa giữa chất béo và một bazơ mạnh như natri hydroxit (NaOH).
-
Làm thế nào để bảo vệ môi trường khỏi tác động của độ pH không phù hợp?
Kiểm soát ô nhiễm công nghiệp, sử dụng phân bón hợp lý, bảo vệ rừng và nâng cao nhận thức cộng đồng về bảo vệ môi trường.
Bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về các loại xe tải phù hợp với nhu cầu vận chuyển hàng hóa của mình tại khu vực Mỹ Đình, Hà Nội? Bạn muốn được tư vấn tận tình về các dòng xe tải, so sánh giá cả và thông số kỹ thuật, cũng như giải đáp mọi thắc mắc liên quan đến thủ tục mua bán, đăng ký và bảo dưỡng xe tải?
Hãy đến với Xe Tải Mỹ Đình ngay hôm nay! Chúng tôi cam kết cung cấp cho bạn những thông tin chính xác, cập nhật và hữu ích nhất về thị trường xe tải tại Mỹ Đình. Đội ngũ chuyên gia giàu kinh nghiệm của chúng tôi luôn sẵn sàng lắng nghe và tư vấn cho bạn giải pháp tối ưu nhất, giúp bạn lựa chọn được chiếc xe tải ưng ý, phù hợp với ngân sách và đáp ứng mọi yêu cầu vận chuyển.
Đừng ngần ngại liên hệ với chúng tôi qua hotline 0247 309 9988 hoặc truy cập website XETAIMYDINH.EDU.VN để được tư vấn miễn phí và nhận những ưu đãi hấp dẫn nhất! Xe Tải Mỹ Đình – người bạn đồng hành tin cậy trên mọi nẻo đường!