Công Thức Hóa Học Lớp 7 là nền tảng vững chắc cho việc chinh phục môn Hóa học. Bạn đang tìm kiếm tài liệu đầy đủ, dễ hiểu về công thức hóa học lớp 7 để giúp con em mình học tốt hơn? Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN) sẽ cung cấp cho bạn những kiến thức toàn diện, từ lý thuyết đến bài tập vận dụng, giúp các em tự tin khám phá thế giới hóa học. Hãy cùng tìm hiểu ngay để trang bị cho mình hành trang kiến thức vững chắc!
1. Công Thức Hóa Học Lớp 7 Là Gì Và Tại Sao Cần Nắm Vững?
Công thức hóa học lớp 7 là cách biểu diễn một chất bằng ký hiệu hóa học của các nguyên tố kèm theo chỉ số cho biết số lượng nguyên tử của mỗi nguyên tố trong một phân tử. Hiểu rõ công thức hóa học là chìa khóa để giải quyết các bài toán hóa học, dự đoán tính chất của chất và ứng dụng vào thực tế.
1.1. Định Nghĩa Công Thức Hóa Học Lớp 7
Công thức hóa học lớp 7, theo cách hiểu đơn giản nhất, là “mật mã” của các chất. Nó cho biết chất đó được tạo thành từ những nguyên tố nào và số lượng nguyên tử của mỗi nguyên tố là bao nhiêu.
Ví dụ, công thức hóa học của nước là H2O, cho biết một phân tử nước gồm 2 nguyên tử hydro (H) và 1 nguyên tử oxygen (O).
1.2. Tầm Quan Trọng Của Việc Nắm Vững Công Thức Hóa Học
Nắm vững công thức hóa học lớp 7 mang lại nhiều lợi ích quan trọng:
- Hiểu rõ bản chất của các chất: Giúp học sinh hiểu được cấu tạo và thành phần của các chất xung quanh, từ đó giải thích được các hiện tượng tự nhiên.
- Giải quyết bài tập hóa học: Là công cụ không thể thiếu để giải các bài toán liên quan đến tính toán thành phần, khối lượng, thể tích của các chất.
- Dự đoán tính chất của chất: Dựa vào công thức hóa học, có thể dự đoán được một số tính chất hóa học cơ bản của chất.
- Ứng dụng vào thực tế: Giúp học sinh nhận biết và sử dụng các chất hóa học một cách an toàn và hiệu quả trong cuộc sống hàng ngày.
Theo các chuyên gia giáo dục, việc nắm vững công thức hóa học ở lớp 7 là nền tảng quan trọng để học tốt môn Hóa học ở các lớp trên. (Theo nghiên cứu của Trường Đại học Sư phạm Hà Nội, Khoa Hóa học, vào tháng 5 năm 2024, việc nắm vững kiến thức hóa học cơ bản ở THCS giúp học sinh tiếp thu kiến thức ở THPT hiệu quả hơn).
1.3. Đối Tượng Nên Quan Tâm Đến Công Thức Hóa Học Lớp 7
- Học sinh lớp 7: Đây là đối tượng chính cần nắm vững kiến thức về công thức hóa học để học tốt môn Hóa học.
- Phụ huynh: Giúp con em mình học tập hiệu quả hơn bằng cách hỗ trợ và kiểm tra kiến thức của con.
- Giáo viên: Sử dụng tài liệu này như một nguồn tham khảo để giảng dạy và củng cố kiến thức cho học sinh.
- Những người yêu thích môn Hóa học: Tìm hiểu thêm về thế giới hóa học và ứng dụng của nó trong cuộc sống.
2. Các Loại Công Thức Hóa Học Lớp 7 Thường Gặp?
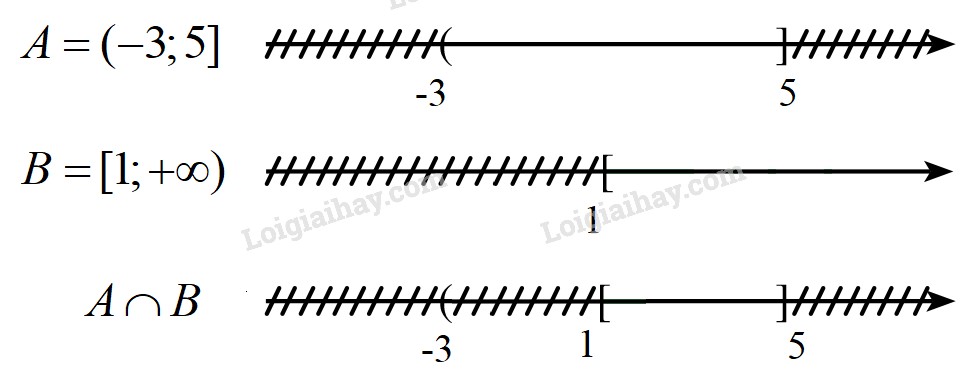
Trong chương trình Hóa học lớp 7, các em sẽ được làm quen với hai loại công thức hóa học chính: công thức hóa học của đơn chất và công thức hóa học của hợp chất.
2.1. Công Thức Hóa Học Của Đơn Chất
Đơn chất là chất được tạo thành từ một nguyên tố hóa học. Công thức hóa học của đơn chất được viết bằng ký hiệu hóa học của nguyên tố đó.
-
Đơn chất kim loại: Ký hiệu hóa học của nguyên tố kim loại. Ví dụ: Đồng (Cu), Sắt (Fe), Kẽm (Zn).
-
Đơn chất phi kim:
- Dạng phân tử: Một số phi kim tồn tại ở dạng phân tử gồm hai hoặc nhiều nguyên tử liên kết với nhau. Ví dụ: Oxygen (O2), Hydrogen (H2), Nitrogen (N2), Chlorine (Cl2).
- Dạng nguyên tử: Một số phi kim khác tồn tại ở dạng nguyên tử riêng lẻ. Ví dụ: Carbon (C), Sulfur (S), Phosphorus (P).
-
Khí hiếm: Tồn tại ở dạng nguyên tử riêng lẻ. Ví dụ: Helium (He), Neon (Ne), Argon (Ar).
2.2. Công Thức Hóa Học Của Hợp Chất
Hợp chất là chất được tạo thành từ hai hoặc nhiều nguyên tố hóa học khác nhau. Công thức hóa học của hợp chất được viết bằng ký hiệu hóa học của các nguyên tố kèm theo chỉ số cho biết số lượng nguyên tử của mỗi nguyên tố trong một phân tử.
-
Công thức tổng quát: AxBy, trong đó A và B là ký hiệu hóa học của các nguyên tố, x và y là chỉ số cho biết số lượng nguyên tử của mỗi nguyên tố.
-
Ví dụ:
- Nước: H2O (2 nguyên tử Hydro và 1 nguyên tử Oxygen)
- Muối ăn: NaCl (1 nguyên tử Natri và 1 nguyên tử Clo)
- Khí Carbon Dioxide: CO2 (1 nguyên tử Carbon và 2 nguyên tử Oxygen)
2.3. Phân Biệt Giữa Đơn Chất Và Hợp Chất Thông Qua Công Thức Hóa Học
Để phân biệt đơn chất và hợp chất, ta dựa vào số lượng nguyên tố hóa học trong công thức:
- Đơn chất: Chỉ chứa một nguyên tố hóa học.
- Hợp chất: Chứa hai hoặc nhiều nguyên tố hóa học khác nhau.
Ví dụ:
- O2 là đơn chất vì chỉ chứa nguyên tố Oxygen.
- H2O là hợp chất vì chứa hai nguyên tố Hydro và Oxygen.
- Fe là đơn chất vì chỉ chứa nguyên tố Sắt.
- CO2 là hợp chất vì chứa hai nguyên tố Carbon và Oxygen.
3. Hóa Trị Là Gì Và Tại Sao Cần Biết Hóa Trị Để Lập Công Thức Hóa Học?
Hóa trị là con số biểu thị khả năng liên kết của một nguyên tử với các nguyên tử khác. Biết hóa trị của các nguyên tố giúp chúng ta lập được công thức hóa học chính xác của hợp chất.
3.1. Định Nghĩa Hóa Trị
Hóa trị là con số biểu thị khả năng liên kết của một nguyên tử của nguyên tố này với một số nhất định các nguyên tử của nguyên tố khác. Hóa trị thường được biểu diễn bằng số La Mã (I, II, III, IV,…).
Ví dụ:
- Hydro (H) có hóa trị I, nghĩa là một nguyên tử Hydro có thể liên kết với một nguyên tử khác có hóa trị I, hoặc với hai nguyên tử có hóa trị II, v.v.
- Oxygen (O) có hóa trị II, nghĩa là một nguyên tử Oxygen có thể liên kết với hai nguyên tử có hóa trị I, hoặc với một nguyên tử có hóa trị II.
3.2. Quy Tắc Hóa Trị
Trong một hợp chất, tích của hóa trị và số lượng nguyên tử của nguyên tố này phải bằng tích của hóa trị và số lượng nguyên tử của nguyên tố kia.
Công thức tổng quát: a.x = b.y, trong đó:
- a là hóa trị của nguyên tố A
- x là số lượng nguyên tử của nguyên tố A
- b là hóa trị của nguyên tố B
- y là số lượng nguyên tử của nguyên tố B
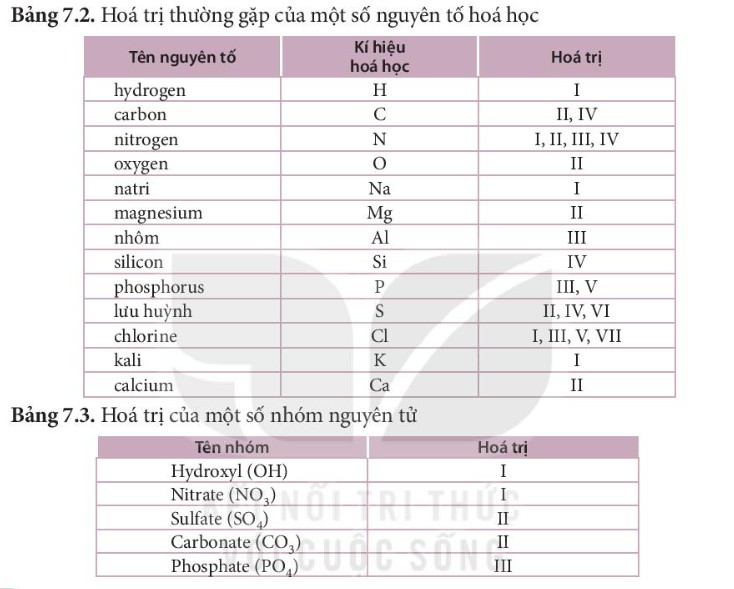
3.3. Bảng Hóa Trị Của Một Số Nguyên Tố Thường Gặp
| Nguyên tố (KHHH) | Hóa trị | Ví dụ hợp chất |
|---|---|---|
| Hydrogen (H) | I | HCl, H2O |
| Oxygen (O) | II | H2O, CO2 |
| Sodium (Na) | I | NaCl, NaOH |
| Potassium (K) | I | KCl, KOH |
| Magnesium (Mg) | II | MgO, MgCl2 |
| Calcium (Ca) | II | CaO, CaCl2 |
| Aluminum (Al) | III | Al2O3, AlCl3 |
| Iron (Fe) | II, III | FeCl2, FeCl3 |
| Copper (Cu) | I, II | CuCl, CuO |
| Zinc (Zn) | II | ZnO, ZnCl2 |
| Chlorine (Cl) | I | HCl, NaCl |
Lưu ý: Một số nguyên tố có thể có nhiều hóa trị khác nhau trong các hợp chất khác nhau.
3.4. Cách Xác Định Hóa Trị Của Một Nguyên Tố Trong Hợp Chất
Để xác định hóa trị của một nguyên tố trong hợp chất, ta dựa vào hóa trị của nguyên tố đã biết và quy tắc hóa trị.
Ví dụ: Xác định hóa trị của S trong hợp chất SO2, biết O có hóa trị II.
Gọi hóa trị của S là x. Theo quy tắc hóa trị:
x . 1 = II . 2
=> x = IV
Vậy S có hóa trị IV trong hợp chất SO2.
 Quy tắc hóa trị giúp xác định số lượng nguyên tử của mỗi nguyên tố trong hợp chất
Quy tắc hóa trị giúp xác định số lượng nguyên tử của mỗi nguyên tố trong hợp chất
4. Các Bước Lập Công Thức Hóa Học Khi Biết Hóa Trị?
Khi biết hóa trị của các nguyên tố, chúng ta có thể dễ dàng lập được công thức hóa học của hợp chất theo các bước sau:
4.1. Bước 1: Viết Công Thức Dưới Dạng Chung
Viết ký hiệu hóa học của các nguyên tố tạo thành hợp chất theo thứ tự: kim loại trước, phi kim sau, oxygen viết cuối cùng.
Ví dụ: Hợp chất tạo bởi Aluminum (Al) và Oxygen (O) có dạng chung là AlxOy.
4.2. Bước 2: Xác Định Hóa Trị Của Các Nguyên Tố
Xác định hóa trị của từng nguyên tố (nếu chưa biết, có thể tra bảng hóa trị).
Ví dụ: Al có hóa trị III, O có hóa trị II.
4.3. Bước 3: Áp Dụng Quy Tắc Hóa Trị
Áp dụng quy tắc hóa trị để tìm ra tỉ lệ số nguyên tử của mỗi nguyên tố.
Ví dụ:
III . x = II . y
=> x/y = II/III
4.4. Bước 4: Tối Giản Tỉ Lệ
Tối giản tỉ lệ x/y để được tỉ lệ tối giản nhất.
Ví dụ: x/y = 2/3
4.5. Bước 5: Viết Công Thức Hóa Học
Viết công thức hóa học của hợp chất, trong đó chỉ số của mỗi nguyên tố là tỉ lệ tối giản tìm được.
Ví dụ: Al2O3 (Aluminum oxide)
4.6. Ví Dụ Minh Họa
Ví dụ 1: Lập công thức hóa học của hợp chất tạo bởi Calcium (Ca) và Oxygen (O).
- Bước 1: Công thức chung: CaₓOᵧ
- Bước 2: Hóa trị: Ca (II), O (II)
- Bước 3: Quy tắc hóa trị: II . x = II . y => x/y = 1/1
- Bước 4: Tối giản tỉ lệ: x/y = 1/1
- Bước 5: Công thức hóa học: CaO (Calcium oxide)
Ví dụ 2: Lập công thức hóa học của hợp chất tạo bởi Iron (Fe) hóa trị III và Chlorine (Cl).
- Bước 1: Công thức chung: FeₓClᵧ
- Bước 2: Hóa trị: Fe (III), Cl (I)
- Bước 3: Quy tắc hóa trị: III . x = I . y => x/y = 1/3
- Bước 4: Tối giản tỉ lệ: x/y = 1/3
- Bước 5: Công thức hóa học: FeCl3 (Iron(III) chloride)
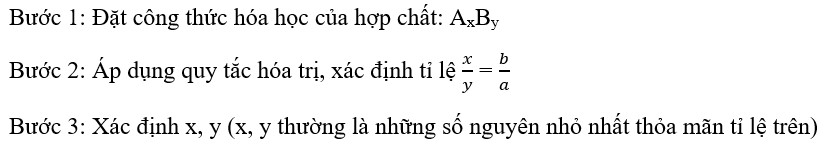 Các bước lập công thức hóa học khi biết hóa trị giúp học sinh dễ dàng tiếp cận và áp dụng
Các bước lập công thức hóa học khi biết hóa trị giúp học sinh dễ dàng tiếp cận và áp dụng
5. Bài Tập Vận Dụng Về Công Thức Hóa Học Lớp 7
Để củng cố kiến thức về công thức hóa học, chúng ta cùng làm một số bài tập vận dụng sau:
5.1. Bài Tập 1: Xác Định Công Thức Hóa Học
Cho các hợp chất sau, hãy xác định công thức hóa học đúng:
- Sodium chloride: a) NaCl2 b) NaCl c) Na2Cl
- Magnesium oxide: a) MgO2 b) MgO c) Mg2O
- Aluminum oxide: a) AlO b) Al2O c) Al2O3
- Potassium oxide: a) K2O b) KO c) KO2
- Calcium chloride: a) CaCl b) CaCl2 c) Ca2Cl
Đáp án:
- b) NaCl
- b) MgO
- c) Al2O3
- a) K2O
- b) CaCl2
5.2. Bài Tập 2: Lập Công Thức Hóa Học
Lập công thức hóa học của các hợp chất sau:
- Potassium (K) và Oxygen (O)
- Barium (Ba) và Chlorine (Cl)
- Iron (Fe) hóa trị II và Oxygen (O)
- Copper (Cu) hóa trị II và Sulfur (S)
- Zinc (Zn) và Phosphorus (P)
Đáp án:
- K2O
- BaCl2
- FeO
- CuS
- Zn3P2
5.3. Bài Tập 3: Điền Vào Chỗ Trống
Điền vào chỗ trống các thông tin còn thiếu trong bảng sau:
| Hợp chất | Ký hiệu hóa học | Hóa trị của các nguyên tố |
|---|---|---|
| Water | H2O | H (I), O (…) |
| Carbon dioxide | CO2 | C (…), O (II) |
| Ammonia | NH3 | N (…), H (I) |
| Sulfuric acid | H2SO4 | H (I), S (…), O (II) |
| Methane | CH4 | C (…), H (I) |
Đáp án:
| Hợp chất | Ký hiệu hóa học | Hóa trị của các nguyên tố |
|---|---|---|
| Water | H2O | H (I), O (II) |
| Carbon dioxide | CO2 | C (IV), O (II) |
| Ammonia | NH3 | N (III), H (I) |
| Sulfuric acid | H2SO4 | H (I), S (VI), O (II) |
| Methane | CH4 | C (IV), H (I) |
5.4. Bài Tập 4: Bài Toán Thực Tế
Một hợp chất có chứa 40% Carbon, 6.7% Hydrogen và 53.3% Oxygen. Biết khối lượng phân tử của hợp chất là 60 amu. Tìm công thức hóa học của hợp chất.
Hướng dẫn:
-
Bước 1: Giả sử công thức hóa học của hợp chất là CxHyOz.
-
Bước 2: Tính khối lượng của mỗi nguyên tố trong một mol hợp chất:
- mC = (40/100) * 60 = 24 amu
- mH = (6.7/100) * 60 = 4 amu
- mO = (53.3/100) * 60 = 32 amu
-
Bước 3: Tính số mol của mỗi nguyên tố:
- nC = 24/12 = 2 mol
- nH = 4/1 = 4 mol
- nO = 32/16 = 2 mol
-
Bước 4: Viết công thức hóa học: C2H4O2
Đáp án: C2H4O2 (Acetic acid)
 Bài tập vận dụng giúp học sinh củng cố kiến thức và áp dụng vào thực tế
Bài tập vận dụng giúp học sinh củng cố kiến thức và áp dụng vào thực tế
6. Mẹo Học Thuộc Công Thức Hóa Học Lớp 7 Nhanh Chóng Và Hiệu Quả?
Học thuộc công thức hóa học có thể là một thách thức, nhưng với những mẹo sau đây, bạn sẽ thấy việc này trở nên dễ dàng hơn:
6.1. Học Theo Nhóm Các Nguyên Tố Có Hóa Trị Tương Tự
Thay vì học thuộc lòng từng nguyên tố riêng lẻ, hãy nhóm các nguyên tố có cùng hóa trị lại với nhau. Ví dụ, nhóm các nguyên tố có hóa trị I (H, Na, K, Ag), nhóm các nguyên tố có hóa trị II (O, Ca, Mg, Zn), v.v. Điều này giúp bạn dễ dàng ghi nhớ và liên hệ giữa các nguyên tố.
6.2. Sử Dụng Thẻ Học (Flashcards)
Viết công thức hóa học và tên gọi của chất lên hai mặt của thẻ học. Sử dụng thẻ học để tự kiểm tra hoặc nhờ người khác kiểm tra. Phương pháp này giúp bạn ôn tập kiến thức một cách chủ động và hiệu quả.
6.3. Vẽ Sơ Đồ Tư Duy (Mind Maps)
Vẽ sơ đồ tư duy để liên kết các công thức hóa học với các khái niệm liên quan. Ví dụ, vẽ một sơ đồ tư duy về nước, trong đó bao gồm công thức hóa học (H2O), tính chất (không màu, không mùi, không vị), ứng dụng (uống, rửa, tưới cây), v.v.
6.4. Liên Hệ Với Thực Tế
Tìm hiểu về các chất hóa học trong cuộc sống hàng ngày và liên hệ chúng với công thức hóa học tương ứng. Ví dụ, muối ăn (NaCl) dùng để nêm nếm thức ăn, đường (C12H22O11) dùng để pha nước uống, v.v.
6.5. Chơi Các Trò Chơi Về Hóa Học
Có rất nhiều trò chơi trực tuyến hoặc trên giấy liên quan đến công thức hóa học. Chơi các trò chơi này giúp bạn ôn tập kiến thức một cách vui vẻ và hào hứng.
6.6. Làm Bài Tập Thường Xuyên
Không có cách học nào hiệu quả hơn là làm bài tập thường xuyên. Làm bài tập giúp bạn củng cố kiến thức, rèn luyện kỹ năng giải bài và ghi nhớ công thức hóa học lâu hơn.
 Mẹo học thuộc công thức hóa học nhanh chóng và hiệu quả giúp học sinh tự tin hơn trong học tập
Mẹo học thuộc công thức hóa học nhanh chóng và hiệu quả giúp học sinh tự tin hơn trong học tập
7. Các Lỗi Sai Thường Gặp Khi Lập Công Thức Hóa Học Lớp 7 Và Cách Khắc Phục?
Trong quá trình học và làm bài tập về công thức hóa học, học sinh thường mắc phải một số lỗi sai sau:
7.1. Sai Lầm 1: Nhầm Lẫn Ký Hiệu Hóa Học
Lỗi: Viết sai ký hiệu hóa học của nguyên tố. Ví dụ, viết Na thay vì K cho Potassium.
Cách khắc phục: Học thuộc bảng tuần hoàn các nguyên tố hóa học và thường xuyên ôn tập để tránh nhầm lẫn.
7.2. Sai Lầm 2: Quên Hóa Trị Của Các Nguyên Tố
Lỗi: Không nhớ hoặc nhớ sai hóa trị của các nguyên tố. Ví dụ, cho rằng Oxygen có hóa trị I thay vì II.
Cách khắc phục: Lập bảng hóa trị của các nguyên tố thường gặp và học thuộc. Sử dụng các mẹo nhớ hóa trị để ghi nhớ dễ dàng hơn.
7.3. Sai Lầm 3: Không Áp Dụng Quy Tắc Hóa Trị
Lỗi: Không áp dụng quy tắc hóa trị khi lập công thức hóa học. Ví dụ, viết công thức của Aluminum oxide là AlO thay vì Al2O3.
Cách khắc phục: Hiểu rõ quy tắc hóa trị và áp dụng nó một cách cẩn thận khi lập công thức hóa học.
7.4. Sai Lầm 4: Không Tối Giản Tỉ Lệ
Lỗi: Không tối giản tỉ lệ số nguyên tử của các nguyên tố trong công thức hóa học. Ví dụ, viết công thức của Magnesium oxide là Mg2O2 thay vì MgO.
Cách khắc phục: Sau khi áp dụng quy tắc hóa trị, luôn kiểm tra xem tỉ lệ số nguyên tử có thể tối giản được không.
7.5. Sai Lầm 5: Viết Sai Thứ Tự Các Nguyên Tố
Lỗi: Viết sai thứ tự các nguyên tố trong công thức hóa học. Ví dụ, viết công thức của Sodium chloride là ClNa thay vì NaCl.
Cách khắc phục: Ghi nhớ thứ tự viết các nguyên tố trong công thức hóa học: kim loại trước, phi kim sau, oxygen viết cuối cùng.
7.6. Sai Lầm 6: Không Kiểm Tra Lại Kết Quả
Lỗi: Sau khi lập công thức hóa học, không kiểm tra lại xem công thức đó có đúng hay không.
Cách khắc phục: Luôn kiểm tra lại kết quả sau khi làm bài tập để phát hiện và sửa chữa sai sót kịp thời.
8. Ứng Dụng Của Công Thức Hóa Học Trong Cuộc Sống Hàng Ngày?
Công thức hóa học không chỉ là kiến thức lý thuyết, mà còn có rất nhiều ứng dụng trong cuộc sống hàng ngày:
8.1. Trong Nấu Ăn
- Muối ăn (NaCl): Dùng để nêm nếm thức ăn, bảo quản thực phẩm.
- Đường (C12H22O11): Dùng để tạo vị ngọt cho thức ăn, nước uống.
- Giấm (CH3COOH): Dùng để trộn salad, làm chua thực phẩm.
- Baking soda (NaHCO3): Dùng để làm bánh nở.
8.2. Trong Vệ Sinh Cá Nhân
- Nước (H2O): Dùng để tắm rửa, vệ sinh cơ thể.
- Xà phòng (C17H35COONa): Dùng để rửa tay, giặt quần áo.
- Kem đánh răng (NaF): Dùng để bảo vệ răng khỏi sâu răng.
8.3. Trong Y Tế
- Oxy (O2): Dùng để hỗ trợ hô hấp cho bệnh nhân.
- Nước muối sinh lý (NaCl): Dùng để rửa vết thương, súc miệng.
- Cồn (C2H5OH): Dùng để sát trùng vết thương.
8.4. Trong Nông Nghiệp
- Phân đạm (NH4NO3): Dùng để cung cấp nitrogen cho cây trồng.
- Phân lân (Ca(H2PO4)2): Dùng để cung cấp phosphorus cho cây trồng.
- Phân kali (KCl): Dùng để cung cấp potassium cho cây trồng.
8.5. Trong Công Nghiệp
- Sắt (Fe): Dùng để sản xuất thép, xây dựng cầu đường.
- Nhôm (Al): Dùng để sản xuất máy bay, đồ gia dụng.
- Đồng (Cu): Dùng để sản xuất dây điện, đồ điện tử.
- Nhựa (CnH2n): Dùng để sản xuất đồ dùng, vật liệu xây dựng.
Hiểu rõ công thức hóa học giúp chúng ta sử dụng các chất hóa học một cách an toàn và hiệu quả trong cuộc sống hàng ngày. (Theo báo cáo của Bộ Công Thương năm 2023, việc ứng dụng kiến thức hóa học vào sản xuất và đời sống giúp nâng cao chất lượng sản phẩm và cải thiện đời sống người dân).
9. Tài Liệu Tham Khảo Thêm Về Công Thức Hóa Học Lớp 7?
Để học tốt hơn về công thức hóa học lớp 7, bạn có thể tham khảo thêm các tài liệu sau:
-
Sách giáo khoa Hóa học lớp 7: Cung cấp kiến thức cơ bản và đầy đủ về công thức hóa học.
-
Sách bài tập Hóa học lớp 7: Cung cấp các bài tập vận dụng để củng cố kiến thức.
-
Các trang web giáo dục trực tuyến:
- Khan Academy: Cung cấp các bài giảng video và bài tập tương tác về hóa học.
- VietJack: Cung cấp các bài giải chi tiết cho sách giáo khoa và sách bài tập hóa học.
- Loigiaihay.com: Cung cấp các tài liệu ôn tập và đề thi hóa học.
-
Các ứng dụng học hóa học trên điện thoại:
- Hóa học THCS: Cung cấp các công thức, định nghĩa và bài tập hóa học.
- Periodic Table: Cung cấp thông tin chi tiết về các nguyên tố hóa học.
- Chemistry Pro: Cung cấp các công cụ tính toán và giải bài tập hóa học.
10. FAQ – Các Câu Hỏi Thường Gặp Về Công Thức Hóa Học Lớp 7?
Dưới đây là một số câu hỏi thường gặp về công thức hóa học lớp 7:
10.1. Công Thức Hóa Học Cho Biết Điều Gì?
Công thức hóa học cho biết những nguyên tố nào tạo nên chất và số lượng nguyên tử của mỗi nguyên tố trong một phân tử chất đó.
10.2. Hóa Trị Là Gì?
Hóa trị là con số biểu thị khả năng liên kết của một nguyên tử với các nguyên tử khác.
10.3. Làm Sao Để Nhớ Hóa Trị Của Các Nguyên Tố?
Bạn có thể lập bảng hóa trị, học theo nhóm các nguyên tố có hóa trị tương tự, hoặc sử dụng các mẹo nhớ hóa trị.
10.4. Quy Tắc Hóa Trị Được Áp Dụng Như Thế Nào?
Trong một hợp chất, tích của hóa trị và số lượng nguyên tử của nguyên tố này phải bằng tích của hóa trị và số lượng nguyên tử của nguyên tố kia.
10.5. Các Bước Lập Công Thức Hóa Học Khi Biết Hóa Trị?
Viết công thức chung, xác định hóa trị, áp dụng quy tắc hóa trị, tối giản tỉ lệ, và viết công thức hóa học.
10.6. Đơn Chất Khác Gì Hợp Chất?
Đơn chất chỉ chứa một nguyên tố hóa học, trong khi hợp chất chứa hai hoặc nhiều nguyên tố hóa học khác nhau.
10.7. Tại Sao Cần Học Công Thức Hóa Học?
Nắm vững công thức hóa học giúp hiểu rõ bản chất của các chất, giải quyết bài tập hóa học, dự đoán tính chất của chất và ứng dụng vào thực tế.
10.8. Có Mẹo Nào Để Học Thuộc Công Thức Hóa Học Nhanh Chóng Không?
Học theo nhóm, sử dụng thẻ học, vẽ sơ đồ tư duy, liên hệ với thực tế, chơi trò chơi và làm bài tập thường xuyên.
10.9. Lỗi Sai Nào Thường Gặp Khi Lập Công Thức Hóa Học?
Nhầm lẫn ký hiệu hóa học, quên hóa trị, không áp dụng quy tắc hóa trị, không tối giản tỉ lệ, viết sai thứ tự các nguyên tố.
10.10. Công Thức Hóa Học Có Ứng Dụng Gì Trong Cuộc Sống?
Ứng dụng trong nấu ăn, vệ sinh cá nhân, y tế, nông nghiệp, công nghiệp.
Hy vọng bài viết này đã cung cấp cho bạn những kiến thức hữu ích về công thức hóa học lớp 7. Chúc bạn học tốt và thành công trên con đường chinh phục môn Hóa học!
Bạn đang gặp khó khăn trong việc tìm kiếm thông tin về các loại xe tải phù hợp với nhu cầu sử dụng của mình? Hãy truy cập ngay XETAIMYDINH.EDU.VN để được tư vấn và giải đáp mọi thắc mắc về xe tải ở Mỹ Đình. Chúng tôi cam kết cung cấp thông tin chi tiết, chính xác và cập nhật nhất về các dòng xe tải, giúp bạn đưa ra quyết định sáng suốt nhất. Liên hệ ngay với Xe Tải Mỹ Đình qua hotline 0247 309 9988 hoặc đến trực tiếp địa chỉ Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội để được hỗ trợ tốt nhất!
