Chất vô cơ là những hợp chất hóa học quen thuộc, đóng vai trò quan trọng trong nhiều lĩnh vực của đời sống. Vậy Chất Vô Cơ Là Gì và chúng được phân loại như thế nào? Hãy cùng XETAIMYDINH.EDU.VN khám phá chi tiết về định nghĩa, đặc điểm nhận dạng, tính chất và ứng dụng của các hợp chất này, giúp bạn có cái nhìn toàn diện và sâu sắc hơn.
1. Chất Vô Cơ Là Gì? Định Nghĩa Chi Tiết
Chất vô cơ là tên gọi chung của các hợp chất hóa học không chứa nguyên tử Cacbon (C) trong thành phần cấu tạo, ngoại trừ một số trường hợp đặc biệt như: khí CO, khí CO2, H2CO3, các muối cacbonat, hydrocarbonat và carbide kim loại. Theo nghiên cứu của Trường Đại học Khoa học Tự nhiên, Đại học Quốc gia Hà Nội năm 2023, các hợp chất vô cơ đóng vai trò quan trọng trong nhiều ngành công nghiệp và đời sống hàng ngày.
Chất vô cơ có nguồn gốc từ các quá trình địa chất và tồn tại phong phú trong tự nhiên. Chúng cũng được tổng hợp trong phòng thí nghiệm, nhà máy, khu nghiên cứu và ứng dụng trong các hoạt động thường ngày. Ví dụ, theo Tổng cục Thống kê, ngành công nghiệp hóa chất Việt Nam năm 2022 sản xuất hàng triệu tấn chất vô cơ phục vụ cho nông nghiệp, xây dựng và các ngành công nghiệp khác.
 Hợp chất vô cơ trong tự nhiên
Hợp chất vô cơ trong tự nhiên
Ảnh 1: Các hợp chất vô cơ tồn tại phong phú trong tự nhiên, đóng vai trò quan trọng trong nhiều quá trình địa chất.
1.1. Tại Sao Cần Phân Biệt Chất Vô Cơ Và Hữu Cơ?
Việc phân biệt giữa chất vô cơ và hữu cơ là cần thiết vì chúng có cấu trúc, tính chất và ứng dụng khác nhau. Dưới đây là bảng so sánh chi tiết:
| Đặc điểm | Chất Vô Cơ | Chất Hữu Cơ |
|---|---|---|
| Thành phần chính | Không chứa Cacbon (trừ một số ngoại lệ) | Chứa Cacbon, thường có Hidro, Oxi, Nitơ, và các nguyên tố khác |
| Liên kết | Liên kết ion, liên kết cộng hóa trị phân cực | Liên kết cộng hóa trị không phân cực hoặc ít phân cực |
| Tính chất vật lý | Thường có nhiệt độ nóng chảy và sôi cao, dẫn điện tốt (nếu là muối nóng chảy hoặc dung dịch), tan tốt trong nước | Thường có nhiệt độ nóng chảy và sôi thấp, ít hoặc không dẫn điện, tan trong dung môi hữu cơ, ít tan trong nước |
| Tính chất hóa học | Phản ứng thường xảy ra nhanh, tạo ra các sản phẩm đơn giản | Phản ứng thường xảy ra chậm, tạo ra các sản phẩm phức tạp |
| Ứng dụng | Sản xuất phân bón, vật liệu xây dựng, chất tẩy rửa, dược phẩm, hóa chất công nghiệp | Sản xuất nhựa, cao su, dược phẩm, thực phẩm, mỹ phẩm, nhiên liệu |
| Nguồn gốc | Khoáng sản, quặng, không khí, nước | Sinh vật sống, sản phẩm của sinh vật, tổng hợp hóa học |
1.2. Vai Trò Của Chất Vô Cơ Trong Đời Sống Và Sản Xuất
Chất vô cơ đóng vai trò then chốt trong nhiều ngành công nghiệp và lĩnh vực của đời sống:
- Nông nghiệp: Phân bón vô cơ (như đạm, lân, kali) cung cấp dinh dưỡng cho cây trồng, tăng năng suất và chất lượng nông sản.
- Xây dựng: Xi măng, vôi, cát, đá là những vật liệu xây dựng vô cơ cơ bản, tạo nên các công trình kiên cố và bền vững.
- Công nghiệp hóa chất: Axit sulfuric (H2SO4), natri hidroxit (NaOH), amoniac (NH3) là những hóa chất vô cơ quan trọng, được sử dụng rộng rãi trong sản xuất và các quá trình công nghiệp khác.
- Y tế: Nhiều hợp chất vô cơ được sử dụng làm thuốc, chất khử trùng, vật liệu nha khoa và các ứng dụng y tế khác.
- Môi trường: Chất vô cơ được sử dụng trong xử lý nước thải, khí thải, và các vấn đề môi trường khác.
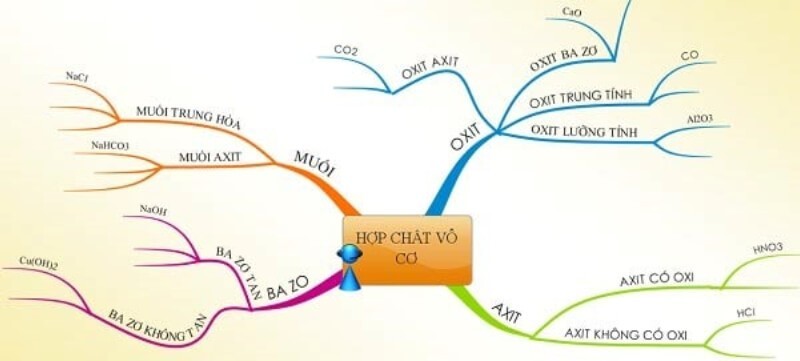
2. Phân Loại Chi Tiết Các Hợp Chất Vô Cơ
Các hợp chất vô cơ được phân loại thành bốn nhóm chính dựa trên thành phần và tính chất hóa học: oxit, axit, bazơ và muối.
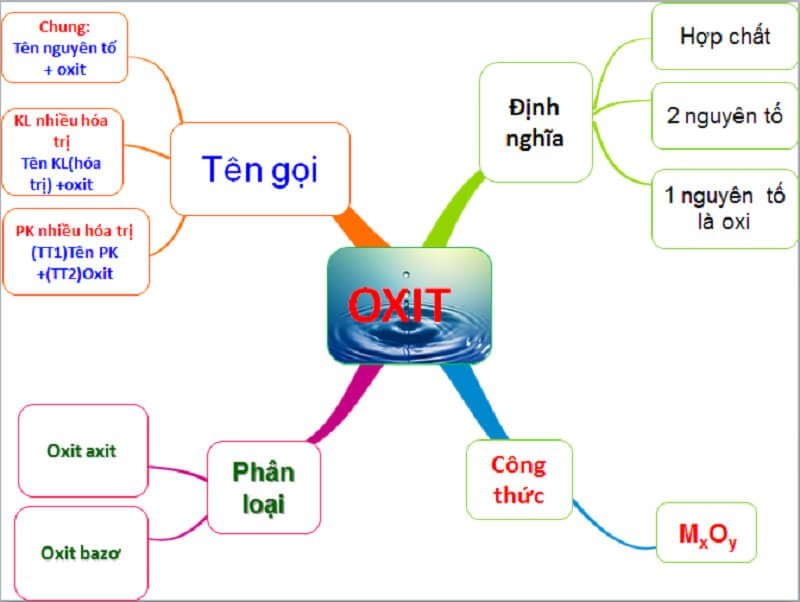
2.1. Oxit Là Gì?
Oxit là hợp chất hóa học được tạo thành từ hai nguyên tố, trong đó một nguyên tố là oxi và nguyên tố còn lại không phải là flo. Theo Sách giáo khoa Hóa học lớp 9, oxit là một trong những loại hợp chất vô cơ quan trọng nhất.
- Công thức tổng quát: MxOy, trong đó M là nguyên tố khác O, x và y là chỉ số biểu thị số lượng nguyên tử của mỗi nguyên tố.
- Ví dụ: Fe2O3 (oxit sắt(III)), CuO (oxit đồng(II)), Na2O (oxit natri), BaO (oxit bari).
2.1.1. Phân Loại Oxit
Oxit được phân loại thành 4 loại chính:
- Oxit bazơ: Oxit tác dụng với axit tạo thành muối và nước. Ví dụ: Na2O, CaO, FeO, CuO.
- Oxit axit: Oxit tác dụng với bazơ tạo thành muối và nước. Ví dụ: SO2, CO2, P2O5, N2O5.
- Oxit lưỡng tính: Oxit tác dụng được với cả axit và bazơ. Ví dụ: Al2O3, ZnO, Cr2O3.
- Oxit trung tính (oxit không tạo muối): Oxit không tác dụng với axit và bazơ. Ví dụ: CO, NO, N2O.
2.1.2. Tính Chất Hóa Học Của Oxit
- Tác dụng với nước:
- Oxit bazơ tan trong nước tạo thành bazơ (kiềm). Ví dụ:
Na2O + H2O → 2NaOH CaO + H2O → Ca(OH)2 - Oxit axit tan trong nước tạo thành axit. Ví dụ:
SO2 + H2O → H2SO3 CO2 + H2O → H2CO3
- Oxit bazơ tan trong nước tạo thành bazơ (kiềm). Ví dụ:
- Tác dụng với axit: Oxit bazơ tác dụng với axit tạo thành muối và nước. Ví dụ:
CuO + 2HCl → CuCl2 + H2O FeO + H2SO4 → FeSO4 + H2O - Tác dụng với bazơ: Oxit axit tác dụng với bazơ tạo thành muối và nước. Ví dụ:
CO2 + 2NaOH → Na2CO3 + H2O SO2 + Ca(OH)2 → CaSO3 + H2O - Tác dụng với oxit khác: Một số oxit có thể tác dụng với nhau để tạo thành oxit mới. Ví dụ:
CaO + SiO2 → CaSiO3
2.1.3. Ứng Dụng Của Oxit
Oxit có nhiều ứng dụng quan trọng trong đời sống và công nghiệp:
- Sản xuất kim loại: Fe2O3 (quặng hematit) được dùng để sản xuất gang thép.
- Vật liệu xây dựng: CaO (vôi sống) được dùng để sản xuất vữa xây dựng.
- Sản xuất axit: SO2 được dùng để sản xuất axit sulfuric (H2SO4).
- Chất hút ẩm: CaO được dùng làm chất hút ẩm trong phòng thí nghiệm và công nghiệp.
- Chất tạo màu: Các oxit kim loại như Cr2O3, Fe2O3 được dùng làm chất tạo màu trong sản xuất gốm sứ, thủy tinh.
 Ứng dụng của oxit trong sản xuất
Ứng dụng của oxit trong sản xuất
Ảnh 2: Oxit đóng vai trò quan trọng trong nhiều quy trình sản xuất công nghiệp, từ sản xuất kim loại đến vật liệu xây dựng.
2.2. Axit Là Gì?
Axit là hợp chất hóa học có khả năng hòa tan trong nước và tạo ra ion H+ (proton). Axit có vị chua, làm đổi màu chất chỉ thị (ví dụ, quỳ tím hóa đỏ) và có khả năng tác dụng với nhiều chất khác.
- Công thức tổng quát: HxA, trong đó A là gốc axit và x là hóa trị của gốc axit.
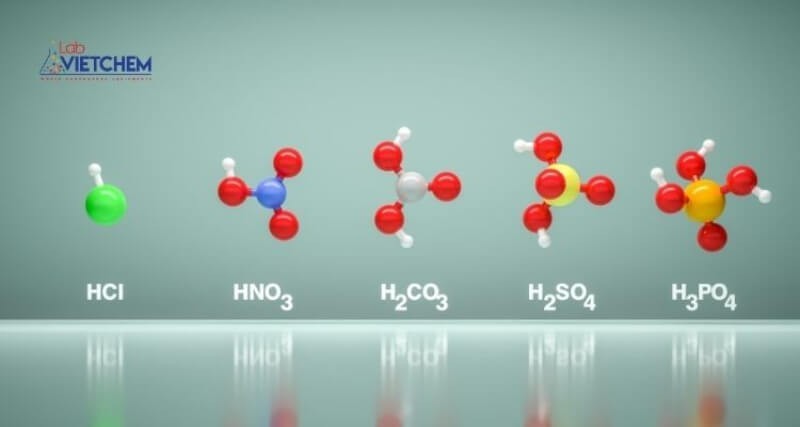
- Ví dụ: H2SO4 (axit sulfuric), HCl (axit clohidric), HNO3 (axit nitric), HBr (axit bromhidric).
2.2.1. Phân Loại Axit
Axit được phân loại dựa trên nhiều tiêu chí khác nhau:
- Theo số nguyên tử hidro có thể thay thế:
- Axit một nấc: HCl, HNO3
- Axit nhiều nấc: H2SO4, H3PO4
- Theo gốc axit:
- Axit có oxi: H2SO4, HNO3, H3PO4
- Axit không có oxi: HCl, HBr, HF
- Theo độ mạnh:
- Axit mạnh: HCl, H2SO4, HNO3
- Axit yếu: H2CO3, CH3COOH
2.2.2. Tính Chất Hóa Học Của Axit
- Tác dụng với chất chỉ thị: Làm đổi màu chất chỉ thị (quỳ tím hóa đỏ, phenolphtalein không màu).
- Tác dụng với kim loại: Axit tác dụng với nhiều kim loại tạo thành muối và khí hidro (H2). Ví dụ:
Fe + 2HCl → FeCl2 + H2 Zn + H2SO4 → ZnSO4 + H2 - Tác dụng với oxit bazơ: Axit tác dụng với oxit bazơ tạo thành muối và nước. Ví dụ:
CuO + 2HCl → CuCl2 + H2O FeO + H2SO4 → FeSO4 + H2O - Tác dụng với bazơ: Axit tác dụng với bazơ tạo thành muối và nước (phản ứng trung hòa). Ví dụ:
HCl + NaOH → NaCl + H2O H2SO4 + 2KOH → K2SO4 + 2H2O - Tác dụng với muối: Axit mạnh có thể đẩy axit yếu ra khỏi muối. Ví dụ:
HCl + Na2CO3 → 2NaCl + H2O + CO2 H2SO4 + BaCl2 → BaSO4 + 2HCl
2.2.3. Ứng Dụng Của Axit
Axit có nhiều ứng dụng quan trọng trong đời sống và công nghiệp:
- Sản xuất phân bón: H2SO4 được dùng để sản xuất phân superphotphat.
- Sản xuất hóa chất: HCl được dùng để sản xuất nhiều hóa chất công nghiệp.
- Tẩy rửa: HCl được dùng để tẩy rửa gỉ sét, cặn bẩn trên kim loại.
- Sản xuất dược phẩm: Nhiều axit được dùng trong sản xuất thuốc và các sản phẩm y tế.
- Chế biến thực phẩm: Axit axetic (CH3COOH) được dùng làm giấm ăn.
2.3. Bazơ Là Gì?
Bazơ là hợp chất hóa học có khả năng phân ly trong dung dịch nước tạo ra ion OH- (hidroxit). Bazơ có vị đắng, làm đổi màu chất chỉ thị (ví dụ, quỳ tím hóa xanh) và có khả năng tác dụng với axit.
- Công thức tổng quát: M(OH)n, trong đó M là kim loại và n là hóa trị của kim loại.
- Ví dụ: NaOH (natri hidroxit), Ca(OH)2 (canxi hidroxit), KOH (kali hidroxit), Ba(OH)2 (bari hidroxit).
2.3.1. Phân Loại Bazơ
Bazơ được phân loại thành hai loại chính:
- Bazơ tan (kiềm): Bazơ tan tốt trong nước. Ví dụ: NaOH, KOH, Ca(OH)2, Ba(OH)2.
- Bazơ không tan: Bazơ không tan hoặc ít tan trong nước. Ví dụ: Cu(OH)2, Fe(OH)2, Fe(OH)3, Al(OH)3.
2.3.2. Tính Chất Hóa Học Của Bazơ
- Tác dụng với chất chỉ thị: Làm đổi màu chất chỉ thị (quỳ tím hóa xanh, phenolphtalein hóa hồng).
- Tác dụng với axit: Bazơ tác dụng với axit tạo thành muối và nước (phản ứng trung hòa). Ví dụ:
NaOH + HCl → NaCl + H2O Ca(OH)2 + H2SO4 → CaSO4 + 2H2O - Tác dụng với oxit axit: Bazơ tác dụng với oxit axit tạo thành muối và nước. Ví dụ:
2NaOH + CO2 → Na2CO3 + H2O Ca(OH)2 + SO2 → CaSO3 + H2O - Tác dụng với muối: Bazơ có thể tác dụng với muối tạo thành muối mới và bazơ mới. Ví dụ:
NaOH + CuCl2 → Cu(OH)2 + 2NaCl Ca(OH)2 + Na2CO3 → CaCO3 + 2NaOH - Nhiệt phân hủy (đối với bazơ không tan): Bazơ không tan bị nhiệt phân hủy tạo thành oxit và nước. Ví dụ:
Cu(OH)2 → CuO + H2O Fe(OH)3 → Fe2O3 + 3H2O
2.3.3. Ứng Dụng Của Bazơ
Bazơ có nhiều ứng dụng quan trọng trong đời sống và công nghiệp:
- Sản xuất xà phòng: NaOH được dùng để sản xuất xà phòng.
- Sản xuất giấy: NaOH được dùng trong quá trình sản xuất giấy.
- Xử lý nước: Ca(OH)2 được dùng để xử lý nước thải, khử chua đất.
- Sản xuất hóa chất: NaOH được dùng để sản xuất nhiều hóa chất công nghiệp.
- Vật liệu xây dựng: Ca(OH)2 (vôi tôi) được dùng để sản xuất vữa xây dựng.
 Ứng dụng của bazơ trong đời sống
Ứng dụng của bazơ trong đời sống
Ảnh 3: Bazơ có nhiều ứng dụng trong đời sống hàng ngày, từ sản xuất xà phòng đến xử lý nước.
2.4. Muối Là Gì?
Muối là hợp chất hóa học được tạo thành khi thay thế một hay nhiều nguyên tử hidro trong phân tử axit bằng một hay nhiều ion kim loại hoặc ion amoni (NH4+). Muối có nhiều ứng dụng quan trọng trong đời sống và công nghiệp.
- Ví dụ: NaCl (natri clorua), CaCO3 (canxi cacbonat), Na2SO4 (natri sulfat), KNO3 (kali nitrat).
2.4.1. Phân Loại Muối
Muối được phân loại thành nhiều loại khác nhau:
- Muối trung hòa: Muối trong đó tất cả các nguyên tử hidro trong axit đã được thay thế bằng ion kim loại. Ví dụ: NaCl, K2SO4, CaCO3.
- Muối axit: Muối trong đó vẫn còn nguyên tử hidro trong gốc axit. Ví dụ: NaHCO3, NaHSO4.
- Muối bazơ: Muối chứa nhóm OH- trong thành phần. Ví dụ: Mg(OH)Cl, Cu(OH)Cl.
- Muối kép: Muối tạo bởi hai cation kim loại khác nhau và một anion gốc axit. Ví dụ: KAl(SO4)2.
- Muối hỗn tạp: Muối tạo bởi một cation kim loại và hai anion gốc axit khác nhau. Ví dụ: CaOCl2.
2.4.2. Tính Chất Hóa Học Của Muối
- Tác dụng với kim loại: Kim loại mạnh hơn có thể đẩy kim loại yếu hơn ra khỏi muối. Ví dụ:
Fe + CuSO4 → FeSO4 + Cu - Tác dụng với axit: Muối có thể tác dụng với axit tạo thành muối mới và axit mới. Ví dụ:
Na2CO3 + 2HCl → 2NaCl + H2O + CO2 - Tác dụng với bazơ: Muối có thể tác dụng với bazơ tạo thành muối mới và bazơ mới. Ví dụ:
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl - Tác dụng với muối: Hai muối có thể tác dụng với nhau tạo thành hai muối mới. Ví dụ:
AgNO3 + NaCl → AgCl + NaNO3 - Phản ứng nhiệt phân hủy: Một số muối bị nhiệt phân hủy tạo thành các sản phẩm khác nhau. Ví dụ:
CaCO3 → CaO + CO2
2.4.3. Ứng Dụng Của Muối
Muối có nhiều ứng dụng quan trọng trong đời sống và công nghiệp:
- Thực phẩm: NaCl (muối ăn) là gia vị quan trọng trong nấu ăn và bảo quản thực phẩm.
- Sản xuất hóa chất: Nhiều muối được dùng để sản xuất các hóa chất công nghiệp khác.
- Phân bón: Các muối như KNO3, (NH4)2SO4 được dùng làm phân bón.
- Y tế: Nhiều muối được dùng làm thuốc, chất sát trùng.
- Vật liệu xây dựng: CaCO3 (đá vôi) được dùng làm vật liệu xây dựng.
3. Các Hợp Chất Vô Cơ Thường Gặp Và Ứng Dụng Thực Tế
Các hợp chất vô cơ có mặt ở khắp mọi nơi trong cuộc sống hàng ngày và trong nhiều ngành công nghiệp khác nhau. Dưới đây là một số ví dụ điển hình:
- Axit sulfuric (H2SO4): Được sử dụng rộng rãi trong sản xuất phân bón, chất tẩy rửa, thuốc nhuộm, và nhiều ngành công nghiệp khác.
- Axit clohidric (HCl): Được sử dụng trong sản xuất hóa chất, tẩy rửa kim loại, và trong công nghiệp thực phẩm.
- Natri hidroxit (NaOH): Được sử dụng trong sản xuất xà phòng, giấy, và trong xử lý nước.
- Canxi hidroxit (Ca(OH)2): Được sử dụng trong xây dựng (vôi tôi), xử lý nước thải, và trong nông nghiệp để khử chua đất.
- Natri clorua (NaCl): Muối ăn, được sử dụng trong nấu ăn, bảo quản thực phẩm, và trong sản xuất hóa chất.
- Canxi cacbonat (CaCO3): Đá vôi, được sử dụng trong xây dựng, sản xuất xi măng, và trong công nghiệp giấy.
4. Cách Gọi Tên Các Hợp Chất Vô Cơ
Việc gọi tên các hợp chất vô cơ tuân theo một số quy tắc nhất định, giúp chúng ta dễ dàng nhận biết và phân biệt chúng.
4.1. Gọi Tên Oxit
Tên oxit được hình thành bằng cách ghép tên của nguyên tố với từ “oxit”. Nếu nguyên tố có nhiều hóa trị, cần chỉ rõ hóa trị của nguyên tố đó.
- Oxit kim loại: Tên kim loại + (hóa trị của kim loại, nếu có nhiều hóa trị) + oxit.
- Ví dụ:
- Na2O: Natri oxit
- FeO: Sắt(II) oxit
- Fe2O3: Sắt(III) oxit
- Ví dụ:
- Oxit phi kim: Tiền tố chỉ số nguyên tử phi kim + tên phi kim + tiền tố chỉ số nguyên tử oxi + oxit.
- Ví dụ:
- CO: Cacbon monoxit
- CO2: Cacbon đioxit
- SO2: Lưu huỳnh đioxit
- P2O5: Điphotpho pentaoxit
- Ví dụ:
4.2. Gọi Tên Bazơ
Tên bazơ được hình thành bằng cách ghép tên của kim loại với từ “hidroxit”. Nếu kim loại có nhiều hóa trị, cần chỉ rõ hóa trị của kim loại đó.
- Tên kim loại + (hóa trị của kim loại, nếu có nhiều hóa trị) + hidroxit.
- Ví dụ:
- NaOH: Natri hidroxit
- Ca(OH)2: Canxi hidroxit
- Fe(OH)2: Sắt(II) hidroxit
- Fe(OH)3: Sắt(III) hidroxit
- Ví dụ:
4.3. Gọi Tên Axit
Tên axit được hình thành theo các quy tắc sau:
- Axit không có oxi: Axit + tên phi kim + hidric.
- Ví dụ:
- HCl: Axit clohidric
- HBr: Axit bromhidric
- HF: Axit flohidric
- Ví dụ:
- Axit có oxi: Axit + tên phi kim + đuôi “ic” (nếu axit có nhiều oxi) hoặc đuôi “ơ” (nếu axit có ít oxi).
- Ví dụ:
- H2SO4: Axit sulfuric (nhiều oxi)
- H2SO3: Axit sunfuro (ít oxi)
- HNO3: Axit nitric (nhiều oxi)
- HNO2: Axit nitro (ít oxi)
- Ví dụ:
4.4. Gọi Tên Muối
Tên muối được hình thành bằng cách ghép tên của kim loại (hoặc gốc amoni) với tên của gốc axit. Nếu kim loại có nhiều hóa trị, cần chỉ rõ hóa trị của kim loại đó.
- Tên kim loại + (hóa trị của kim loại, nếu có nhiều hóa trị) + tên gốc axit.
- Ví dụ:
- NaCl: Natri clorua
- CaCO3: Canxi cacbonat
- FeCl2: Sắt(II) clorua
- FeCl3: Sắt(III) clorua
- (NH4)2SO4: Amoni sulfat
- Ví dụ:
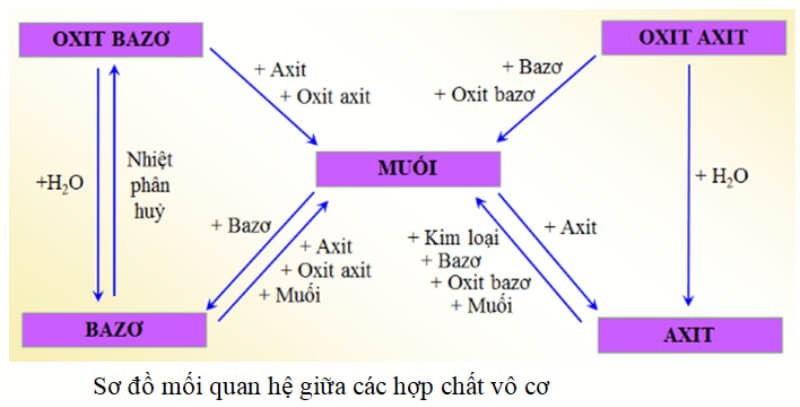
5. Sơ Đồ Tư Duy Về Hợp Chất Vô Cơ
Sơ đồ tư duy là một công cụ hữu ích để hệ thống hóa kiến thức về các loại hợp chất vô cơ và mối quan hệ giữa chúng.
 Sơ đồ tư duy hợp chất vô cơ
Sơ đồ tư duy hợp chất vô cơ
Ảnh 4: Sơ đồ tư duy giúp người học dễ dàng hình dung và ghi nhớ các khái niệm, phân loại và tính chất của hợp chất vô cơ.
 Sơ đồ tư duy hợp chất vô cơ chi tiết
Sơ đồ tư duy hợp chất vô cơ chi tiết
Ảnh 5: Một sơ đồ tư duy khác, thể hiện mối quan hệ giữa các loại hợp chất vô cơ và các phản ứng hóa học liên quan.
6. Bài Tập Về Hợp Chất Vô Cơ (Có Lời Giải Chi Tiết)
Để củng cố kiến thức về hợp chất vô cơ, chúng ta cùng làm một số bài tập ví dụ:
Bài 1: Hoàn thành chuỗi phản ứng sau:
Fe → FeCl2 → Fe(OH)2 → FeO → FeLời giải:
Fe + 2HCl → FeCl2 + H2FeCl2 + 2NaOH → Fe(OH)2 + 2NaClFe(OH)2 → FeO + H2O(nhiệt độ cao, không có không khí)FeO + H2 → Fe + H2O(nhiệt độ cao)
Bài 2: Cho các chất sau: CaO, CO2, NaOH, HCl, CuSO4. Viết các phương trình phản ứng có thể xảy ra giữa các chất này.
Lời giải:
CaO + H2O → Ca(OH)2CO2 + H2O → H2CO3CO2 + Ca(OH)2 → CaCO3 + H2ONaOH + HCl → NaCl + H2O2NaOH + CuSO4 → Cu(OH)2 + Na2SO4CaO + 2HCl → CaCl2 + H2OCa(OH)2 + 2HCl -> CaCl2 + 2H2O
Bài 3: Nhận biết các dung dịch mất nhãn sau: HCl, NaOH, NaCl.
Lời giải:
- Sử dụng quỳ tím:
- HCl làm quỳ tím hóa đỏ.
- NaOH làm quỳ tím hóa xanh.
- NaCl không làm đổi màu quỳ tím.
7. FAQ – Các Câu Hỏi Thường Gặp Về Chất Vô Cơ
Dưới đây là một số câu hỏi thường gặp về chất vô cơ:
- Chất vô cơ có dẫn điện không?
- Chất vô cơ có thể dẫn điện nếu là muối nóng chảy hoặc dung dịch.
- Chất vô cơ có tan trong nước không?
- Một số chất vô cơ tan tốt trong nước, một số ít tan hoặc không tan.
- Phân biệt chất vô cơ và hữu cơ như thế nào?
- Chất vô cơ không chứa Cacbon (trừ một số trường hợp), trong khi chất hữu cơ chứa Cacbon.
- Oxit axit là gì?
- Oxit axit là oxit tác dụng với bazơ tạo thành muối và nước.
- Bazơ mạnh là gì?
- Bazơ mạnh là bazơ tan tốt trong nước và phân ly hoàn toàn thành ion.
- Muối trung hòa là gì?
- Muối trung hòa là muối trong đó tất cả các nguyên tử hidro trong axit đã được thay thế bằng ion kim loại.
- Ứng dụng của chất vô cơ trong nông nghiệp là gì?
- Chất vô cơ được dùng làm phân bón để cung cấp dinh dưỡng cho cây trồng.
- Axit sulfuric có tính chất gì đặc biệt?
- Axit sulfuric là axit mạnh, có tính háo nước và được dùng rộng rãi trong công nghiệp.
- Natri hidroxit có độc hại không?
- Natri hidroxit là chất ăn mòn, có thể gây bỏng nếu tiếp xúc với da và mắt.
- Chất vô cơ có vai trò gì trong xử lý nước thải?
- Chất vô cơ được dùng để trung hòa axit, kết tủa các chất ô nhiễm trong nước thải.
8. Tìm Hiểu Thêm Về Xe Tải Tại Mỹ Đình
Nếu bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về các loại xe tải, giá cả, địa điểm mua bán uy tín và dịch vụ sửa chữa chất lượng tại khu vực Mỹ Đình, Hà Nội, hãy truy cập ngay XETAIMYDINH.EDU.VN. Tại đây, bạn sẽ tìm thấy:
- Thông tin chi tiết và cập nhật về các loại xe tải có sẵn ở Mỹ Đình, Hà Nội.
- So sánh giá cả và thông số kỹ thuật giữa các dòng xe.
- Tư vấn lựa chọn xe phù hợp với nhu cầu và ngân sách của bạn.
- Giải đáp các thắc mắc liên quan đến thủ tục mua bán, đăng ký và bảo dưỡng xe tải.
- Thông tin về các dịch vụ sửa chữa xe tải uy tín trong khu vực.
Liên hệ ngay với Xe Tải Mỹ Đình để được tư vấn và hỗ trợ tốt nhất:
- Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội.
- Hotline: 0247 309 9988
- Trang web: XETAIMYDINH.EDU.VN
Xe Tải Mỹ Đình cam kết mang đến cho bạn những thông tin chính xác, hữu ích và dịch vụ chuyên nghiệp nhất. Đừng ngần ngại liên hệ với chúng tôi để được giải đáp mọi thắc mắc và tìm được chiếc xe tải ưng ý nhất!