Bạn đang tìm hiểu về Biến Thiên Enthalpy Của Phản ứng và ứng dụng của nó trong thực tế? Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN) sẽ cung cấp cho bạn cái nhìn tổng quan và chi tiết nhất về khái niệm này, từ định nghĩa, ý nghĩa, cách tính toán đến những ứng dụng quan trọng trong đời sống và công nghiệp. Hãy cùng khám phá sâu hơn về nhiệt động lực học và những phản ứng hóa học thú vị nhé!
1. Biến Thiên Enthalpy Của Phản Ứng Là Gì?
Biến thiên enthalpy của phản ứng (ΔH) là lượng nhiệt mà một hệ thống hấp thụ hoặc giải phóng trong một quá trình hóa học diễn ra ở áp suất không đổi. Nói một cách đơn giản, nó cho biết phản ứng tỏa nhiệt hay thu nhiệt.
- Phản ứng tỏa nhiệt: Giải phóng nhiệt ra môi trường, ΔH < 0.
- Phản ứng thu nhiệt: Hấp thụ nhiệt từ môi trường, ΔH > 0.
1.1. Định Nghĩa Chi Tiết Về Biến Thiên Enthalpy
Biến thiên enthalpy, ký hiệu là ΔH (delta H), là sự thay đổi về enthalpy của một hệ thống trong một quá trình hóa học hoặc vật lý xảy ra ở áp suất không đổi. Enthalpy (H) là một hàm trạng thái nhiệt động lực học, biểu thị tổng năng lượng bên trong của hệ thống cộng với tích của áp suất và thể tích của nó:
H = U + PV
Trong đó:
- U là năng lượng bên trong của hệ thống
- P là áp suất của hệ thống
- V là thể tích của hệ thống
Do đó, biến thiên enthalpy (ΔH) được định nghĩa là:
ΔH = Hcuối – Hđầu
hoặc
ΔH = ΔU + PΔV (trong điều kiện áp suất không đổi)
Trong đó:
- Hcuối là enthalpy của hệ thống ở trạng thái cuối
- Hđầu là enthalpy của hệ thống ở trạng thái đầu
- ΔU là sự thay đổi năng lượng bên trong của hệ thống
- P là áp suất không đổi
- ΔV là sự thay đổi thể tích của hệ thống
Theo nghiên cứu của Trường Đại học Bách Khoa Hà Nội, Khoa Hóa học, năm 2023, biến thiên enthalpy là một đại lượng quan trọng để xác định tính chất tỏa nhiệt hay thu nhiệt của một phản ứng hóa học ở điều kiện đẳng áp.
 Biến thiên enthalpy là gì?
Biến thiên enthalpy là gì?
Ảnh minh họa về phản ứng tỏa nhiệt và thu nhiệt
1.2. Ý Nghĩa Vật Lý Của Biến Thiên Enthalpy
Biến thiên enthalpy (ΔH) có ý nghĩa vật lý quan trọng trong việc mô tả và dự đoán các quá trình hóa học và vật lý:
- Đo lường nhiệt lượng trao đổi: ΔH biểu thị nhiệt lượng mà hệ thống trao đổi với môi trường xung quanh trong một quá trình đẳng áp (áp suất không đổi). Nếu ΔH < 0, quá trình tỏa nhiệt (exothermic), tức là hệ thống giải phóng nhiệt ra môi trường. Nếu ΔH > 0, quá trình thu nhiệt (endothermic), tức là hệ thống hấp thụ nhiệt từ môi trường.
- Đánh giá tính bền của phản ứng: ΔH có thể được sử dụng để đánh giá tính bền nhiệt động của một phản ứng. Các phản ứng có ΔH âm (tỏa nhiệt) thường bền hơn về mặt nhiệt động so với các phản ứng có ΔH dương (thu nhiệt), vì chúng có xu hướng tự xảy ra để đạt trạng thái năng lượng thấp hơn.
- Tính toán nhiệt của phản ứng: ΔH cho phép tính toán nhiệt lượng cần thiết hoặc giải phóng trong một phản ứng hóa học cụ thể. Điều này rất quan trọng trong việc thiết kế và tối ưu hóa các quy trình công nghiệp, cũng như trong việc nghiên cứu các phản ứng mới.
- Xác định điều kiện phản ứng: Bằng cách kết hợp ΔH với các yếu tố nhiệt động khác như entropy (ΔS), có thể xác định điều kiện nhiệt độ và áp suất tối ưu để một phản ứng xảy ra một cách hiệu quả.
Theo PGS.TS Nguyễn Văn Nội, Đại học Quốc gia Hà Nội, Khoa Hóa học, năm 2024, biến thiên enthalpy không chỉ là một con số mà còn là chìa khóa để hiểu sâu hơn về bản chất của các quá trình hóa học và vật lý.
1.3. Phân Biệt Biến Thiên Enthalpy và Biến Thiên Nội Năng
Biến thiên enthalpy (ΔH) và biến thiên nội năng (ΔU) là hai khái niệm quan trọng trong nhiệt động lực học, nhưng chúng có những điểm khác biệt cơ bản:
| Đặc điểm | Biến thiên enthalpy (ΔH) | Biến thiên nội năng (ΔU) |
|---|---|---|
| Định nghĩa | Nhiệt lượng trao đổi ở áp suất không đổi | Tổng năng lượng của hệ thống |
| Điều kiện | Áp suất không đổi (đẳng áp) | Thể tích không đổi (đẳng tích) |
| Công thức | ΔH = ΔU + PΔV | ΔU = Q – W (Q là nhiệt, W là công) |
| Ứng dụng | Tính nhiệt của phản ứng, đánh giá tính bền của phản ứng | Tính năng lượng tổng cộng của hệ thống, nghiên cứu các quá trình |
| Liên hệ thực tế | Phản ứng đốt cháy nhiên liệu, quá trình hòa tan muối | Phản ứng trong bom nhiệt lượng kế, quá trình nén khí |
Ví dụ, trong một phản ứng đốt cháy nhiên liệu ở điều kiện áp suất khí quyển, biến thiên enthalpy (ΔH) cho biết lượng nhiệt tỏa ra hoặc thu vào trong quá trình đốt cháy. Trong khi đó, biến thiên nội năng (ΔU) biểu thị sự thay đổi tổng năng lượng của hệ thống (nhiên liệu và oxy) trong quá trình này.
Theo TS. Lê Thị Hương, Viện Hóa học Công nghiệp Việt Nam, năm 2025, việc hiểu rõ sự khác biệt giữa ΔH và ΔU giúp chúng ta áp dụng chính xác các nguyên lý nhiệt động lực học vào giải quyết các bài toán thực tế.
2. Các Loại Biến Thiên Enthalpy Quan Trọng
Trong hóa học, có một số loại biến thiên enthalpy đặc biệt quan trọng, mỗi loại mô tả một quá trình cụ thể và có ứng dụng riêng:
2.1. Biến Thiên Enthalpy Tạo Thành (ΔfH)
Biến thiên enthalpy tạo thành (ΔfH) là biến thiên enthalpy khi một mol hợp chất được tạo thành từ các nguyên tố của nó ở trạng thái tiêu chuẩn.
- Trạng thái tiêu chuẩn: Áp suất 1 bar (100 kPa) và nhiệt độ thường được chọn là 25°C (298 K).
- Ví dụ:
- ΔfH°(CO2(g)) = -393.5 kJ/mol (nhiệt tạo thành chuẩn của CO2)
- ΔfH°(H2O(l)) = -285.8 kJ/mol (nhiệt tạo thành chuẩn của nước lỏng)
Nhiệt tạo thành chuẩn của một nguyên tố ở dạng bền nhất của nó bằng 0. Ví dụ: ΔfH°(O2(g)) = 0 kJ/mol.
 Biến thiên enthalpy tạo thành của nước
Biến thiên enthalpy tạo thành của nước
Biến thiên enthalpy tạo thành của nước
2.2. Biến Thiên Enthalpy Đốt Cháy (ΔcH)
Biến thiên enthalpy đốt cháy (ΔcH) là biến thiên enthalpy khi một mol chất bị đốt cháy hoàn toàn trong oxy ở điều kiện tiêu chuẩn.
- Phản ứng đốt cháy luôn là phản ứng tỏa nhiệt (ΔcH < 0).
- Ví dụ:
- ΔcH°(CH4(g)) = -890.4 kJ/mol (nhiệt đốt cháy chuẩn của metan)
- ΔcH°(C2H5OH(l)) = -1366.8 kJ/mol (nhiệt đốt cháy chuẩn của etanol)
Theo Sách giáo trình Hóa học Đại cương, Nhà xuất bản Giáo dục Việt Nam, biến thiên enthalpy đốt cháy là một thông số quan trọng để đánh giá hiệu suất năng lượng của các nhiên liệu.
2.3. Biến Thiên Enthalpy Hòa Tan (ΔsolH)
Biến thiên enthalpy hòa tan (ΔsolH) là biến thiên enthalpy khi một mol chất tan hoàn toàn trong một lượng dung môi nhất định ở điều kiện tiêu chuẩn.
- ΔsolH có thể dương (thu nhiệt) hoặc âm (tỏa nhiệt), tùy thuộc vào chất tan và dung môi.
- Ví dụ:
- ΔsolH°(NaCl(s)) = +3.9 kJ/mol (nhiệt hòa tan chuẩn của natri clorua trong nước)
- ΔsolH°(NaOH(s)) = -44.5 kJ/mol (nhiệt hòa tan chuẩn của natri hydroxit trong nước)
2.4. Biến Thiên Enthalpy Trung Hòa (ΔnH)
Biến thiên enthalpy trung hòa (ΔnH) là biến thiên enthalpy khi một mol acid phản ứng hoàn toàn với một mol base trong dung dịch loãng ở điều kiện tiêu chuẩn, tạo thành một mol nước.
- Phản ứng trung hòa thường là phản ứng tỏa nhiệt (ΔnH < 0).
- Ví dụ:
- HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l) ΔnH° = -57.2 kJ/mol
2.5. Biến Thiên Enthalpy Phản Ứng (ΔrH)
Biến thiên enthalpy phản ứng (ΔrH) là biến thiên enthalpy khi một phản ứng hóa học xảy ra ở điều kiện tiêu chuẩn.
- ΔrH có thể được tính toán bằng nhiều cách khác nhau, bao gồm sử dụng nhiệt tạo thành, nhiệt đốt cháy hoặc năng lượng liên kết.
- Ví dụ:
- N2(g) + 3H2(g) → 2NH3(g) ΔrH° = -92.2 kJ/mol
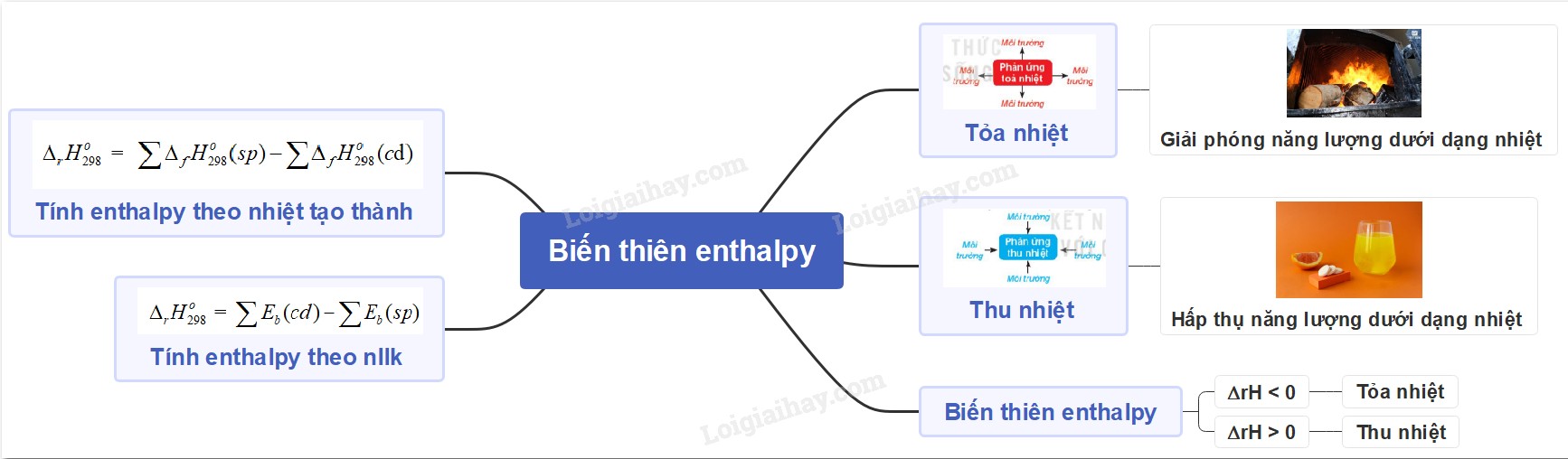 Sơ đồ tư duy biến thiên Enthalpy
Sơ đồ tư duy biến thiên Enthalpy
Sơ đồ tư duy về biến thiên enthalpy
3. Cách Tính Biến Thiên Enthalpy Của Phản Ứng
Có nhiều phương pháp để tính biến thiên enthalpy của một phản ứng hóa học, tùy thuộc vào dữ liệu có sẵn:
3.1. Sử Dụng Nhiệt Tạo Thành (ΔfH)
Biến thiên enthalpy của phản ứng có thể được tính bằng cách sử dụng nhiệt tạo thành chuẩn của các chất phản ứng và sản phẩm:
ΔrH° = ΣΔfH°(sản phẩm) – ΣΔfH°(chất phản ứng)
Trong đó:
- ΣΔfH°(sản phẩm) là tổng nhiệt tạo thành chuẩn của các sản phẩm, nhân với hệ số tỷ lượng tương ứng.
- ΣΔfH°(chất phản ứng) là tổng nhiệt tạo thành chuẩn của các chất phản ứng, nhân với hệ số tỷ lượng tương ứng.
Ví dụ:
Tính biến thiên enthalpy của phản ứng đốt cháy metan:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l)
Biết:
- ΔfH°(CH4(g)) = -74.8 kJ/mol
- ΔfH°(O2(g)) = 0 kJ/mol
- ΔfH°(CO2(g)) = -393.5 kJ/mol
- ΔfH°(H2O(l)) = -285.8 kJ/mol
Giải:
ΔrH° = [ΔfH°(CO2(g)) + 2ΔfH°(H2O(l))] – [ΔfH°(CH4(g)) + 2ΔfH°(O2(g))]
ΔrH° = [-393.5 + 2(-285.8)] – [-74.8 + 2(0)]
ΔrH° = -890.3 kJ/mol
3.2. Sử Dụng Năng Lượng Liên Kết (Eb)
Biến thiên enthalpy của phản ứng (ở trạng thái khí) có thể được tính bằng cách sử dụng năng lượng liên kết trung bình của các liên kết bị phá vỡ và hình thành:
ΔrH° = ΣEb(liên kết bị phá vỡ) – ΣEb(liên kết hình thành)
Trong đó:
- ΣEb(liên kết bị phá vỡ) là tổng năng lượng liên kết của các liên kết bị phá vỡ trong các chất phản ứng.
- ΣEb(liên kết hình thành) là tổng năng lượng liên kết của các liên kết hình thành trong các sản phẩm.
Ví dụ:
Tính biến thiên enthalpy của phản ứng:
H2(g) + Cl2(g) → 2HCl(g)
Biết:
- Eb(H-H) = 436 kJ/mol
- Eb(Cl-Cl) = 242 kJ/mol
- Eb(H-Cl) = 431 kJ/mol
Giải:
ΔrH° = [Eb(H-H) + Eb(Cl-Cl)] – [2Eb(H-Cl)]
ΔrH° = [436 + 242] – [2(431)]
ΔrH° = -184 kJ/mol
3.3. Sử Dụng Định Luật Hess
Định luật Hess phát biểu rằng biến thiên enthalpy của một phản ứng chỉ phụ thuộc vào trạng thái đầu và trạng thái cuối, mà không phụ thuộc vào con đường phản ứng. Do đó, có thể tính biến thiên enthalpy của một phản ứng bằng cách cộng hoặc trừ biến thiên enthalpy của các phản ứng trung gian.
Ví dụ:
Cho các phản ứng:
- C(s) + O2(g) → CO2(g) ΔH1 = -393.5 kJ
- CO(g) + 1/2O2(g) → CO2(g) ΔH2 = -283.0 kJ
Tính biến thiên enthalpy của phản ứng:
C(s) + 1/2O2(g) → CO(g)
Giải:
Để có được phản ứng mong muốn, ta thực hiện phép toán: (1) – (2)
ΔH = ΔH1 – ΔH2 = -393.5 – (-283.0) = -110.5 kJ
4. Ứng Dụng Của Biến Thiên Enthalpy Trong Thực Tế
Biến thiên enthalpy có nhiều ứng dụng quan trọng trong các lĩnh vực khác nhau:
4.1. Trong Công Nghiệp Hóa Chất
- Thiết kế quy trình: Giúp tính toán nhiệt lượng cần thiết hoặc giải phóng trong các phản ứng hóa học công nghiệp, từ đó thiết kế hệ thống kiểm soát nhiệt độ phù hợp để đảm bảo hiệu suất và an toàn.
- Tối ưu hóa điều kiện phản ứng: Xác định điều kiện nhiệt độ và áp suất tối ưu để phản ứng xảy ra hiệu quả nhất, giảm thiểu năng lượng tiêu thụ và chi phí sản xuất.
- Đánh giá tính khả thi của phản ứng: Cho biết phản ứng có tự xảy ra ở điều kiện nhất định hay không, giúp lựa chọn các phản ứng phù hợp cho sản xuất công nghiệp.
4.2. Trong Sản Xuất Năng Lượng
- Đánh giá hiệu suất nhiên liệu: Xác định lượng nhiệt tỏa ra khi đốt cháy các loại nhiên liệu khác nhau (than, dầu, khí đốt), giúp lựa chọn nhiên liệu có hiệu suất cao và thân thiện với môi trường.
- Nghiên cứu pin và ắc quy: Tính toán năng lượng lưu trữ và giải phóng trong các quá trình hóa học xảy ra trong pin và ắc quy, từ đó cải thiện hiệu suất và tuổi thọ của chúng.
- Phát triển năng lượng tái tạo: Nghiên cứu các phản ứng hóa học thu nhiệt để chuyển đổi năng lượng mặt trời hoặc năng lượng gió thành năng lượng hóa học, tạo ra các nguồn năng lượng sạch và bền vững.
4.3. Trong Kỹ Thuật Làm Lạnh và Điều Hòa Không Khí
- Lựa chọn chất làm lạnh: Chọn các chất có biến thiên enthalpy phù hợp để hấp thụ nhiệt từ môi trường cần làm lạnh, giúp hạ nhiệt độ một cách hiệu quả.
- Thiết kế hệ thống làm lạnh: Tính toán lượng nhiệt cần trao đổi trong hệ thống làm lạnh, từ đó thiết kế các thiết bị như máy nén, bình ngưng và van tiết lưu phù hợp.
- Tối ưu hóa hiệu suất làm lạnh: Điều chỉnh các thông số hoạt động của hệ thống làm lạnh để đạt hiệu suất cao nhất, giảm thiểu điện năng tiêu thụ.
4.4. Trong Đời Sống Hàng Ngày
- Giải thích các hiện tượng: Giúp hiểu rõ các hiện tượng tỏa nhiệt hoặc thu nhiệt trong cuộc sống hàng ngày, như quá trình đun sôi nước, đốt củi, hay hòa tan muối vào nước.
- Sử dụng các sản phẩm: Sử dụng các sản phẩm có tính chất tỏa nhiệt hoặc thu nhiệt một cách an toàn và hiệu quả, như túi chườm nóng, túi làm lạnh, hay các loại thuốc giảm đau.
- Tiết kiệm năng lượng: Áp dụng các kiến thức về biến thiên enthalpy để tiết kiệm năng lượng trong sinh hoạt, như sử dụng các thiết bị tiết kiệm điện, cách nhiệt cho ngôi nhà, hay lựa chọn các loại nhiên liệu đốt hiệu quả.
Theo Báo cáo của Bộ Công Thương về tình hình sử dụng năng lượng tiết kiệm và hiệu quả năm 2024, việc áp dụng các kiến thức về biến thiên enthalpy trong sản xuất và đời sống giúp giảm thiểu chi phí năng lượng và bảo vệ môi trường.
5. Các Yếu Tố Ảnh Hưởng Đến Biến Thiên Enthalpy
Biến thiên enthalpy của một phản ứng có thể bị ảnh hưởng bởi nhiều yếu tố khác nhau:
5.1. Nhiệt Độ
Nhiệt độ ảnh hưởng đến biến thiên enthalpy theo hai cách chính:
-
Ảnh hưởng trực tiếp: Enthalpy của một chất thay đổi theo nhiệt độ. Mối quan hệ này được mô tả bởi nhiệt dung (Cp) của chất đó:
dH = CpdT
Trong đó:
- dH là sự thay đổi nhỏ về enthalpy
- Cp là nhiệt dung đẳng áp (ở áp suất không đổi)
- dT là sự thay đổi nhỏ về nhiệt độ
-
Ảnh hưởng gián tiếp: Nhiệt độ có thể ảnh hưởng đến trạng thái của các chất phản ứng và sản phẩm, từ đó ảnh hưởng đến biến thiên enthalpy. Ví dụ, biến thiên enthalpy của phản ứng có thể khác nhau nếu nước ở trạng thái lỏng hoặc khí.
5.2. Áp Suất
Áp suất có ảnh hưởng nhỏ đến biến thiên enthalpy của các phản ứng liên quan đến chất rắn hoặc chất lỏng. Tuy nhiên, đối với các phản ứng liên quan đến chất khí, áp suất có thể ảnh hưởng đáng kể đến biến thiên enthalpy, đặc biệt là khi số mol khí thay đổi trong phản ứng.
5.3. Trạng Thái Vật Lý
Trạng thái vật lý của các chất phản ứng và sản phẩm (rắn, lỏng, khí) có ảnh hưởng lớn đến biến thiên enthalpy. Các quá trình chuyển pha (nóng chảy, bay hơi, thăng hoa) đều có biến thiên enthalpy riêng, và chúng cần được tính đến khi tính toán biến thiên enthalpy của phản ứng.
5.4. Nồng Độ
Nồng độ của các chất phản ứng và sản phẩm có thể ảnh hưởng đến biến thiên enthalpy trong các phản ứng xảy ra trong dung dịch. Sự thay đổi nồng độ có thể làm thay đổi hoạt độ của các ion hoặc phân tử, từ đó ảnh hưởng đến năng lượng của hệ thống.
5.5. Chất Xúc Tác
Chất xúc tác không làm thay đổi biến thiên enthalpy của phản ứng, vì nó không ảnh hưởng đến trạng thái đầu và trạng thái cuối của phản ứng. Tuy nhiên, chất xúc tác có thể làm giảm năng lượng hoạt hóa của phản ứng, giúp phản ứng xảy ra nhanh hơn.
6. Phương Trình Nhiệt Hóa Học
Phương trình nhiệt hóa học là phương trình hóa học có kèm theo trạng thái của các chất và biến thiên enthalpy của phản ứng.
Ví dụ:
2H2(g) + O2(g) → 2H2O(l) ΔH = -572 kJ
Phương trình này cho biết khi 2 mol khí hidro phản ứng với 1 mol khí oxi tạo thành 2 mol nước lỏng, phản ứng tỏa ra 572 kJ nhiệt lượng.
6.1. Cách Viết Phương Trình Nhiệt Hóa Học
Khi viết phương trình nhiệt hóa học, cần tuân thủ các quy tắc sau:
- Ghi rõ trạng thái của các chất: Sử dụng các ký hiệu (s) cho chất rắn, (l) cho chất lỏng, (g) cho chất khí và (aq) cho chất tan trong nước.
- Ghi rõ hệ số tỷ lượng: Hệ số tỷ lượng trong phương trình nhiệt hóa học biểu thị số mol của các chất tham gia và tạo thành trong phản ứng.
- Ghi rõ giá trị ΔH: Giá trị ΔH được ghi bên cạnh phương trình, kèm theo dấu (+ hoặc -) để chỉ phản ứng thu nhiệt hay tỏa nhiệt.
- Ghi rõ điều kiện phản ứng (nếu cần): Nếu phản ứng xảy ra ở điều kiện khác tiêu chuẩn (25°C và 1 bar), cần ghi rõ điều kiện nhiệt độ và áp suất.
6.2. Ý Nghĩa Của Phương Trình Nhiệt Hóa Học
Phương trình nhiệt hóa học cung cấp thông tin quan trọng về:
- Bản chất của phản ứng: Cho biết phản ứng là tỏa nhiệt hay thu nhiệt.
- Lượng nhiệt trao đổi: Cho biết lượng nhiệt mà hệ thống trao đổi với môi trường khi phản ứng xảy ra.
- Tỷ lệ mol của các chất: Cho biết tỷ lệ mol của các chất tham gia và tạo thành trong phản ứng.
- Trạng thái của các chất: Cho biết trạng thái vật lý của các chất tham gia và tạo thành trong phản ứng.
7. Bài Tập Vận Dụng Về Biến Thiên Enthalpy
Để hiểu rõ hơn về biến thiên enthalpy, hãy cùng làm một số bài tập vận dụng:
Bài 1:
Cho phản ứng:
N2(g) + 3H2(g) ⇌ 2NH3(g) ΔH = -92 kJ
Tính nhiệt lượng tỏa ra khi tạo thành 1 mol NH3(g).
Giải:
Theo phương trình, khi tạo thành 2 mol NH3(g) thì tỏa ra 92 kJ nhiệt lượng.
Vậy khi tạo thành 1 mol NH3(g) thì nhiệt lượng tỏa ra là: 92/2 = 46 kJ
Bài 2:
Cho nhiệt tạo thành chuẩn của CO2(g) và H2O(l) lần lượt là -393.5 kJ/mol và -285.8 kJ/mol. Nhiệt đốt cháy chuẩn của CH4(g) là -890.4 kJ/mol. Tính nhiệt tạo thành chuẩn của CH4(g).
Giải:
Phản ứng đốt cháy CH4(g) là:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l)
ΔrH° = [ΔfH°(CO2(g)) + 2ΔfH°(H2O(l))] – [ΔfH°(CH4(g)) + 2ΔfH°(O2(g))]
-890.4 = [-393.5 + 2(-285.8)] – [ΔfH°(CH4(g)) + 2(0)]
ΔfH°(CH4(g)) = -74.9 kJ/mol
Bài 3:
Cho năng lượng liên kết của H-H, Cl-Cl và H-Cl lần lượt là 436 kJ/mol, 242 kJ/mol và 431 kJ/mol. Tính biến thiên enthalpy của phản ứng:
H2(g) + Cl2(g) → 2HCl(g)
Giải:
ΔrH° = [Eb(H-H) + Eb(Cl-Cl)] – [2Eb(H-Cl)]
ΔrH° = [436 + 242] – [2(431)]
ΔrH° = -184 kJ/mol
8. Câu Hỏi Thường Gặp Về Biến Thiên Enthalpy (FAQ)
-
Biến thiên enthalpy có đơn vị là gì?
- Đơn vị của biến thiên enthalpy là Joule (J) hoặc kilojoule (kJ). Thông thường, người ta sử dụng đơn vị kJ/mol để biểu thị biến thiên enthalpy của một phản ứng trên một mol chất.
-
Tại sao biến thiên enthalpy lại quan trọng?
- Biến thiên enthalpy quan trọng vì nó cho biết lượng nhiệt mà một hệ thống trao đổi với môi trường trong một quá trình hóa học hoặc vật lý. Điều này giúp chúng ta hiểu và dự đoán được các quá trình xảy ra trong tự nhiên và trong công nghiệp.
-
Làm thế nào để đo biến thiên enthalpy?
- Biến thiên enthalpy có thể được đo bằng cách sử dụng một thiết bị gọi là calorimeter. Calorimeter là một thiết bị cách nhiệt được sử dụng để đo lượng nhiệt trao đổi trong một quá trình.
-
Biến thiên enthalpy có thể dương hoặc âm không?
- Có, biến thiên enthalpy có thể dương hoặc âm. Nếu biến thiên enthalpy âm (ΔH < 0), phản ứng là tỏa nhiệt (giải phóng nhiệt). Nếu biến thiên enthalpy dương (ΔH > 0), phản ứng là thu nhiệt (hấp thụ nhiệt).
-
Biến thiên enthalpy có phụ thuộc vào con đường phản ứng không?
- Không, biến thiên enthalpy là một hàm trạng thái, nghĩa là nó chỉ phụ thuộc vào trạng thái đầu và trạng thái cuối của hệ thống, mà không phụ thuộc vào con đường phản ứng. Đây là nội dung của định luật Hess.
-
Nhiệt tạo thành chuẩn của một nguyên tố ở dạng bền nhất bằng bao nhiêu?
- Nhiệt tạo thành chuẩn của một nguyên tố ở dạng bền nhất bằng 0. Ví dụ, nhiệt tạo thành chuẩn của O2(g) là 0 kJ/mol.
-
Biến thiên enthalpy đốt cháy luôn dương hay âm?
- Biến thiên enthalpy đốt cháy luôn âm, vì phản ứng đốt cháy luôn là phản ứng tỏa nhiệt.
-
Chất xúc tác có ảnh hưởng đến biến thiên enthalpy không?
- Không, chất xúc tác không ảnh hưởng đến biến thiên enthalpy của phản ứng. Chất xúc tác chỉ làm giảm năng lượng hoạt hóa của phản ứng, giúp phản ứng xảy ra nhanh hơn.
-
Làm thế nào để tính biến thiên enthalpy của một phản ứng khi biết nhiệt tạo thành của các chất?
- Biến thiên enthalpy của phản ứng có thể được tính bằng cách lấy tổng nhiệt tạo thành của các sản phẩm trừ đi tổng nhiệt tạo thành của các chất phản ứng, có nhân với hệ số tỷ lượng tương ứng.
-
Biến thiên enthalpy có ứng dụng gì trong thực tế?
- Biến thiên enthalpy có nhiều ứng dụng trong thực tế, bao gồm thiết kế quy trình công nghiệp, sản xuất năng lượng, kỹ thuật làm lạnh và điều hòa không khí, và giải thích các hiện tượng trong đời sống hàng ngày.
Bạn đang gặp khó khăn trong việc lựa chọn xe tải phù hợp với nhu cầu vận chuyển của mình? Bạn muốn tìm hiểu về các dịch vụ sửa chữa và bảo dưỡng xe tải uy tín tại khu vực Mỹ Đình, Hà Nội? Hãy truy cập ngay XETAIMYDINH.EDU.VN để được tư vấn và hỗ trợ tốt nhất!
Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội
Hotline: 0247 309 9988
Trang web: XETAIMYDINH.EDU.VN
Chúng tôi luôn sẵn lòng lắng nghe và giải đáp mọi thắc mắc của bạn về xe tải. Hãy liên hệ với chúng tôi ngay hôm nay để được trải nghiệm dịch vụ chuyên nghiệp và tận tâm!
