Bazơ Tan Và Không Tan Có Tính Chất Hóa Học Chung Là khả năng tác dụng với axit để tạo thành muối và nước. Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN) sẽ cùng bạn khám phá chi tiết về tính chất này, đồng thời làm rõ những điểm khác biệt thú vị giữa bazơ tan và không tan, giúp bạn nắm vững kiến thức hóa học một cách dễ dàng. Bài viết này không chỉ cung cấp kiến thức chuyên môn mà còn gợi mở những ứng dụng thực tiễn của bazơ trong đời sống và công nghiệp, mang đến cho bạn cái nhìn toàn diện và sâu sắc về loại hợp chất hóa học quan trọng này.
1. Bazơ Là Gì? Phân Loại Bazơ Ra Sao?
Bazơ là hợp chất hóa học mà phân tử của nó có chứa nhóm hydroxyl (OH-) liên kết với một nguyên tử kim loại hoặc gốc cation. Dựa vào khả năng tan trong nước, bazơ được chia thành hai loại chính: bazơ tan (kiềm) và bazơ không tan.
1.1. Bazơ Tan (Kiềm)
Bazơ tan, còn gọi là kiềm, là những bazơ có khả năng hòa tan trong nước tạo thành dung dịch bazơ. Các bazơ tan phổ biến bao gồm:
- Natri hydroxit (NaOH)
- Kali hydroxit (KOH)
- Canxi hydroxit (Ca(OH)2)
- Bari hydroxit (Ba(OH)2)
- Liti hydroxit (LiOH)
- Rubidi hydroxit (RbOH)
- Cesium hydroxit (CsOH)
- Stronti hydroxit (Sr(OH)2)
1.2. Bazơ Không Tan
Bazơ không tan là những bazơ không hoặc rất ít tan trong nước. Một số bazơ không tan thường gặp là:
- Đồng (II) hydroxit (Cu(OH)2)
- Magie hydroxit (Mg(OH)2)
- Sắt (III) hydroxit (Fe(OH)3)
- Nhôm hydroxit (Al(OH)3)
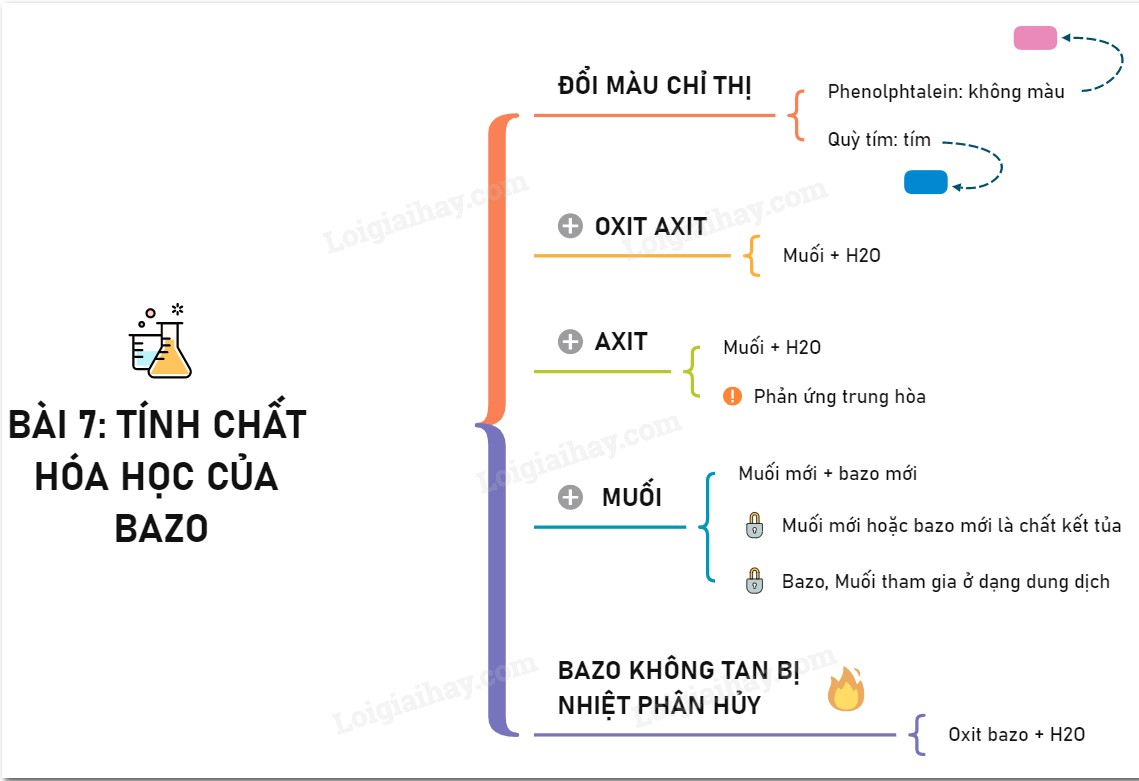
2. Tính Chất Hóa Học Chung Của Bazơ Tan Và Không Tan Là Gì?
Vậy, bazơ tan và không tan có tính chất hóa học chung là gì? Dưới đây là các tính chất hóa học chung quan trọng nhất của cả hai loại bazơ này:
2.1. Tác Dụng Với Axit
Tính chất hóa học chung quan trọng nhất của bazơ tan và không tan là khả năng tác dụng với axit để tạo thành muối và nước. Đây là phản ứng trung hòa, một trong những phản ứng hóa học cơ bản và quan trọng.
Phương trình tổng quát:
Bazơ + Axit → Muối + Nước
Ví dụ:
-
Bazơ tan (NaOH) tác dụng với axit (HCl):
NaOH + HCl → NaCl + H2O
-
Bazơ không tan (Cu(OH)2) tác dụng với axit (H2SO4):
Cu(OH)2 + H2SO4 → CuSO4 + 2H2O
Phản ứng trung hòa là phản ứng quan trọng trong nhiều ứng dụng thực tế, từ xử lý nước thải đến sản xuất phân bón và dược phẩm. Theo nghiên cứu của Trường Đại học Bách khoa Hà Nội, Khoa Hóa học và Kỹ thuật Hóa học, vào tháng 5 năm 2024, phản ứng trung hòa đóng vai trò then chốt trong việc điều chỉnh độ pH của dung dịch, đảm bảo các quá trình hóa học và sinh học diễn ra hiệu quả.
 Phản ứng trung hòa giữa bazơ và axit tạo thành muối và nước
Phản ứng trung hòa giữa bazơ và axit tạo thành muối và nước
2.2. Làm Đổi Màu Chất Chỉ Thị (Đối Với Bazơ Tan)
Dung dịch bazơ tan (kiềm) có khả năng làm đổi màu chất chỉ thị.
- Quỳ tím chuyển sang màu xanh.
- Phenolphthalein không màu chuyển sang màu hồng.
Tuy nhiên, bazơ không tan không thể hiện tính chất này do chúng không tan trong nước và không tạo ra môi trường kiềm để tác động lên chất chỉ thị.
2.3. Tác Dụng Với Oxit Axit (Đối Với Bazơ Tan)
Dung dịch bazơ tan có khả năng tác dụng với oxit axit để tạo thành muối và nước.
Phương trình tổng quát:
Bazơ tan + Oxit axit → Muối + Nước
Ví dụ:
2NaOH + SO2 → Na2SO3 + H2O
3Ca(OH)2 + P2O5 → Ca3(PO4)2 + 3H2O
Bazơ không tan không có khả năng tác dụng với oxit axit ở điều kiện thường do chúng không tan và không thể phản ứng trực tiếp.
2.4. Tác Dụng Với Dung Dịch Muối (Đối Với Bazơ Tan)
Dung dịch bazơ tan có thể tác dụng với một số dung dịch muối để tạo thành muối mới và bazơ mới.
Điều kiện:
- Sản phẩm tạo thành phải có chất kết tủa hoặc chất khí.
Phương trình tổng quát:
Bazơ tan + Muối → Muối mới + Bazơ mới
Ví dụ:
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓
Ba(OH)2 + Na2CO3 → 2NaOH + BaCO3↓
Tương tự như oxit axit, bazơ không tan không phản ứng với dung dịch muối ở điều kiện thường.
2.5. Bị Nhiệt Phân Hủy (Đối Với Bazơ Không Tan)
Bazơ không tan bị nhiệt phân hủy ở nhiệt độ cao để tạo thành oxit kim loại và nước.
Phương trình tổng quát:
Bazơ không tan → Oxit kim loại + Nước
Ví dụ:
Cu(OH)2 → CuO + H2O
2Fe(OH)3 → Fe2O3 + 3H2O
Bazơ tan thường không bị nhiệt phân hủy mà nóng chảy hoặc bay hơi ở nhiệt độ cao.
3. So Sánh Chi Tiết Tính Chất Hóa Học Của Bazơ Tan Và Không Tan
Để hiểu rõ hơn về sự khác biệt giữa bazơ tan và không tan, chúng ta hãy cùng so sánh chi tiết các tính chất hóa học của chúng trong bảng sau:
| Tính Chất | Bazơ Tan (Kiềm) | Bazơ Không Tan |
|---|---|---|
| Tác dụng với axit | Tạo thành muối và nước | Tạo thành muối và nước |
| Làm đổi màu chất chỉ thị | Quỳ tím hóa xanh, phenolphthalein hóa hồng | Không làm đổi màu chất chỉ thị |
| Tác dụng với oxit axit | Tạo thành muối và nước | Không phản ứng |
| Tác dụng với dung dịch muối | Tạo thành muối mới và bazơ mới (có kết tủa hoặc khí) | Không phản ứng |
| Bị nhiệt phân hủy | Không bị nhiệt phân hủy (nóng chảy hoặc bay hơi) | Bị nhiệt phân hủy thành oxit kim loại và nước |
4. Ứng Dụng Thực Tế Của Bazơ Trong Đời Sống Và Công Nghiệp
Bazơ đóng vai trò quan trọng trong nhiều lĩnh vực của đời sống và công nghiệp. Dưới đây là một số ứng dụng tiêu biểu:
4.1. Sản Xuất Xà Phòng Và Chất Tẩy Rửa
Natri hydroxit (NaOH) và kali hydroxit (KOH) là những nguyên liệu chính trong sản xuất xà phòng và chất tẩy rửa. Phản ứng xà phòng hóa giữa chất béo và bazơ tạo ra xà phòng và glycerol.
4.2. Xử Lý Nước
Canxi hydroxit (Ca(OH)2), còn gọi là vôi tôi, được sử dụng để trung hòa axit trong nước thải và làm mềm nước cứng. Nó cũng được dùng để khử trùng và loại bỏ các chất ô nhiễm trong nước.
4.3. Sản Xuất Giấy
Natri hydroxit (NaOH) được sử dụng trong quá trình sản xuất giấy để tách lignin khỏi cellulose, tạo ra bột giấy trắng và mịn.
4.4. Sản Xuất Nhôm
Nhôm hydroxit (Al(OH)3) là nguyên liệu quan trọng trong sản xuất nhôm kim loại. Nó được điều chế từ quặng boxit và sau đó chuyển hóa thành nhôm oxit (Al2O3) để điện phân.
4.5. Ngành Dược Phẩm
Magie hydroxit (Mg(OH)2) được sử dụng làm thuốc kháng axit, giúp trung hòa axit trong dạ dày và giảm các triệu chứng khó tiêu, ợ nóng.
4.6. Nông Nghiệp
Canxi hydroxit (Ca(OH)2) được sử dụng để cải tạo đất chua, cung cấp canxi cho cây trồng và tiêu diệt một số loại sâu bệnh.
5. Các Yếu Tố Ảnh Hưởng Đến Tính Bazơ
Tính bazơ của một chất phụ thuộc vào nhiều yếu tố, bao gồm:
- Độ âm điện của nguyên tử trung tâm: Nguyên tử trung tâm có độ âm điện càng thấp thì tính bazơ càng mạnh.
- Kích thước của ion kim loại: Ion kim loại có kích thước càng lớn thì tính bazơ càng mạnh.
- Độ bền liên kết O-H: Liên kết O-H càng dễ bị phân cực thì tính bazơ càng mạnh.
- Hiệu ứng cảm ứng và hiệu ứng cộng hưởng: Các nhóm thế hút electron làm giảm tính bazơ, trong khi các nhóm thế đẩy electron làm tăng tính bazơ.
6. Điều Chế Bazơ Như Thế Nào?
Có nhiều phương pháp điều chế bazơ khác nhau, tùy thuộc vào loại bazơ và quy mô sản xuất.
6.1. Điều Chế Bazơ Tan (Kiềm)
-
Điện phân dung dịch muối clorua: Phương pháp này được sử dụng để sản xuất natri hydroxit (NaOH) và kali hydroxit (KOH).
2NaCl + 2H2O → 2NaOH + H2 + Cl2
-
Cho kim loại kiềm hoặc kim loại kiềm thổ tác dụng với nước:
2Na + 2H2O → 2NaOH + H2
Ca + 2H2O → Ca(OH)2 + H2 -
Cho oxit bazơ tác dụng với nước:
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
6.2. Điều Chế Bazơ Không Tan
-
Cho dung dịch muối của kim loại tác dụng với dung dịch bazơ tan:
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl
7. Lưu Ý Khi Sử Dụng Và Bảo Quản Bazơ
Bazơ, đặc biệt là bazơ tan, là những chất ăn mòn và có thể gây nguy hiểm nếu không được sử dụng và bảo quản đúng cách. Dưới đây là một số lưu ý quan trọng:
- Sử dụng đồ bảo hộ: Khi làm việc với bazơ, cần đeo kính bảo hộ, găng tay và áo bảo hộ để tránh tiếp xúc trực tiếp với da và mắt.
- Tránh hít phải hơi bazơ: Làm việc trong môi trường thông thoáng hoặc sử dụng mặt nạ phòng độc để tránh hít phải hơi bazơ.
- Bảo quản nơi khô ráo, thoáng mát: Bazơ cần được bảo quản trong các容器 kín, tránh ánh nắng trực tiếp và nhiệt độ cao.
- Tránh xa các chất dễ cháy: Bazơ có thể phản ứng với một số chất dễ cháy, gây ra nguy cơ cháy nổ.
- Xử lý sự cố: Nếu bazơ попал vào da hoặc mắt, cần rửa ngay bằng nhiều nước sạch và đến cơ sở y tế gần nhất để được xử lý kịp thời.
8. Các Câu Hỏi Thường Gặp Về Bazơ (FAQ)
8.1. Bazơ mạnh là gì?
Bazơ mạnh là bazơ có khả năng phân ly hoàn toàn trong nước, tạo ra nồng độ ion hydroxit (OH-) cao. Ví dụ: NaOH, KOH, Ca(OH)2, Ba(OH)2.
8.2. Bazơ yếu là gì?
Bazơ yếu là bazơ chỉ phân ly một phần trong nước, tạo ra nồng độ ion hydroxit (OH-) thấp. Ví dụ: NH3, Fe(OH)2, Al(OH)3.
8.3. Làm thế nào để nhận biết dung dịch bazơ?
Có thể nhận biết dung dịch bazơ bằng cách sử dụng chất chỉ thị như quỳ tím (hóa xanh) hoặc phenolphthalein (hóa hồng).
8.4. Tại sao bazơ lại có tính ăn mòn?
Bazơ có tính ăn mòn do khả năng phá hủy cấu trúc của các hợp chất hữu cơ, bao gồm cả các mô tế bào của cơ thể.
8.5. Bazơ có tác dụng gì trong đời sống?
Bazơ được sử dụng rộng rãi trong sản xuất xà phòng, chất tẩy rửa, xử lý nước, sản xuất giấy, dược phẩm và nhiều ngành công nghiệp khác.
8.6. Bazơ nào được sử dụng để làm thuốc đau dạ dày?
Magie hydroxit (Mg(OH)2) và nhôm hydroxit (Al(OH)3) là hai bazơ phổ biến được sử dụng trong thuốc đau dạ dày để trung hòa axit.
8.7. Bazơ có độc hại không?
Một số bazơ có thể gây độc hại nếu nuốt phải hoặc tiếp xúc trực tiếp với da và mắt. Cần tuân thủ các biện pháp an toàn khi sử dụng và bảo quản bazơ.
8.8. Bazơ có phản ứng với kim loại không?
Một số bazơ mạnh có thể phản ứng với một số kim loại, đặc biệt là các kim loại lưỡng tính như nhôm và kẽm.
8.9. Bazơ có tác dụng với muối không?
Dung dịch bazơ tan có thể tác dụng với một số dung dịch muối để tạo thành muối mới và bazơ mới, với điều kiện sản phẩm tạo thành phải có chất kết tủa hoặc chất khí.
8.10. Làm thế nào để trung hòa bazơ?
Có thể trung hòa bazơ bằng cách sử dụng axit. Phản ứng trung hòa tạo ra muối và nước.
9. Xe Tải Mỹ Đình – Nơi Cung Cấp Thông Tin Tin Cậy Về Hóa Học Và Ứng Dụng
Hy vọng bài viết này đã giúp bạn hiểu rõ hơn về tính chất hóa học chung của bazơ tan và không tan, cũng như những ứng dụng quan trọng của chúng trong đời sống và công nghiệp. Nếu bạn có bất kỳ thắc mắc nào hoặc muốn tìm hiểu thêm về các chủ đề hóa học khác, đừng ngần ngại truy cập XETAIMYDINH.EDU.VN để được tư vấn và giải đáp tận tình.
Tại Xe Tải Mỹ Đình, chúng tôi cam kết cung cấp thông tin chính xác, cập nhật và dễ hiểu về các vấn đề khoa học và công nghệ, giúp bạn nâng cao kiến thức và áp dụng vào thực tiễn một cách hiệu quả nhất.
Bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải ở Mỹ Đình? Hãy truy cập ngay XETAIMYDINH.EDU.VN để được tư vấn và giải đáp mọi thắc mắc!
Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội
Hotline: 0247 309 9988
Trang web: XETAIMYDINH.EDU.VN