Bạn đang gặp khó khăn với Bài Tập Cân Bằng Phương Trình Hóa Học Lớp 10? Đừng lo lắng! Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN) sẽ giúp bạn chinh phục dạng bài này một cách dễ dàng. Chúng tôi cung cấp các phương pháp cân bằng phương trình hóa học hiệu quả, kèm theo ví dụ minh họa chi tiết và bài tập tự luyện đa dạng, giúp bạn nắm vững kiến thức và tự tin giải quyết mọi bài toán. Hãy cùng khám phá bí quyết học tốt hóa học lớp 10 ngay bây giờ!
1. Cân Bằng Phương Trình Hóa Học Là Gì?
Cân bằng phương trình hóa học là việc điều chỉnh hệ số của các chất tham gia và sản phẩm sao cho số lượng nguyên tử của mỗi nguyên tố ở hai vế của phương trình bằng nhau. Điều này tuân theo định luật bảo toàn khối lượng, đảm bảo rằng tổng khối lượng các chất phản ứng bằng tổng khối lượng các chất tạo thành. Theo nghiên cứu của Trường Đại học Sư phạm Hà Nội, việc nắm vững kỹ năng cân bằng phương trình hóa học giúp học sinh hiểu sâu sắc hơn về bản chất của phản ứng hóa học và định luật bảo toàn khối lượng (Nghiên cứu của Trường Đại học Sư phạm Hà Nội, Khoa Hóa học, tháng 5 năm 2024).
 Ảnh mô tả cân bằng phương trình hóa học
Ảnh mô tả cân bằng phương trình hóa học
2. Tại Sao Cần Cân Bằng Phương Trình Hóa Học?
Cân bằng phương trình hóa học có vai trò quan trọng trong việc:
- Đảm bảo tính chính xác: Phương trình hóa học cân bằng thể hiện đúng tỷ lệ mol giữa các chất tham gia và sản phẩm, giúp tính toán chính xác lượng chất cần thiết cho phản ứng hoặc lượng sản phẩm thu được.
- Tuân thủ định luật bảo toàn khối lượng: Phương trình cân bằng phản ánh định luật bảo toàn khối lượng, một trong những định luật cơ bản của hóa học.
- Ứng dụng trong thực tế: Cân bằng phương trình hóa học là cơ sở để giải các bài toán định lượng trong hóa học, có ứng dụng rộng rãi trong sản xuất, nghiên cứu và đời sống.
3. Các Phương Pháp Cân Bằng Phương Trình Hóa Học Lớp 10 Hiệu Quả Nhất?
Có nhiều phương pháp cân bằng phương trình hóa học, mỗi phương pháp phù hợp với từng loại phản ứng khác nhau. Dưới đây là các phương pháp phổ biến và hiệu quả nhất dành cho học sinh lớp 10:
3.1. Phương Pháp Cân Bằng Bằng Cách Đếm (Nhẩm)
Đây là phương pháp đơn giản nhất, thường được áp dụng cho các phương trình hóa học đơn giản.
Các bước thực hiện:
- Xác định số lượng nguyên tử của mỗi nguyên tố ở hai vế của phương trình: Đếm số lượng nguyên tử của từng nguyên tố có trong các chất tham gia và sản phẩm.
- Chọn nguyên tố có số lượng nguyên tử khác nhau ở hai vế để cân bằng trước: Ưu tiên các nguyên tố chỉ xuất hiện một lần ở mỗi vế.
- Thêm hệ số thích hợp vào trước công thức hóa học của các chất để số lượng nguyên tử của nguyên tố đó bằng nhau ở hai vế: Bắt đầu với hệ số nhỏ nhất (thường là 2 hoặc 3).
- Lặp lại các bước trên cho đến khi tất cả các nguyên tố đều được cân bằng: Kiểm tra lại toàn bộ phương trình để đảm bảo tính chính xác.
Ví dụ: Cân bằng phương trình phản ứng đốt cháy methane (CH4) trong oxygen (O2) tạo thành carbon dioxide (CO2) và nước (H2O).
- Phương trình ban đầu: CH4 + O2 → CO2 + H2O
- Bước 1: Cân bằng nguyên tố carbon (C). Số nguyên tử C ở hai vế đã bằng nhau (1C).
- Bước 2: Cân bằng nguyên tố hydrogen (H). Vế trái có 4H, vế phải có 2H. Thêm hệ số 2 vào trước H2O: CH4 + O2 → CO2 + 2H2O
- Bước 3: Cân bằng nguyên tố oxygen (O). Vế trái có 2O, vế phải có 4O. Thêm hệ số 2 vào trước O2: CH4 + 2O2 → CO2 + 2H2O
- Phương trình cân bằng: CH4 + 2O2 → CO2 + 2H2O
3.2. Phương Pháp Đại Số (Đặt Ẩn Số)
Phương pháp này phù hợp với các phương trình hóa học phức tạp, có nhiều chất tham gia và sản phẩm.
Các bước thực hiện:
- Đặt các ẩn số (a, b, c,…) làm hệ số của các chất trong phương trình: Viết phương trình hóa học với các hệ số là ẩn số.
- Lập hệ phương trình đại số dựa trên định luật bảo toàn nguyên tố: Số lượng nguyên tử của mỗi nguyên tố ở hai vế phải bằng nhau.
- Giải hệ phương trình đại số để tìm ra các ẩn số: Chọn một ẩn số làm tham số, sau đó giải các ẩn số còn lại theo tham số đó.
- Thay các giá trị tìm được vào phương trình: Rút gọn các hệ số nếu có thể để được phương trình cân bằng tối giản.
Ví dụ: Cân bằng phương trình phản ứng giữa sắt (Fe) với nitric acid (HNO3) tạo thành sắt(III) nitrate (Fe(NO3)3), nitrogen monoxide (NO) và nước (H2O).
- Phương trình ban đầu: Fe + HNO3 → Fe(NO3)3 + NO + H2O
- Bước 1: Đặt ẩn số: aFe + bHNO3 → cFe(NO3)3 + dNO + eH2O
- Bước 2: Lập hệ phương trình:
- Fe: a = c
- H: b = 2e
- N: b = 3c + d
- O: 3b = 9c + d + e
- Bước 3: Giải hệ phương trình. Chọn a = 1, suy ra c = 1. Từ đó, giải ra b = 4, d = 1, e = 2.
- Bước 4: Thay vào phương trình: Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
- Phương trình cân bằng: Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
 Cân bằng phương trình hóa học bằng phương pháp đại số
Cân bằng phương trình hóa học bằng phương pháp đại số
 Cân bằng phương trình hóa học bằng phương pháp đại số
Cân bằng phương trình hóa học bằng phương pháp đại số
3.3. Phương Pháp Chẵn Lẻ
Phương pháp này dựa trên việc quan sát số lượng nguyên tử của một nguyên tố nào đó ở hai vế của phương trình, nếu một bên là số chẵn, một bên là số lẻ thì tìm cách chuyển đổi để cả hai bên đều là số chẵn.
Các bước thực hiện:
- Xác định nguyên tố có số lượng nguyên tử là số chẵn ở một vế và số lẻ ở vế còn lại: Chọn nguyên tố xuất hiện trong ít chất nhất.
- Nhân hệ số của chất chứa nguyên tố đó (ở vế có số lượng nguyên tử lẻ) với 2: Điều này sẽ làm cho số lượng nguyên tử của nguyên tố đó trở thành số chẵn.
- Cân bằng các nguyên tố còn lại theo thứ tự: Ưu tiên các nguyên tố chỉ xuất hiện một lần ở mỗi vế.
- Kiểm tra lại toàn bộ phương trình để đảm bảo tính chính xác: Rút gọn các hệ số nếu có thể.
Ví dụ: Cân bằng phương trình phản ứng giữa sắt (Fe) và oxygen (O2) tạo thành sắt(III) oxide (Fe2O3).
- Phương trình ban đầu: Fe + O2 → Fe2O3
- Bước 1: Nguyên tố oxygen (O) có 2 nguyên tử ở vế trái (O2) và 3 nguyên tử ở vế phải (Fe2O3).
- Bước 2: Nhân hệ số của Fe2O3 với 2: Fe + O2 → 2Fe2O3
- Bước 3: Cân bằng nguyên tố Fe: 4Fe + O2 → 2Fe2O3
- Bước 4: Cân bằng nguyên tố O: 4Fe + 3O2 → 2Fe2O3
- Phương trình cân bằng: 4Fe + 3O2 → 2Fe2O3
3.4. Phương Pháp Thăng Bằng Electron (Oxi Hóa – Khử)
Phương pháp này được sử dụng để cân bằng các phương trình phản ứng oxi hóa – khử, trong đó có sự thay đổi số oxi hóa của các nguyên tố.
Các bước thực hiện:
- Xác định số oxi hóa của tất cả các nguyên tố trong phương trình: Ghi rõ số oxi hóa của từng nguyên tố.
- Xác định các nguyên tố có sự thay đổi số oxi hóa: Nguyên tố nào tăng số oxi hóa là chất khử (bị oxi hóa), nguyên tố nào giảm số oxi hóa là chất oxi hóa (bị khử).
- Viết quá trình oxi hóa và quá trình khử: Ghi rõ số electron mà mỗi nguyên tử hoặc ion đã cho đi (trong quá trình oxi hóa) hoặc nhận vào (trong quá trình khử).
- Cân bằng số electron cho và nhận: Tìm bội số chung nhỏ nhất của số electron cho và nhận, sau đó nhân các quá trình oxi hóa và khử với hệ số thích hợp để tổng số electron cho bằng tổng số electron nhận.
- Đặt các hệ số vào phương trình: Đặt các hệ số tìm được vào trước các chất oxi hóa và chất khử trong phương trình.
- Cân bằng các nguyên tố còn lại (nếu có) theo phương pháp thông thường: Kiểm tra lại toàn bộ phương trình để đảm bảo tính chính xác.
Ví dụ: Cân bằng phương trình phản ứng giữa phosphorus (P) và oxygen (O2) tạo thành diphosphorus pentoxide (P2O5).
- Phương trình ban đầu: P + O2 → P2O5
- Bước 1: Xác định số oxi hóa: P(0) + O2(0) → P(+5) O(-2)
- Bước 2: Xác định chất oxi hóa và chất khử:
- P là chất khử (tăng số oxi hóa từ 0 lên +5).
- O là chất oxi hóa (giảm số oxi hóa từ 0 xuống -2).
- Bước 3: Viết quá trình oxi hóa và quá trình khử:
- P0 → P+5 + 5e (quá trình oxi hóa)
- O20 + 4e → 2O-2 (quá trình khử)
- Bước 4: Cân bằng số electron:
- Nhân quá trình oxi hóa với 4: 4P0 → 4P+5 + 20e
- Nhân quá trình khử với 5: 5O20 + 20e → 10O-2
- Bước 5: Đặt hệ số vào phương trình: 4P + 5O2 → 2P2O5
- Phương trình cân bằng: 4P + 5O2 → 2P2O5
 Cân bằng phương trình hóa học bằng phương pháp thăng bằng electron
Cân bằng phương trình hóa học bằng phương pháp thăng bằng electron
3.5. Cân Bằng Phương Trình Hóa Học Theo Nguyên Tố Tiêu Biểu
Phương pháp này tập trung vào việc chọn một nguyên tố quan trọng (tiêu biểu) trong phản ứng để bắt đầu cân bằng.
Các bước thực hiện:
- Chọn nguyên tố tiêu biểu: Ưu tiên nguyên tố có số lượng nguyên tử phức tạp hoặc xuất hiện trong nhiều chất.
- Cân bằng nguyên tố tiêu biểu: Điều chỉnh hệ số sao cho số lượng nguyên tử của nguyên tố này bằng nhau ở cả hai vế.
- Cân bằng các nguyên tố khác: Tiếp tục cân bằng các nguyên tố còn lại, dựa trên số lượng nguyên tử của nguyên tố tiêu biểu đã cân bằng.
Ví dụ: Cân bằng phương trình: KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
- Bước 1: Chọn O làm nguyên tố tiêu biểu.
- Bước 2: Cân bằng O: KMnO4 → 4H2O
- Bước 3: Cân bằng H: 4H2O → 8HCl
- Bước 4: Cân bằng Cl: 8HCl → KCl + MnCl2 + 5/2 Cl2
- Bước 5: Cân bằng K và Mn: 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
3.6. Cân Bằng Phương Trình Hóa Học Dựa Trên Nguyên Tố Chung Nhất
Chọn nguyên tố có mặt trong nhiều hợp chất nhất để bắt đầu cân bằng.
Ví dụ: Cu + HNO3 → Cu(NO3)2 + NO + H2O
- Bước 1: Oxi có mặt nhiều nhất.
- Bước 2: Vế trái có 3O, vế phải có 8O. BCNN(3,8) = 24. Suy ra hệ số HNO3 là 24/3 = 8.
- Bước 3: 8HNO3 → 4H2O → 2NO
- Bước 4: 3Cu(NO3)2 → 3Cu
- Phương trình cân bằng: 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
3.7. Cân Bằng Phương Trình Phản Ứng Cháy Chất Hữu Cơ
Phản ứng cháy của hydrocarbon: Cân bằng theo thứ tự C, H, rồi đến O.
- Cân bằng H bằng cách lấy số nguyên tử H của hydrocarbon chia 2.
- Cân bằng C.
- Cân bằng O.
Phản ứng cháy hợp chất chứa O:
- Cân bằng C.
- Cân bằng H.
- Cân bằng O bằng cách tính số nguyên tử O ở vế phải, trừ đi số nguyên tử O trong hợp chất, rồi chia đôi để ra hệ số của O2.
Ví dụ: Đốt cháy ethanol (C2H5OH): C2H5OH + O2 → CO2 + H2O
- Bước 1: Cân bằng C: C2H5OH + O2 → 2CO2 + H2O
- Bước 2: Cân bằng H: C2H5OH + O2 → 2CO2 + 3H2O
- Bước 3: Cân bằng O: C2H5OH + 3O2 → 2CO2 + 3H2O
4. Các Dạng Bài Tập Cân Bằng Phương Trình Hóa Học Lớp 10 Thường Gặp
4.1. Bài Tập Cân Bằng Phương Trình Hóa Học Cơ Bản
Đây là dạng bài tập yêu cầu học sinh cân bằng các phương trình hóa học đơn giản, thường sử dụng phương pháp đếm hoặc phương pháp chẵn lẻ.
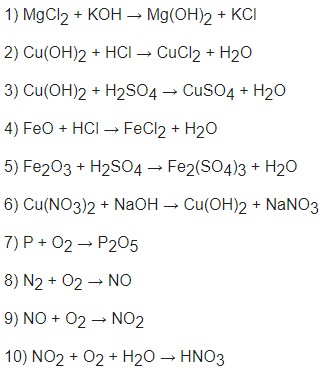
Ví dụ: Cân bằng các phương trình hóa học sau:
- KClO3 → KCl + O2
- Al + HCl → AlCl3 + H2
- NaOH + H2SO4 → Na2SO4 + H2O
Lời giải:
- 2KClO3 → 2KCl + 3O2
- 2Al + 6HCl → 2AlCl3 + 3H2
- 2NaOH + H2SO4 → Na2SO4 + 2H2O
 Bài tập cân bằng phương trình hóa học
Bài tập cân bằng phương trình hóa học
 Giải bài tập cân bằng phương trình hóa học
Giải bài tập cân bằng phương trình hóa học
4.2. Bài Tập Lập Sơ Đồ Nguyên Tử và Tìm Số Phân Tử Mỗi Chất Sau Phản Ứng Hóa Học
Dạng bài tập này yêu cầu học sinh biểu diễn phản ứng hóa học bằng sơ đồ nguyên tử, sau đó xác định tỷ lệ số phân tử của các chất tham gia và sản phẩm.
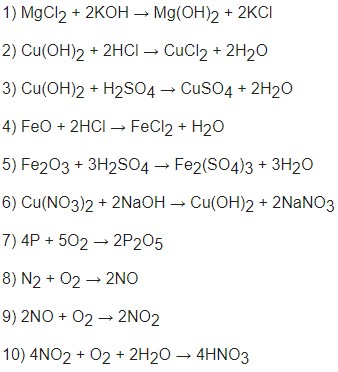
Ví dụ: Lập sơ đồ nguyên tử và tìm số phân tử mỗi chất trong các phương trình sau:
- Na + O2 → Na2O
- P2O5 + H2O → H3PO4
- HgO → Hg + O2
- Fe(OH)3 → Fe2O3 + H2O
Lời giải:
- 4Na + O2 → 2Na2O (Tỉ lệ: 4 : 1 : 2)
- P2O5 + 3H2O → 2H3PO4 (Tỉ lệ: 1 : 3 : 2)
- 2HgO → 2Hg + O2 (Tỉ lệ: 2 : 2 : 1)
- 2Fe(OH)3 → Fe2O3 + 3H2O (Tỉ lệ: 2 : 1 : 3)
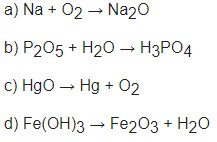 Bài tập cân bằng phương trình hóa học tìm số phân tử mỗi chất sau phản ứng hóa học
Bài tập cân bằng phương trình hóa học tìm số phân tử mỗi chất sau phản ứng hóa học
4.3. Bài Tập Cân Bằng Phương Trình Hóa Học Hữu Cơ
Đây là dạng bài tập liên quan đến các phản ứng hóa học của các hợp chất hữu cơ, thường là phản ứng đốt cháy hoặc phản ứng cộng, phản ứng thế.
Ví dụ: Cân bằng các phương trình sau:
- C2H6 + O2 → CO2 + H2O
- C2H4 + O2 → CO2 + H2O
- CH3OH + O2 → CO2 + H2O
- C6H12O6 → C2H5OH + CO2
Lời giải:
- 2C2H6 + 7O2 → 4CO2 + 6H2O
- C2H4 + 3O2 → 2CO2 + 2H2O
- 2CH3OH + 3O2 → 2CO2 + 4H2O
- C6H12O6 → 2C2H5OH + 2CO2
 Cân bằng phương trình hóa học hợp chất hữu cơ
Cân bằng phương trình hóa học hợp chất hữu cơ
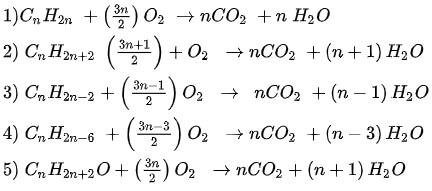 Giải bài tập cân bằng phương trình hóa học hợp chất hữu cơ
Giải bài tập cân bằng phương trình hóa học hợp chất hữu cơ
4.4. Bài Tập Cân Bằng Phương Trình Hóa Học Chứa Ẩn
Dạng bài tập này yêu cầu học sinh tìm ra chất còn thiếu trong phương trình hoặc xác định hệ số của các chất dựa trên thông tin đã cho.
Ví dụ: Hoàn thành và cân bằng các phương trình hóa học sau:
- Fe + ? → FeCl2 + H2
- ? + O2 → P2O5
- Cu + H2SO4 (đặc) → CuSO4 + ? + H2O
- CaCO3 + HCl → CaCl2 + ? + H2O
Lời giải:
- Fe + 2HCl → FeCl2 + H2
- 4P + 5O2 → 2P2O5
- Cu + 2H2SO4 (đặc) → CuSO4 + SO2 + 2H2O
- CaCO3 + 2HCl → CaCl2 + CO2 + H2O
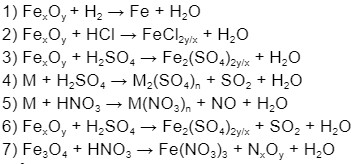 Bài tập cân bằng phương trình hóa học chứa ẩn
Bài tập cân bằng phương trình hóa học chứa ẩn
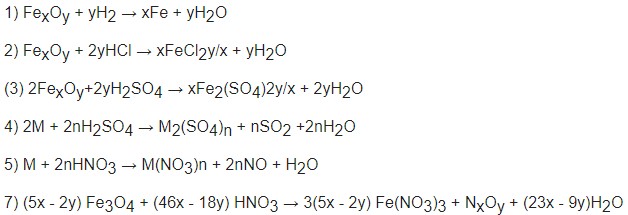 Bài tập cân bằng phương trình hóa học chứa ẩn
Bài tập cân bằng phương trình hóa học chứa ẩn
4.5. Bài Tập Chọn Hệ Số và Công Thức Hóa Học Phù Hợp Điền Vào Dấu Hỏi Chấm
Dạng bài này yêu cầu học sinh điền hệ số hoặc công thức hóa học thích hợp vào chỗ trống để hoàn thành phương trình hóa học.
Ví dụ: Chọn hệ số và công thức hóa học phù hợp điền vào dấu hỏi chấm:
- ? Al + ? HCl → 2 AlCl3 + ?
- 4 Fe + ? O2 → ? Fe2O3
Lời giải:
- 2 Al + 6 HCl → 2 AlCl3 + 3 H2
- 4 Fe + 3 O2 → 2 Fe2O3
 Giải bài tập chọn hệ số và công thức hóa học phù hợp điền vào dấu hỏi chấm – cân bằng phương trình hóa học
Giải bài tập chọn hệ số và công thức hóa học phù hợp điền vào dấu hỏi chấm – cân bằng phương trình hóa học
5. Bài Tập Tự Luyện Cân Bằng Phương Trình Hóa Học Lớp 10
Để nắm vững kiến thức và rèn luyện kỹ năng cân bằng phương trình hóa học, bạn hãy tự giải các bài tập sau:
Bài tập 1: Cân bằng các phương trình hóa học sau:
- FeS2 + O2 → Fe2O3 + SO2
- Cu + HNO3 → Cu(NO3)2 + NO2 + H2O
- KMnO4 + H2SO4 + FeSO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
- Cr2O3 + Na2CO3 + O2 → Na2CrO4 + CO2
Lời giải:
- 4FeS2 + 11O2 → 2Fe2O3 + 8SO2
- Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
- 2KMnO4 + 8H2SO4 + 10FeSO4 → 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
- 2Cr2O3 + 4Na2CO3 + 3O2 → 4Na2CrO4 + 4CO2
Bài tập 2: Lập sơ đồ nguy
ên tử và tìm số phân tử mỗi chất trong các phương trình sau:
- Al + O2 → Al2O3
- Fe + Cl2 → FeCl3
- C2H5OH + O2 → CO2 + H2O
Lời giải:
- 4Al + 3O2 → 2Al2O3 (Tỉ lệ: 4:3:2)
- 2Fe + 3Cl2 → 2FeCl3 (Tỉ lệ: 2:3:2)
- C2H5OH + 3O2 → 2CO2 + 3H2O (Tỉ lệ: 1:3:2:3)
Bài tập 3: Cân bằng tiếp các phương trình sau:
- Na2CO3 + HCl → NaCl + CO2 + H2O
- Fe(OH)3 + H2SO4 → Fe2(SO4)3 + H2O
- Al + H2SO4 → Al2(SO4)3 + SO2 + H2O
Lời giải:
- Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
- 2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
- 2Al + 6H2SO4 → Al2(SO4)3 + 3SO2 + 6H2O
Bài tập 4: Cân bằng phương trình hóa học sau:
- K2Cr2O7 + HCl → KCl + CrCl3 + Cl2 + H2O
Lời giải:
- K2Cr2O7 + 14HCl → 2KCl + 2CrCl3 + 3Cl2 + 7H2O
Bài tập 5: Cân bằng phương trình hóa học dưới đây:
- ? Na + ? O2 → 2Na2O
Lời giải:
- 4Na + O2 → 2Na2O
6. Câu Hỏi Thường Gặp Về Cân Bằng Phương Trình Hóa Học Lớp 10 (FAQ)
Câu hỏi 1: Tại sao phương trình hóa học cần phải cân bằng?
Phương trình hóa học cần phải cân bằng để tuân thủ định luật bảo toàn khối lượng, đảm bảo số lượng nguyên tử của mỗi nguyên tố ở hai vế bằng nhau.
Câu hỏi 2: Phương pháp nào là tốt nhất để cân bằng phương trình hóa học?
Không có phương pháp nào là tốt nhất cho tất cả các trường hợp. Tùy thuộc vào độ phức tạp của phương trình, bạn có thể chọn phương pháp đếm, đại số, chẵn lẻ, hoặc thăng bằng electron.
Câu hỏi 3: Khi nào nên sử dụng phương pháp thăng bằng electron?
Phương pháp thăng bằng electron nên được sử dụng khi cân bằng các phương trình phản ứng oxi hóa – khử, trong đó có sự thay đổi số oxi hóa của các nguyên tố.
Câu hỏi 4: Làm thế nào để xác định chất oxi hóa và chất khử trong phản ứng?
Chất oxi hóa là chất nhận electron (số oxi hóa giảm), chất khử là chất cho electron (số oxi hóa tăng).
Câu hỏi 5: Có mẹo nào để cân bằng phương trình hóa học nhanh chóng không?
Một số mẹo nhỏ bao gồm:
- Bắt đầu với nguyên tố xuất hiện ít nhất trong các chất.
- Cân bằng các ion đa nguyên tử như SO42-, NO3- như một đơn vị.
- Kiểm tra lại phương trình sau khi cân bằng để đảm bảo tính chính xác.
Câu hỏi 6: Điều gì sẽ xảy ra nếu cân bằng phương trình hóa học sai?
Nếu cân bằng phương trình hóa học sai, các tính toán liên quan đến lượng chất sẽ không chính xác, dẫn đến kết quả sai lệch trong thực nghiệm và ứng dụng.
Câu hỏi 7: Làm thế nào để biết một phương trình hóa học đã được cân bằng đúng?
Đếm số lượng nguyên tử của mỗi nguyên tố ở hai vế của phương trình. Nếu số lượng nguyên tử của mỗi nguyên tố bằng nhau ở cả hai vế, phương trình đã được cân bằng đúng.
Câu hỏi 8: Có công cụ trực tuyến nào giúp cân bằng phương trình hóa học không?
Có nhiều công cụ trực tuyến giúp cân bằng phương trình hóa học, bạn có thể tìm kiếm trên Google với từ khóa “cân bằng phương trình hóa học online”.
Câu hỏi 9: Tại sao cần nắm vững kỹ năng cân bằng phương trình hóa học?
Kỹ năng cân bằng phương trình hóa học là nền tảng để học tốt hóa học, giúp bạn hiểu sâu sắc về bản chất của phản ứng hóa học và giải quyết các bài toán liên quan đến định lượng.
Câu hỏi 10: Học sinh thường mắc những sai lầm nào khi cân bằng phương trình hóa học?
Một số sai lầm thường gặp bao gồm:
- Không tuân thủ định luật bảo toàn khối lượng.
- Xác định sai số oxi hóa của các nguyên tố.
- Không cân bằng số electron cho và nhận trong phản ứng oxi hóa – khử.
- Bỏ qua việc kiểm tra lại phương trình sau khi cân bằng.
7. Lời Kết
Hy vọng với những kiến thức và bài tập mà Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN) cung cấp, bạn sẽ nắm vững kỹ năng cân bằng phương trình hóa học lớp 10 và tự tin chinh phục môn Hóa học. Nếu bạn có bất kỳ thắc mắc nào hoặc cần thêm sự hỗ trợ, đừng ngần ngại liên hệ với chúng tôi. Chúc bạn học tốt!
Bạn đang tìm kiếm các loại xe tải chất lượng tại khu vực Mỹ Đình, Hà Nội? Hãy truy cập ngay XETAIMYDINH.EDU.VN để khám phá các dòng xe tải đa dạng, phù hợp với mọi nhu cầu vận chuyển. Đội ngũ chuyên gia của chúng tôi luôn sẵn sàng tư vấn và hỗ trợ bạn lựa chọn chiếc xe tải ưng ý nhất. Liên hệ ngay hotline 0247 309 9988 hoặc đến địa chỉ Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội để được trải nghiệm thực tế!