Amoniac (NH3) là một hợp chất vô cơ quan trọng, và việc nắm vững khả năng phản ứng của nó là vô cùng cần thiết. Vậy, Amoniac Phản ứng được Với Nhóm Chất Nào Sau đây? Câu trả lời là amoniac có thể phản ứng với axit, oxit kim loại, và một số muối kim loại. Để hiểu rõ hơn về các phản ứng này, cùng Xe Tải Mỹ Đình đi sâu vào chi tiết nhé!
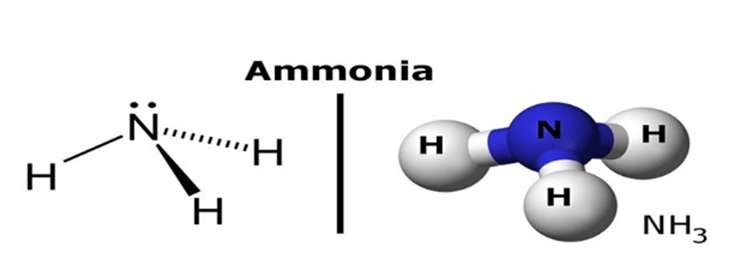 Công thức hóa học của Amoniac – tính chất hóa học của NH3
Công thức hóa học của Amoniac – tính chất hóa học của NH3
1. Amoniac (NH3) Là Gì?
Amoniac là một hợp chất hóa học vô cơ với công thức phân tử NH3. Đây là một khí không màu, có mùi khai đặc trưng và tan rất nhiều trong nước. Amoniac đóng vai trò quan trọng trong nhiều quá trình sinh học và công nghiệp.
1.1. Tính Chất Vật Lý Của Amoniac
- Trạng thái: Khí ở điều kiện thường.
- Màu sắc: Không màu.
- Mùi: Mùi khai đặc trưng, hắc.
- Độ tan: Tan rất tốt trong nước.
- Tỉ khối: Nhẹ hơn không khí.
- Hóa lỏng: Dễ hóa lỏng.
 Tính chất vật lý của Amoniac – tính chất hóa học của NH3
Tính chất vật lý của Amoniac – tính chất hóa học của NH3
1.2. Cấu Trúc Phân Tử Amoniac
Phân tử amoniac có cấu trúc hình chóp tam giác, với nguyên tử nitơ (N) ở đỉnh và ba nguyên tử hydro (H) ở đáy. Nguyên tử nitơ còn một cặp electron tự do, tạo nên tính bazơ của amoniac.
1.3. Tính Chất Hóa Học Đặc Trưng Của Amoniac
Amoniac thể hiện tính bazơ yếu và tính khử mạnh, tham gia vào nhiều phản ứng hóa học quan trọng. Dưới đây là các tính chất hóa học chi tiết của amoniac:
2. Amoniac Phản Ứng Với Nhóm Chất Nào?
2.1. Phản Ứng Với Axit
Amoniac là một bazơ yếu, do đó nó dễ dàng phản ứng với các axit để tạo thành muối amoni. Phản ứng này là một trong những tính chất quan trọng nhất của amoniac.
-
Ví dụ:
-
Với axit clohidric (HCl):
NH3 (k) + HCl (k) → NH4Cl (r)
-
Với axit sunfuric (H2SO4):
2NH3 + H2SO4 → (NH4)2SO4
-
Phản ứng này được ứng dụng rộng rãi trong sản xuất phân bón và các hợp chất amoni khác.
Bảng: Phản ứng của amoniac với một số axit thông dụng
| Axit | Phương trình phản ứng | Sản phẩm | Ứng dụng |
|---|---|---|---|
| Axit clohidric (HCl) | NH3 (k) + HCl (k) → NH4Cl (r) | Amoni clorua (NH4Cl) | Sản xuất pin, chất điện giải, phân bón |
| Axit sunfuric (H2SO4) | 2NH3 + H2SO4 → (NH4)2SO4 | Amoni sunfat ((NH4)2SO4) | Sản xuất phân bón, chất chống cháy |
| Axit nitric (HNO3) | NH3 + HNO3 → NH4NO3 | Amoni nitrat (NH4NO3) | Sản xuất phân bón, thuốc nổ |
| Axit photphoric (H3PO4) | NH3 + H3PO4 → (NH4)H2PO4 (Monoammonium phosphate) 2NH3 + H3PO4 → (NH4)2HPO4 (Diammonium phosphate) | Monoammonium phosphate (MAP), Diammonium phosphate (DAP) | Sản xuất phân bón, chất chống cháy, phụ gia thực phẩm (DAP) |
| Axit axetic (CH3COOH) | NH3 + CH3COOH → CH3COONH4 | Amoni axetat (CH3COONH4) | Chất đệm trong phòng thí nghiệm, công nghiệp dệt nhuộm |
| Axit cacbonic (H2CO3) | NH3 + H2CO3 → NH4HCO3 | Amoni bicacbonat (NH4HCO3) | Bột nở trong công nghiệp thực phẩm, sản xuất chất chữa cháy |
2.2. Phản Ứng Với Oxit Kim Loại
Amoniac có tính khử mạnh, đặc biệt khi ở nhiệt độ cao. Do đó, nó có thể khử một số oxit kim loại thành kim loại tự do.
-
Ví dụ:
-
Với đồng(II) oxit (CuO):
2NH3 (k) + 3CuO (r) → 3Cu (r) + N2 (k) + 3H2O (k)
-
Phản ứng này minh chứng cho khả năng khử của amoniac, biến oxit kim loại thành kim loại nguyên chất.
Bảng: Phản ứng của amoniac với một số oxit kim loại
| Oxit kim loại | Phương trình phản ứng | Sản phẩm | Điều kiện phản ứng | Ứng dụng |
|---|---|---|---|---|
| Đồng(II) oxit (CuO) | 2NH3 (k) + 3CuO (r) → 3Cu (r) + N2 (k) + 3H2O (k) | Đồng (Cu), nitơ (N2), nước (H2O) | Nhiệt độ cao | Sản xuất đồng kim loại, loại bỏ oxit kim loại trong các quá trình luyện kim |
| Sắt(III) oxit (Fe2O3) | 2NH3 (k) + Fe2O3 (r) → 2Fe (r) + N2 (k) + 3H2O (k) | Sắt (Fe), nitơ (N2), nước (H2O) | Nhiệt độ cao | Sản xuất sắt kim loại, loại bỏ oxit kim loại trong các quá trình luyện kim |
| Chì(II) oxit (PbO) | 2NH3 (k) + 3PbO (r) → 3Pb (r) + N2 (k) + 3H2O (k) | Chì (Pb), nitơ (N2), nước (H2O) | Nhiệt độ cao | Sản xuất chì kim loại, loại bỏ oxit kim loại trong các quá trình luyện kim |
| Kẽm oxit (ZnO) | 2NH3 (k) + 3ZnO (r) → 3Zn (r) + N2 (k) + 3H2O (k) | Kẽm (Zn), nitơ (N2), nước (H2O) | Nhiệt độ cao | Sản xuất kẽm kim loại, loại bỏ oxit kim loại trong các quá trình luyện kim |
| Niken(II) oxit (NiO) | 2NH3 (k) + 3NiO (r) → 3Ni (r) + N2 (k) + 3H2O (k) | Niken (Ni), nitơ (N2), nước (H2O) | Nhiệt độ cao | Sản xuất niken kim loại, loại bỏ oxit kim loại trong các quá trình luyện kim |
| Bạc oxit (Ag2O) | 2NH3 + 3Ag2O → 6Ag + N2 + 3H2O | Bạc (Ag), nitơ (N2), nước (H2O) | Nhiệt độ cao | Sản xuất bạc kim loại, loại bỏ oxit kim loại trong các quá trình luyện kim |
| Mangan oxit (MnO2) | 4NH3 (k) + 3MnO2 (r) → 3Mn (r) + 2N2 (k) + 6H2O (k) (Lưu ý: Phản ứng này có thể phức tạp hơn và tạo ra các sản phẩm trung gian tùy thuộc vào điều kiện) | Mangan (Mn), nitơ (N2), nước (H2O) (và có thể có các sản phẩm trung gian) | Nhiệt độ cao | Sản xuất mangan kim loại, loại bỏ oxit kim loại trong các quá trình luyện kim (phản ứng này ít phổ biến hơn so với các oxit kim loại khác) |
2.3. Phản Ứng Với Muối Kim Loại
Amoniac có thể phản ứng với dung dịch muối của một số kim loại để tạo thành hidroxit của kim loại đó, thường là kết tủa.
-
Ví dụ:
-
Với đồng(II) sunfat (CuSO4):
CuSO4 (dd) + 2NH3 (dd) + 2H2O (l) → Cu(OH)2 (r) + (NH4)2SO4 (dd)
-
Kết tủa đồng(II) hidroxit có màu xanh lam.
Bảng: Phản ứng của amoniac với một số muối kim loại
| Muối kim loại | Phương trình phản ứng | Sản phẩm | Màu sắc kết tủa |
|---|---|---|---|
| Đồng(II) sunfat (CuSO4) | CuSO4 (dd) + 2NH3 (dd) + 2H2O (l) → Cu(OH)2 (r) + (NH4)2SO4 (dd) | Đồng(II) hidroxit (Cu(OH)2), amoni sunfat ((NH4)2SO4) | Xanh lam |
| Sắt(II) clorua (FeCl2) | FeCl2 (dd) + 2NH3 (dd) + 2H2O (l) → Fe(OH)2 (r) + 2NH4Cl (dd) | Sắt(II) hidroxit (Fe(OH)2), amoni clorua (NH4Cl) | Trắng xanh |
| Sắt(III) clorua (FeCl3) | FeCl3 (dd) + 3NH3 (dd) + 3H2O (l) → Fe(OH)3 (r) + 3NH4Cl (dd) | Sắt(III) hidroxit (Fe(OH)3), amoni clorua (NH4Cl) | Nâu đỏ |
| Kẽm sunfat (ZnSO4) | ZnSO4 (dd) + 2NH3 (dd) + 2H2O (l) → Zn(OH)2 (r) + (NH4)2SO4 (dd) | Kẽm hidroxit (Zn(OH)2), amoni sunfat ((NH4)2SO4) | Trắng |
| Bạc nitrat (AgNO3) | Ag+(dd) + 2NH3(dd) → [Ag(NH3)2]+ (dd) | Phức bạc-amoni ([Ag(NH3)2]+ ) (phức tan, không tạo kết tủa trực tiếp) | Không màu |
| Mangan(II) clorua (MnCl2) | MnCl2 (dd) + 2NH3 (dd) + 2H2O (l) → Mn(OH)2 (r) + 2NH4Cl (dd) | Mangan(II) hidroxit (Mn(OH)2), amoni clorua (NH4Cl) | Hồng nhạt |
| Niken(II) clorua (NiCl2) | NiCl2 (dd) + 2NH3 (dd) + 2H2O (l) → Ni(OH)2 (r) + 2NH4Cl (dd) | Niken(II) hidroxit (Ni(OH)2), amoni clorua (NH4Cl) | Xanh lục nhạt |
2.4. Phản Ứng Tạo Phức Chất
Amoniac có khả năng tạo phức với nhiều ion kim loại, đặc biệt là các kim loại chuyển tiếp. Các phức chất này thường có màu sắc đặc trưng và được ứng dụng trong nhiều lĩnh vực.
-
Ví dụ:
-
Với ion đồng(II) (Cu2+):
Cu2+ (dd) + 4NH3 (dd) → [Cu(NH3)4]2+ (dd)
-
Phức chất [Cu(NH3)4]2+ có màu xanh đậm.
Bảng: Phản ứng tạo phức của amoniac với một số ion kim loại
| Ion kim loại | Phương trình phản ứng | Phức chất tạo thành | Màu sắc phức chất | Ứng dụng |
|---|---|---|---|---|
| Đồng(II) (Cu2+) | Cu2+ (dd) + 4NH3 (dd) → [Cu(NH3)4]2+ (dd) | Tetraamin đồng(II) ([Cu(NH3)4]2+) | Xanh đậm | Thuốc thử, chất xúc tác, mạ điện, phân tích hóa học |
| Bạc(I) (Ag+) | Ag+ (dd) + 2NH3 (dd) → [Ag(NH3)2]+ (dd) | Diamin bạc(I) ([Ag(NH3)2]+) | Không màu | Thuốc thử Tollens (nhận biết aldehyde), mạ bạc, phân tích hóa học |
| Kẽm(II) (Zn2+) | Zn2+ (dd) + 4NH3 (dd) → [Zn(NH3)4]2+ (dd) | Tetraamin kẽm(II) ([Zn(NH3)4]2+) | Không màu | Chất xúc tác, mạ kẽm, sản xuất rayon, phân tích hóa học |
| Niken(II) (Ni2+) | Ni2+ (dd) + 6NH3 (dd) → [Ni(NH3)6]2+ (dd) | Hexaamin niken(II) ([Ni(NH3)6]2+) | Xanh lam | Chất xúc tác, mạ niken, sản xuất chất màu, phân tích hóa học |
| Coban(II) (Co2+) | Co2+ (dd) + 6NH3 (dd) → [Co(NH3)6]2+ (dd) (Coban(II) dễ bị oxi hóa thành Coban(III) trong môi trường amoniac) | Hexaamin coban(II) ([Co(NH3)6]2+) (hoặc Coban(III)) | Hồng/Nâu | Chất xúc tác, sản xuất chất màu, phân tích hóa học, điều chế các phức chất coban khác (Lưu ý: Coban dễ bị oxi hóa trong môi trường NH3) |
3. Ứng Dụng Quan Trọng Của Amoniac Trong Đời Sống Và Sản Xuất
Amoniac có nhiều ứng dụng quan trọng trong các ngành công nghiệp và đời sống hàng ngày:
- Sản xuất phân bón: Amoniac là nguyên liệu chính để sản xuất các loại phân đạm như ure, amoni nitrat, và amoni sunfat.
- Sản xuất axit nitric: Amoniac được oxi hóa để tạo thành axit nitric, một hóa chất quan trọng trong sản xuất phân bón, thuốc nổ và nhiều hóa chất khác.
- Sản xuất hóa chất: Amoniac là nguyên liệu để sản xuất nhiều loại hóa chất khác nhau, bao gồm polyme, dược phẩm và chất tẩy rửa.
- Chất làm lạnh: Amoniac lỏng được sử dụng làm chất làm lạnh trong các hệ thống làm lạnh công nghiệp.
- Xử lý nước: Amoniac được sử dụng để khử trùng và điều chỉnh độ pH của nước.
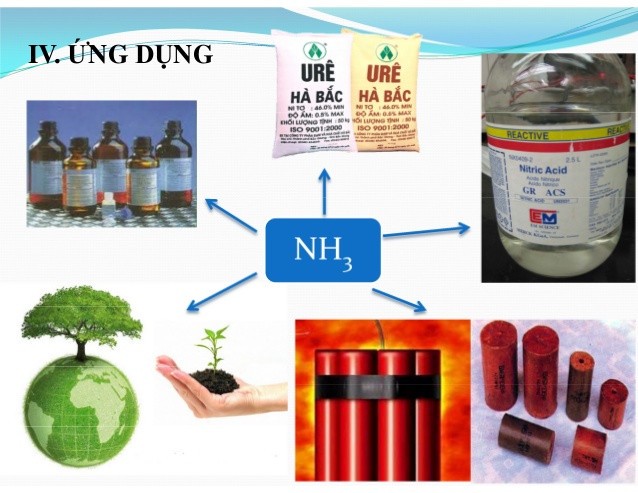 Ứng dụng của Amoniac- tính chất hóa học của NH3
Ứng dụng của Amoniac- tính chất hóa học của NH3
4. Điều Chế Amoniac Trong Phòng Thí Nghiệm Và Công Nghiệp
4.1. Điều Chế Trong Phòng Thí Nghiệm
Trong phòng thí nghiệm, amoniac có thể được điều chế bằng cách đun nóng hỗn hợp muối amoni và vôi tôi xút.
-
Phương trình phản ứng:
2NH4Cl (r) + Ca(OH)2 (r) → 2NH3 (k) + CaCl2 (r) + 2H2O (l)
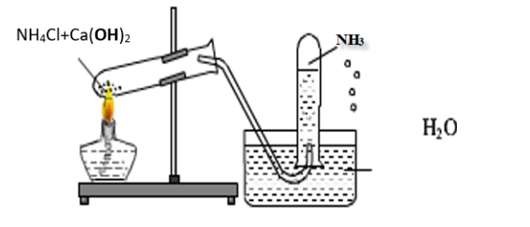 Điều chế Amoniac trong phòng thí nghiệm – tính chất hóa học của NH3
Điều chế Amoniac trong phòng thí nghiệm – tính chất hóa học của NH3
4.2. Điều Chế Trong Công Nghiệp
Trong công nghiệp, amoniac được sản xuất chủ yếu bằng phương pháp Haber-Bosch, trong đó nitơ và hydro phản ứng với nhau ở nhiệt độ và áp suất cao, có xúc tác là sắt.
-
Phương trình phản ứng:
N2 (k) + 3H2 (k) ⇌ 2NH3 (k)
Phản ứng này là thuận nghịch và tỏa nhiệt, do đó cần điều kiện nhiệt độ và áp suất thích hợp để đạt hiệu suất cao nhất.
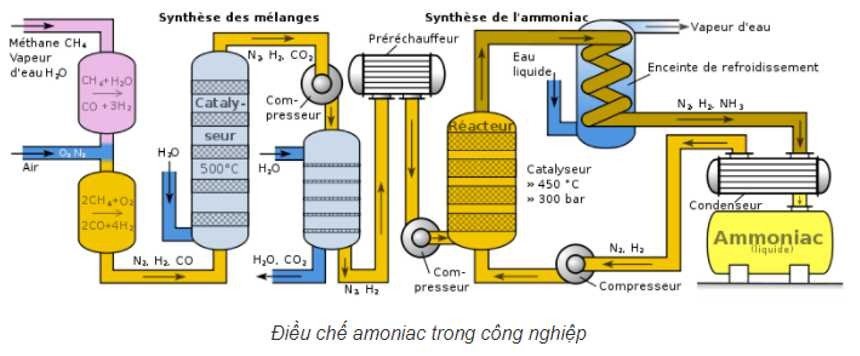 Điều chế Amoniac trong phòng công nghiệp – tính chất hóa học của NH3
Điều chế Amoniac trong phòng công nghiệp – tính chất hóa học của NH3
5. Nhận Biết Khí Amoniac
Để nhận biết khí amoniac, người ta thường dùng một trong hai cách sau:
-
Dùng giấy quỳ ẩm: Khí amoniac làm giấy quỳ ẩm chuyển sang màu xanh do tính bazơ của nó.
-
Cho khí amoniac tác dụng với axit clohidric đặc: Khí amoniac phản ứng với hơi axit clohidric tạo thành khói trắng amoni clorua.
NH3 (k) + HCl (k) → NH4Cl (r)
6. Các Câu Hỏi Thường Gặp Về Amoniac (FAQ)
1. Amoniac có độc không?
Có, amoniac là một chất độc. Hít phải amoniac với nồng độ cao có thể gây kích ứng đường hô hấp, ho, khó thở, và thậm chí gây tử vong.
2. Amoniac được sử dụng để làm gì trong nông nghiệp?
Amoniac được sử dụng để sản xuất phân đạm, cung cấp nitơ cho cây trồng, giúp cây phát triển xanh tốt.
3. Tại sao amoniac tan tốt trong nước?
Amoniac tan tốt trong nước do tạo liên kết hidro với các phân tử nước.
4. Làm thế nào để bảo quản amoniac an toàn?
Amoniac cần được bảo quản trong các bình chứa kín, đặt ở nơi thoáng mát, tránh xa nguồn nhiệt và các chất oxy hóa mạnh.
5. Phản ứng giữa amoniac và axit tạo ra chất gì?
Phản ứng giữa amoniac và axit tạo ra muối amoni. Ví dụ, amoniac phản ứng với axit clohidric tạo ra amoni clorua (NH4Cl).
6. Amoniac có tác dụng gì trong công nghiệp làm lạnh?
Amoniac lỏng có nhiệt bay hơi cao, do đó nó được sử dụng làm chất làm lạnh trong các hệ thống làm lạnh công nghiệp.
7. Amoniac có gây ô nhiễm môi trường không?
Có, amoniac có thể gây ô nhiễm môi trường nếu không được sử dụng và xử lý đúng cách. Nó có thể gây ô nhiễm nguồn nước và không khí, ảnh hưởng đến sức khỏe con người và động vật.
8. Làm thế nào để giảm thiểu ô nhiễm do amoniac gây ra?
Để giảm thiểu ô nhiễm do amoniac gây ra, cần sử dụng amoniac một cách hợp lý, tránh lãng phí, và có các biện pháp xử lý khí thải và nước thải chứa amoniac trước khi thải ra môi trường.
9. Amoniac có tính chất hóa học đặc trưng nào?
Amoniac có tính bazơ yếu và tính khử mạnh. Nó có khả năng phản ứng với axit, oxit kim loại, và tạo phức với các ion kim loại.
10. Vì sao amoniac có mùi khai đặc trưng?
Mùi khai đặc trưng của amoniac là do các phân tử NH3 dễ bay hơi và kích thích các thụ thể khứu giác trong mũi.
7. Tại Sao Nên Tìm Hiểu Về Xe Tải Tại XETAIMYDINH.EDU.VN?
Nếu bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải ở khu vực Mỹ Đình, Hà Nội, thì XETAIMYDINH.EDU.VN là địa chỉ không thể bỏ qua. Chúng tôi cung cấp:
- Thông tin chi tiết và cập nhật: Về các loại xe tải có sẵn, giá cả, thông số kỹ thuật, và các chương trình khuyến mãi hấp dẫn.
- So sánh các dòng xe: Giúp bạn dễ dàng lựa chọn loại xe phù hợp với nhu cầu và ngân sách của mình.
- Tư vấn chuyên nghiệp: Đội ngũ chuyên gia giàu kinh nghiệm sẵn sàng giải đáp mọi thắc mắc của bạn về thủ tục mua bán, đăng ký, và bảo dưỡng xe tải.
- Dịch vụ sửa chữa uy tín: Giới thiệu các địa chỉ sửa chữa xe tải uy tín trong khu vực Mỹ Đình, đảm bảo xe của bạn luôn hoạt động tốt nhất.
Đừng ngần ngại liên hệ với Xe Tải Mỹ Đình ngay hôm nay để được tư vấn và hỗ trợ tốt nhất!
Thông tin liên hệ:
- Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội
- Hotline: 0247 309 9988
- Trang web: XETAIMYDINH.EDU.VN
Lời kêu gọi hành động (CTA):
Truy cập XETAIMYDINH.EDU.VN ngay hôm nay để khám phá thế giới xe tải đa dạng và nhận được sự tư vấn tận tâm từ đội ngũ chuyên gia của chúng tôi. Hãy để Xe Tải Mỹ Đình đồng hành cùng bạn trên mọi nẻo đường!