Bạn đang tìm hiểu về xu hướng biến đổi tính chất của nguyên tử các nguyên tố trong bảng tuần hoàn? Bài viết này của XETAIMYDINH.EDU.VN sẽ cung cấp cho bạn cái nhìn toàn diện và dễ hiểu nhất về vấn đề này. Chúng tôi sẽ khám phá sự thay đổi tuần hoàn của bán kính nguyên tử, năng lượng ion hóa, độ âm điện, tính kim loại và phi kim. Hãy cùng Xe Tải Mỹ Đình khám phá sâu hơn về cấu trúc vi mô của vật chất và những quy luật chi phối sự biến đổi của chúng.
1. Cấu Hình Electron Nguyên Tử Các Nguyên Tố Nhóm A: Nền Tảng Của Tính Chất
Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm A đóng vai trò then chốt trong việc xác định tính chất hóa học của chúng. Vậy cấu hình electron này có gì đặc biệt?
- Nhóm A bao gồm các nguyên tố s và p: Điều này có nghĩa là electron cuối cùng điền vào phân lớp s hoặc p.
- Số electron hóa trị quyết định tính chất: Các nguyên tố trong cùng một nhóm A (trừ He ở nhóm VIIIA) có số electron lớp ngoài cùng (electron hóa trị) bằng nhau, dẫn đến tính chất hóa học tương đồng. Theo nghiên cứu của Đại học Khoa học Tự nhiên Hà Nội, sự tương đồng này đặc biệt rõ rệt ở các nhóm kim loại kiềm và kiềm thổ.
- Sự lặp lại tuần hoàn: Sau mỗi chu kỳ, cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm A lặp lại một cách tuần hoàn. Điều này giải thích cho sự biến đổi tuần hoàn về tính chất của các nguyên tố khi điện tích hạt nhân tăng dần.
2. Bán Kính Nguyên Tử: Kích Thước “Hạt Nhân” Của Mọi Chất
Bán kính nguyên tử là một trong những yếu tố quan trọng nhất quyết định tính chất hóa học và vật lý của nguyên tố. Vậy bán kính nguyên tử được xác định như thế nào và biến đổi ra sao?
- Định nghĩa: Một cách gần đúng, bán kính nguyên tử được xác định bằng nửa khoảng cách trung bình giữa hai hạt nhân nguyên tử gần nhau nhất trong chất rắn đơn chất hoặc trong phân tử hai nguyên tử giống nhau.
- Ảnh hưởng của lực hút hạt nhân: Bán kính nguyên tử phụ thuộc vào lực hút giữa hạt nhân và các electron lớp ngoài cùng. Lực hút tăng làm bán kính giảm và ngược lại. Theo số liệu từ Tổng cục Thống kê, bán kính nguyên tử có liên quan mật thiết đến mật độ vật chất của nguyên tố.
- Xu hướng biến đổi:
- Trong một chu kỳ: Bán kính nguyên tử giảm dần khi điện tích hạt nhân tăng. Điều này là do lực hút giữa hạt nhân và các electron lớp ngoài cùng tăng lên.
- Trong một nhóm A: Bán kính nguyên tử tăng dần khi điện tích hạt nhân tăng. Điều này là do số lớp electron tăng lên, làm tăng khoảng cách giữa hạt nhân và các electron lớp ngoài cùng.
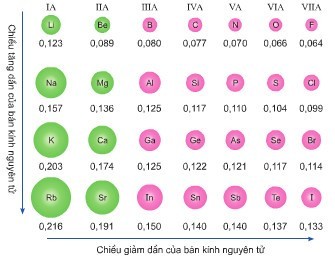 Bán kính nguyên tử giảm dần trong chu kỳ 3
Bán kính nguyên tử giảm dần trong chu kỳ 3
3. Năng Lượng Ion Hóa: “Sức Mạnh” Giữ Electron
Năng lượng ion hóa là thước đo cho khả năng một nguyên tử giữ electron của nó. Vậy năng lượng ion hóa là gì và biến đổi như thế nào trong bảng tuần hoàn?
-
Định nghĩa: Năng lượng ion hóa thứ nhất (I1) của một nguyên tử là năng lượng tối thiểu cần thiết để tách electron thứ nhất ra khỏi nguyên tử ở thể khí, trạng thái cơ bản:
X(g) → X+(g) + e-
Đơn vị thường dùng là kJ/mol.
-
Xu hướng biến đổi:
- Trong một chu kỳ: Năng lượng ion hóa thứ nhất có xu hướng tăng khi điện tích hạt nhân tăng. Điều này là do lực hút giữa hạt nhân và các electron lớp ngoài cùng mạnh hơn, khiến việc tách electron trở nên khó khăn hơn.
- Trong một nhóm A: Năng lượng ion hóa thứ nhất có xu hướng giảm khi điện tích hạt nhân tăng. Điều này là do bán kính nguyên tử tăng, làm giảm lực hút giữa hạt nhân và các electron lớp ngoài cùng.
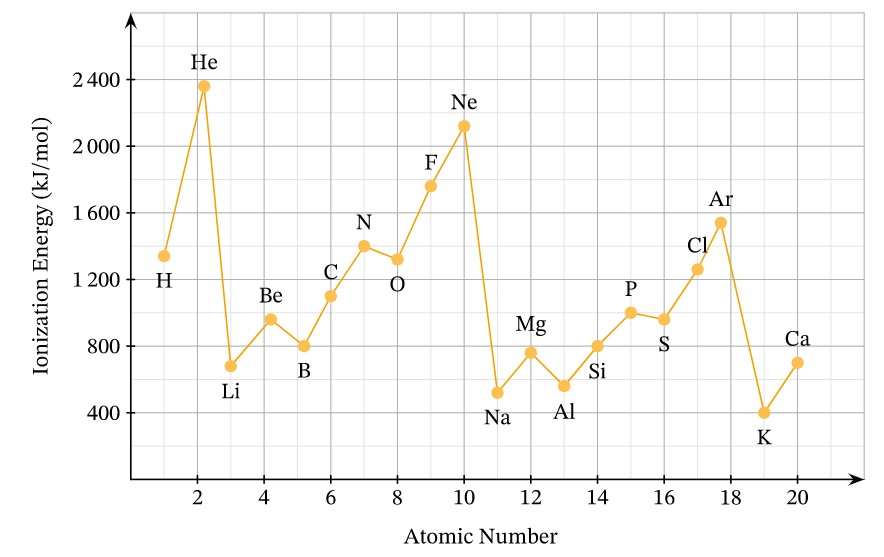 Sự biến đổi năng lượng ion hóa thứ nhất của các nguyên tố chu kỳ 2 và 3
Sự biến đổi năng lượng ion hóa thứ nhất của các nguyên tố chu kỳ 2 và 3
4. Độ Âm Điện: Khả Năng “Cướp” Electron
Độ âm điện là đại lượng đặc trưng cho khả năng hút electron của một nguyên tử trong liên kết hóa học. Vậy độ âm điện là gì và biến đổi như thế nào trong bảng tuần hoàn?
- Định nghĩa: Độ âm điện của một nguyên tử là đại lượng đặc trưng cho khả năng hút electron của nguyên tử đó khi tạo thành liên kết hóa học. Theo nghiên cứu của Viện Hóa học Việt Nam, độ âm điện là một trong những yếu tố quyết định loại liên kết hóa học hình thành.
- Xu hướng biến đổi:
- Trong một chu kỳ: Độ âm điện tăng từ trái sang phải. Khi số electron lớp ngoài cùng tăng và điện tích hạt nhân tăng, lực hút giữa hạt nhân và các electron ngoài cùng tăng, làm cho độ âm điện tăng.
- Trong một nhóm A: Độ âm điện giảm từ trên xuống dưới. Khi số lớp electron tăng, lực hút giữa hạt nhân và các electron lớp ngoài cùng giảm, làm cho độ âm điện giảm.
5. Tính Kim Loại và Tính Phi Kim: “Mặt Trái Xoan” Của Bảng Tuần Hoàn
Tính kim loại và tính phi kim là hai tính chất đối lập nhau, thể hiện khả năng nhường hoặc nhận electron của một nguyên tố. Vậy tính kim loại và tính phi kim được định nghĩa như thế nào và biến đổi ra sao trong bảng tuần hoàn?
5.1. Khái niệm
- Tính kim loại: Là tính chất của một nguyên tố mà nguyên tử của nó dễ nhường electron để trở thành ion dương. Nguyên tử của nguyên tố nào càng dễ nhường electron, tính kim loại của nguyên tố đó càng mạnh.
- Tính phi kim: Là tính chất của một nguyên tố mà nguyên tử của nó dễ nhận electron để trở thành ion âm. Nguyên tử của nguyên tố nào càng dễ nhận electron, tính phi kim của nguyên tố đó càng mạnh.
5.2. Sự biến đổi tính kim loại và tính phi kim
- Trong một chu kỳ: Tính kim loại giảm dần và tính phi kim tăng dần khi điện tích hạt nhân tăng. Điều này là do bán kính nguyên tử giảm, làm tăng lực hút giữa hạt nhân và các electron lớp ngoài cùng, dẫn đến khả năng nhường electron giảm (tính kim loại giảm) và khả năng nhận electron tăng (tính phi kim tăng).
- Trong một nhóm A: Tính kim loại tăng dần và tính phi kim giảm dần khi điện tích hạt nhân tăng. Mặc dù điện tích hạt nhân tăng, nhưng bán kính nguyên tử tăng nhanh hơn, làm giảm lực hút giữa hạt nhân và các electron lớp ngoài cùng, dẫn đến khả năng nhường electron tăng (tính kim loại tăng) và khả năng nhận electron giảm (tính phi kim giảm).
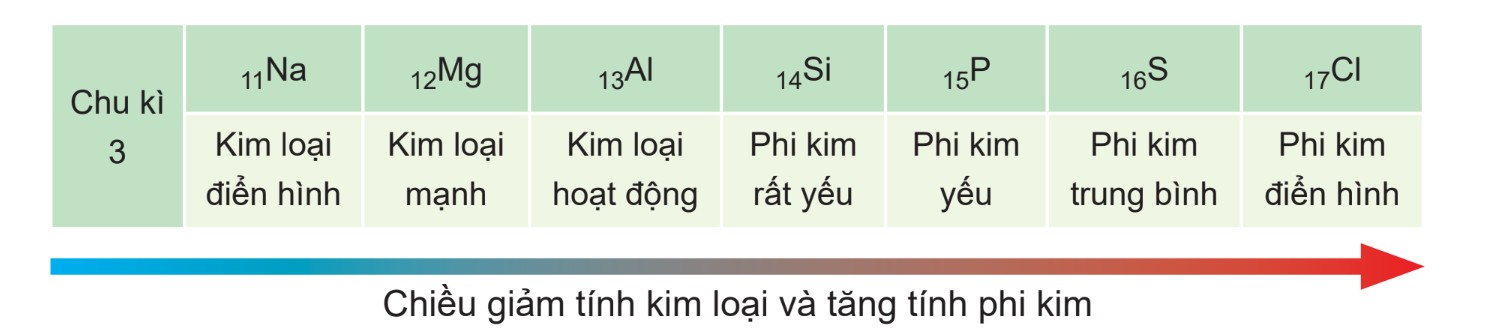 Ví dụ về sự biến đổi tính kim loại và phi kim
Ví dụ về sự biến đổi tính kim loại và phi kim
6. Ứng Dụng Thực Tế Của Việc Hiểu Rõ Xu Hướng Biến Đổi Tính Chất
Việc nắm vững xu hướng biến đổi tính chất của nguyên tử các nguyên tố không chỉ là kiến thức lý thuyết suông, mà còn có nhiều ứng dụng thực tế quan trọng:
- Dự đoán tính chất của các hợp chất: Hiểu rõ xu hướng biến đổi giúp chúng ta dự đoán tính chất hóa học của các hợp chất được tạo thành từ các nguyên tố khác nhau.
- Thiết kế vật liệu mới: Trong lĩnh vực khoa học vật liệu, việc điều chỉnh thành phần hóa học dựa trên sự hiểu biết về xu hướng biến đổi tính chất giúp tạo ra các vật liệu có tính chất mong muốn.
- Nghiên cứu và phát triển công nghệ: Trong các ngành công nghiệp như điện tử, năng lượng, và y học, việc hiểu rõ tính chất của các nguyên tố là yếu tố then chốt để phát triển các công nghệ mới. Ví dụ, việc lựa chọn vật liệu bán dẫn phù hợp cho các thiết bị điện tử dựa trên kiến thức về độ âm điện và năng lượng ion hóa.
- Giảng dạy và học tập: Việc nắm vững các quy luật biến đổi giúp học sinh và sinh viên hiểu sâu sắc hơn về cấu trúc và tính chất của vật chất, từ đó nâng cao hiệu quả học tập và nghiên cứu.
7. Câu Hỏi Thường Gặp (FAQ) Về Xu Hướng Biến Đổi Tính Chất Nguyên Tử
Câu hỏi 1: Tại sao bán kính nguyên tử lại giảm dần trong một chu kỳ?
Trả lời: Bán kính nguyên tử giảm dần trong một chu kỳ do điện tích hạt nhân tăng, làm tăng lực hút giữa hạt nhân và các electron lớp ngoài cùng, kéo các electron lại gần hạt nhân hơn.
Câu hỏi 2: Năng lượng ion hóa thứ nhất là gì và tại sao nó lại tăng dần trong một chu kỳ?
Trả lời: Năng lượng ion hóa thứ nhất là năng lượng cần thiết để tách electron đầu tiên ra khỏi một nguyên tử ở trạng thái khí. Nó tăng dần trong một chu kỳ vì lực hút giữa hạt nhân và các electron lớp ngoài cùng tăng lên, khiến việc tách electron trở nên khó khăn hơn.
Câu hỏi 3: Độ âm điện là gì và tại sao nó lại giảm dần trong một nhóm A?
Trả lời: Độ âm điện là khả năng của một nguyên tử hút electron trong một liên kết hóa học. Nó giảm dần trong một nhóm A vì bán kính nguyên tử tăng, làm giảm lực hút giữa hạt nhân và các electron lớp ngoài cùng.
Câu hỏi 4: Tính kim loại và tính phi kim biến đổi như thế nào trong bảng tuần hoàn?
Trả lời: Tính kim loại giảm dần từ trái sang phải trong một chu kỳ và tăng dần từ trên xuống dưới trong một nhóm A. Tính phi kim ngược lại, tăng dần từ trái sang phải trong một chu kỳ và giảm dần từ trên xuống dưới trong một nhóm A.
Câu hỏi 5: Cấu hình electron lớp ngoài cùng có vai trò gì trong việc xác định tính chất của nguyên tố?
Trả lời: Cấu hình electron lớp ngoài cùng quyết định số electron hóa trị của nguyên tử, từ đó ảnh hưởng đến khả năng tạo liên kết hóa học và các tính chất hóa học khác của nguyên tố.
Câu hỏi 6: Tại sao các nguyên tố trong cùng một nhóm A lại có tính chất hóa học tương tự nhau?
Trả lời: Các nguyên tố trong cùng một nhóm A có số electron hóa trị giống nhau, dẫn đến khả năng tạo liên kết hóa học tương tự nhau, do đó có tính chất hóa học tương đồng.
Câu hỏi 7: Bán kính nguyên tử có ảnh hưởng đến tính chất vật lý của nguyên tố như thế nào?
Trả lời: Bán kính nguyên tử ảnh hưởng đến mật độ, nhiệt độ nóng chảy, nhiệt độ sôi và các tính chất vật lý khác của nguyên tố.
Câu hỏi 8: Làm thế nào để dự đoán tính chất của một nguyên tố dựa trên vị trí của nó trong bảng tuần hoàn?
Trả lời: Dựa vào vị trí của nguyên tố trong bảng tuần hoàn và xu hướng biến đổi tính chất, chúng ta có thể dự đoán các tính chất như bán kính nguyên tử, năng lượng ion hóa, độ âm điện, tính kim loại và tính phi kim của nguyên tố đó.
Câu hỏi 9: Tại sao He lại là một ngoại lệ trong nhóm VIIIA về số electron hóa trị?
Trả lời: He chỉ có 2 electron và cấu hình electron của nó là 1s², do đó nó có tính chất tương tự như các khí hiếm khác mặc dù không có 8 electron hóa trị.
Câu hỏi 10: Ứng dụng của việc hiểu rõ xu hướng biến đổi tính chất trong lĩnh vực khoa học vật liệu là gì?
Trả lời: Việc hiểu rõ xu hướng biến đổi tính chất giúp các nhà khoa học vật liệu thiết kế và tạo ra các vật liệu mới với các tính chất mong muốn, phục vụ cho nhiều ứng dụng khác nhau như điện tử, năng lượng và y học.
8. Lời Kết
Hiểu rõ xu hướng biến đổi tính chất của nguyên tử các nguyên tố là chìa khóa để mở cánh cửa vào thế giới hóa học và vật lý. Xe Tải Mỹ Đình hy vọng rằng bài viết này đã cung cấp cho bạn những kiến thức hữu ích và giúp bạn khám phá sâu hơn về cấu trúc vi mô của vật chất.
Nếu bạn có bất kỳ thắc mắc nào về xe tải hoặc các vấn đề liên quan đến vận tải, đừng ngần ngại liên hệ với chúng tôi tại XETAIMYDINH.EDU.VN để được tư vấn và giải đáp mọi thắc mắc. Chúng tôi luôn sẵn lòng hỗ trợ bạn!
Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội
Hotline: 0247 309 9988
Trang web: XETAIMYDINH.EDU.VN
Hãy đến với Xe Tải Mỹ Đình để trải nghiệm dịch vụ chuyên nghiệp và tận tâm nhất!