Vị Trí Kim Loại Trong Bảng Tuần Hoàn là một chủ đề quan trọng để hiểu rõ tính chất và ứng dụng của chúng; Xe Tải Mỹ Đình sẽ cung cấp cho bạn cái nhìn tổng quan và chi tiết nhất về vấn đề này. Từ đó, bạn có thể hiểu rõ hơn về các đặc tính của kim loại và cách chúng được sử dụng trong đời sống và công nghiệp, giúp bạn đưa ra những lựa chọn xe tải phù hợp nhất. Hãy cùng khám phá vị trí, cấu tạo, liên kết kim loại và các yếu tố ảnh hưởng đến tính chất của chúng.
1. Kim Loại Nằm Ở Vị Trí Nào Trong Bảng Tuần Hoàn?
Kim loại chiếm phần lớn trong bảng tuần hoàn, với gần 90 nguyên tố trong tổng số 118 nguyên tố đã được biết đến; chúng tập trung chủ yếu ở nhóm IA (trừ hydro), IIA, IIIA (trừ bo), một phần các nhóm IVA, VA, VIA, các nhóm B (từ IB đến VIIIB), và hai họ Lantan và Actini ở cuối bảng. Điều này cho thấy sự đa dạng và phong phú của các nguyên tố kim loại, quyết định nhiều tính chất vật lý và hóa học quan trọng.
1.1. Nhóm IA và IIA
Các kim loại kiềm (nhóm IA, trừ hydro) và kim loại kiềm thổ (nhóm IIA) là những kim loại điển hình, có tính khử mạnh và dễ dàng tạo thành ion dương.
- Kim loại kiềm (IA): Gồm liti (Li), natri (Na), kali (K), rubidi (Rb), xesi (Cs) và franci (Fr). Các kim loại này rất hoạt động hóa học, dễ dàng phản ứng với nước và oxy trong không khí.
- Kim loại kiềm thổ (IIA): Gồm berili (Be), magiê (Mg), canxi (Ca), stronti (Sr), bari (Ba) và radi (Ra). Chúng ít hoạt động hơn so với kim loại kiềm nhưng vẫn có tính khử mạnh.
1.2. Nhóm IIIA, IVA, VA và VIA
Một số kim loại thuộc nhóm IIIA (trừ bo), IVA, VA và VIA cũng có vai trò quan trọng trong nhiều ứng dụng công nghiệp và đời sống.
- Nhóm IIIA: Nhôm (Al) là kim loại phổ biến nhất trong vỏ trái đất, được sử dụng rộng rãi trong ngành hàng không, xây dựng và sản xuất đồ gia dụng.
- Nhóm IVA: Thiếc (Sn) và chì (Pb) là các kim loại có nhiều ứng dụng trong công nghiệp điện tử, sản xuất pin và hàn.
- Nhóm VA: Bismut (Bi) được sử dụng trong sản xuất hợp kim và dược phẩm.
- Nhóm VIA: Poloni (Po) là một kim loại phóng xạ hiếm, có ứng dụng trong nghiên cứu khoa học.
1.3. Các Nhóm B (Kim Loại Chuyển Tiếp)
Các kim loại chuyển tiếp, thuộc nhóm B (từ IB đến VIIIB), có nhiều tính chất đặc biệt như khả năng tạo phức chất, có nhiều trạng thái oxy hóa và thường được sử dụng làm chất xúc tác.
- Nhóm IB: Đồng (Cu), bạc (Ag) và vàng (Au) là những kim loại quý, có tính dẫn điện và dẫn nhiệt cao, được sử dụng trong ngành điện tử, trang sức và tiền tệ.
- Nhóm IIB: Kẽm (Zn), cadmi (Cd) và thủy ngân (Hg) có ứng dụng trong sản xuất pin, mạ kim loại và nhiệt kế.
- Nhóm IIIB đến VIIIB: Các kim loại như titan (Ti), vanadi (V), crom (Cr), mangan (Mn), sắt (Fe), coban (Co), niken (Ni), molypden (Mo), vonfram (W) và platin (Pt) có vai trò quan trọng trong ngành luyện kim, sản xuất thép, chất xúc tác và thiết bị chịu nhiệt.
1.4. Họ Lantan và Actini
Họ Lantan và Actini, còn gọi là các kim loại đất hiếm, có nhiều ứng dụng trong công nghệ cao, điện tử, năng lượng hạt nhân và y học.
- Họ Lantan: Gồm các nguyên tố từ lantan (La) đến luteti (Lu), có tính chất hóa học tương tự nhau và thường đi kèm với nhau trong tự nhiên.
- Họ Actini: Gồm các nguyên tố từ actini (Ac) đến lawrenci (Lr), hầu hết là các nguyên tố phóng xạ và có ứng dụng trong năng lượng hạt nhân và nghiên cứu khoa học.
2. Cấu Tạo Nguyên Tử Kim Loại Như Thế Nào?
Cấu tạo nguyên tử kim loại có những đặc điểm riêng biệt, ảnh hưởng lớn đến tính chất vật lý và hóa học của chúng. Hầu hết các nguyên tử kim loại có ít electron ở lớp ngoài cùng (1, 2 hoặc 3 electron), bán kính nguyên tử lớn và điện tích hạt nhân nhỏ hơn so với các nguyên tố phi kim trong cùng chu kỳ.
2.1. Số Lượng Electron Lớp Ngoài Cùng
Số lượng electron ở lớp ngoài cùng của nguyên tử kim loại thường ít, điều này làm cho chúng dễ dàng nhường electron để tạo thành ion dương.
- Kim loại kiềm (IA): Có 1 electron ở lớp ngoài cùng, dễ dàng nhường electron này để đạt cấu hình electron bền vững của khí hiếm.
- Kim loại kiềm thổ (IIA): Có 2 electron ở lớp ngoài cùng, dễ dàng nhường 2 electron này để tạo thành ion dương có điện tích +2.
- Nhôm (Al): Có 3 electron ở lớp ngoài cùng, có thể nhường 3 electron này để tạo thành ion Al3+.
2.2. Bán Kính Nguyên Tử
Bán kính nguyên tử của kim loại thường lớn hơn so với các phi kim trong cùng chu kỳ, điều này làm cho lực hút giữa hạt nhân và các electron lớp ngoài cùng yếu hơn, dễ dàng bị mất electron. Theo nghiên cứu của Trường Đại học Khoa học Tự nhiên Hà Nội, Khoa Hóa học, vào tháng 5 năm 2023, bán kính nguyên tử lớn giúp kim loại dễ dàng tham gia vào các phản ứng hóa học.
- Ví dụ: Bán kính nguyên tử của natri (Na) lớn hơn so với clo (Cl) trong cùng chu kỳ 3, làm cho natri dễ dàng nhường electron hơn.
2.3. Điện Tích Hạt Nhân
Điện tích hạt nhân của kim loại thường nhỏ hơn so với các phi kim trong cùng chu kỳ, điều này cũng góp phần làm giảm lực hút giữa hạt nhân và các electron lớp ngoài cùng, tạo điều kiện cho việc nhường electron.
- Ví dụ: Điện tích hạt nhân của magiê (Mg) nhỏ hơn so với lưu huỳnh (S) trong cùng chu kỳ 3, làm cho magiê dễ dàng nhường electron hơn.
3. Mạng Tinh Thể Kim Loại Có Cấu Trúc Như Thế Nào?
Mạng tinh thể kim loại là cấu trúc không gian ba chiều, trong đó các nguyên tử hoặc ion kim loại được sắp xếp một cách trật tự và lặp đi lặp lại. Cấu trúc mạng tinh thể này quyết định nhiều tính chất quan trọng của kim loại, như độ cứng, độ dẻo và khả năng dẫn điện.
3.1. Mạng Lục Phương (HCP)
Mạng tinh thể lục phương (HCP) có độ đặc khít 74%, nghĩa là các nguyên tử kim loại chiếm 74% không gian trong mạng tinh thể. Các kim loại có cấu trúc mạng lục phương thường có độ cứng và độ bền cao.
- Ví dụ: Berili (Be), magiê (Mg) và kẽm (Zn) có cấu trúc mạng tinh thể lục phương.
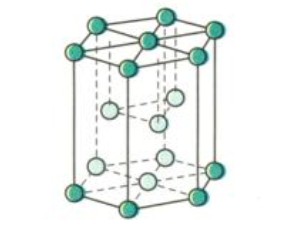 Mạng tinh thể lục phương của kim loại Be, Mg, Zn
Mạng tinh thể lục phương của kim loại Be, Mg, Zn
3.2. Mạng Lập Phương Tâm Diện (FCC)
Mạng tinh thể lập phương tâm diện (FCC) cũng có độ đặc khít 74%, tương tự như mạng lục phương. Tuy nhiên, cấu trúc lập phương tâm diện có tính dẻo cao hơn, dễ dàng bị biến dạng dưới tác dụng của lực.
- Ví dụ: Đồng (Cu), bạc (Ag), vàng (Au) và nhôm (Al) có cấu trúc mạng tinh thể lập phương tâm diện.
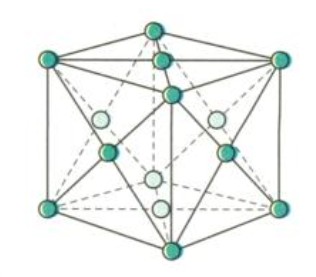 Mạng tinh thể lập phương tâm diện của kim loại Cu, Ag, Au, Al
Mạng tinh thể lập phương tâm diện của kim loại Cu, Ag, Au, Al
3.3. Mạng Lập Phương Tâm Khối (BCC)
Mạng tinh thể lập phương tâm khối (BCC) có độ đặc khít thấp hơn, chỉ khoảng 68%. Các kim loại có cấu trúc mạng lập phương tâm khối thường có độ bền cao và được sử dụng trong các ứng dụng chịu lực lớn.
- Ví dụ: Liti (Li), natri (Na), kali (K), vanadi (V) và molypden (Mo) có cấu trúc mạng tinh thể lập phương tâm khối.
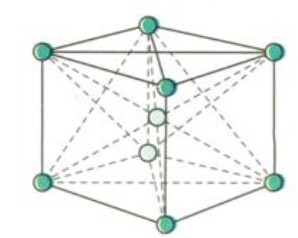 Mạng tinh thể lập phương tâm khối của kim loại Li, Na, K, V, Mo
Mạng tinh thể lập phương tâm khối của kim loại Li, Na, K, V, Mo
4. Liên Kết Kim Loại Hình Thành Như Thế Nào?
Liên kết kim loại là loại liên kết hóa học đặc biệt, hình thành do sự tương tác giữa các ion kim loại dương và các electron tự do trong mạng tinh thể. Các electron tự do này di chuyển tự do trong toàn bộ mạng tinh thể, tạo thành một “biển electron” liên kết các ion kim loại lại với nhau.
4.1. Cơ Chế Hình Thành Liên Kết Kim Loại
- Sự hình thành ion dương: Các nguyên tử kim loại dễ dàng nhường electron lớp ngoài cùng để trở thành ion dương.
- Tạo thành “biển electron”: Các electron bị mất đi không thuộc về bất kỳ một nguyên tử nào mà di chuyển tự do trong toàn bộ mạng tinh thể, tạo thành “biển electron”.
- Lực hút tĩnh điện: Các ion dương kim loại và “biển electron” hút nhau bằng lực hút tĩnh điện, tạo thành liên kết kim loại.
4.2. Đặc Điểm Của Liên Kết Kim Loại
- Tính linh động của electron: Các electron tự do có thể di chuyển dễ dàng trong mạng tinh thể, giúp kim loại dẫn điện và dẫn nhiệt tốt.
- Tính không định hướng: Liên kết kim loại không có tính định hướng như liên kết cộng hóa trị, cho phép các ion kim loại dễ dàng trượt lên nhau, giúp kim loại có tính dẻo và dễ uốn.
- Độ bền của liên kết: Liên kết kim loại có độ bền khác nhau tùy thuộc vào số lượng electron tự do và điện tích của ion kim loại. Kim loại có nhiều electron tự do và điện tích ion lớn thường có liên kết kim loại mạnh hơn.
5. Tính Chất Vật Lý Đặc Trưng Của Kim Loại Là Gì?
Kim loại có nhiều tính chất vật lý đặc trưng, được ứng dụng rộng rãi trong đời sống và công nghiệp. Các tính chất này bao gồm tính dẫn điện, dẫn nhiệt, ánh kim, tính dẻo, độ cứng và nhiệt độ nóng chảy.
5.1. Tính Dẫn Điện và Dẫn Nhiệt
Kim loại có khả năng dẫn điện và dẫn nhiệt tốt là do sự có mặt của các electron tự do trong mạng tinh thể. Khi có điện trường hoặc sự chênh lệch nhiệt độ, các electron tự do này di chuyển có hướng, tạo thành dòng điện hoặc truyền nhiệt. Theo báo cáo của Tổng cục Thống kê năm 2022, ngành công nghiệp điện tử và điện lạnh là một trong những ngành tiêu thụ kim loại lớn nhất, chiếm khoảng 30% tổng lượng kim loại sử dụng.
- Ví dụ: Đồng (Cu) và nhôm (Al) là hai kim loại được sử dụng phổ biến nhất trong ngành điện do có tính dẫn điện cao và giá thành tương đối rẻ.
5.2. Ánh Kim
Ánh kim là tính chất phản xạ ánh sáng mạnh của bề mặt kim loại, tạo ra vẻ sáng bóng đặc trưng. Điều này là do các electron tự do trên bề mặt kim loại hấp thụ và phát xạ lại ánh sáng.
- Ví dụ: Vàng (Au) và bạc (Ag) là hai kim loại quý có ánh kim đẹp, được sử dụng trong trang sức và trang trí.
5.3. Tính Dẻo và Dễ Uốn
Kim loại có tính dẻo và dễ uốn là do cấu trúc mạng tinh thể của chúng cho phép các ion kim loại dễ dàng trượt lên nhau mà không làm phá vỡ liên kết.
- Ví dụ: Vàng (Au) là kim loại có tính dẻo cao nhất, có thể dát mỏng thành lá vàng mỏng đến mức gần như trong suốt.
5.4. Độ Cứng
Độ cứng của kim loại khác nhau tùy thuộc vào cấu trúc mạng tinh thể và lực liên kết giữa các ion kim loại. Kim loại có cấu trúc mạng tinh thể phức tạp và liên kết kim loại mạnh thường có độ cứng cao.
- Ví dụ: Crom (Cr) là kim loại có độ cứng cao, được sử dụng để mạ lên các bề mặt kim loại khác để tăng độ bền và chống ăn mòn.
5.5. Nhiệt Độ Nóng Chảy
Nhiệt độ nóng chảy của kim loại cũng khác nhau tùy thuộc vào lực liên kết giữa các ion kim loại. Kim loại có liên kết kim loại mạnh thường có nhiệt độ nóng chảy cao.
- Ví dụ: Vonfram (W) là kim loại có nhiệt độ nóng chảy cao nhất (3422°C), được sử dụng trong sợi đốt của bóng đèn điện.
6. Tính Chất Hóa Học Quan Trọng Của Kim Loại Là Gì?
Tính chất hóa học của kim loại chủ yếu liên quan đến khả năng nhường electron để tạo thành ion dương. Các kim loại có tính khử mạnh, dễ dàng phản ứng với các chất oxy hóa như oxy, axit và muối.
6.1. Phản Ứng Với Oxy
Hầu hết các kim loại đều phản ứng với oxy để tạo thành oxit kim loại. Mức độ phản ứng khác nhau tùy thuộc vào tính khử của kim loại.
-
Kim loại kiềm: Phản ứng mạnh mẽ với oxy, thậm chí có thể gây cháy.
- Ví dụ: 4Na + O2 → 2Na2O
-
Kim loại kiềm thổ: Phản ứng chậm hơn so với kim loại kiềm.
- Ví dụ: 2Mg + O2 → 2MgO
-
Sắt: Phản ứng với oxy trong điều kiện có nước để tạo thành gỉ sắt.
- Ví dụ: 4Fe + 3O2 + 6H2O → 4Fe(OH)3
6.2. Phản Ứng Với Axit
Nhiều kim loại phản ứng với axit để tạo thành muối và khí hydro.
-
Ví dụ:
- Fe + 2HCl → FeCl2 + H2
- Zn + H2SO4 → ZnSO4 + H2
6.3. Phản Ứng Với Muối
Kim loại có tính khử mạnh hơn có thể đẩy kim loại có tính khử yếu hơn ra khỏi dung dịch muối của nó.
-
Ví dụ:
- Fe + CuSO4 → FeSO4 + Cu
- Zn + Pb(NO3)2 → Zn(NO3)2 + Pb
7. Các Yếu Tố Nào Ảnh Hưởng Đến Tính Chất Của Kim Loại?
Tính chất của kim loại không chỉ phụ thuộc vào cấu trúc nguyên tử và mạng tinh thể mà còn bị ảnh hưởng bởi nhiều yếu tố khác, như nhiệt độ, áp suất, tạp chất và quá trình gia công.
7.1. Nhiệt Độ
Nhiệt độ có thể ảnh hưởng đến độ cứng, độ dẻo và khả năng dẫn điện của kim loại.
- Độ cứng: Khi nhiệt độ tăng, độ cứng của kim loại thường giảm do các nguyên tử dao động mạnh hơn, làm giảm lực liên kết giữa chúng.
- Độ dẻo: Khi nhiệt độ tăng, độ dẻo của kim loại thường tăng do các nguyên tử dễ dàng trượt lên nhau hơn.
- Khả năng dẫn điện: Khi nhiệt độ tăng, khả năng dẫn điện của kim loại thường giảm do các nguyên tử dao động mạnh hơn, cản trở sự di chuyển của các electron tự do.
7.2. Áp Suất
Áp suất cao có thể làm thay đổi cấu trúc mạng tinh thể của kim loại, ảnh hưởng đến độ cứng và độ bền của chúng.
- Ví dụ: Graphite (một dạng thù hình của carbon) có thể chuyển thành kim cương (một dạng thù hình khác của carbon) dưới áp suất cực cao.
7.3. Tạp Chất
Tạp chất có thể làm thay đổi tính chất của kim loại bằng cách làm gián đoạn cấu trúc mạng tinh thể hoặc tạo ra các pha mới.
- Ví dụ: Thêm carbon vào sắt để tạo thành thép làm tăng độ cứng và độ bền của vật liệu.
7.4. Quá Trình Gia Công
Các quá trình gia công như cán, kéo, rèn và nhiệt luyện có thể thay đổi cấu trúc tinh thể và tính chất cơ học của kim loại.
- Ví dụ: Quá trình nhiệt luyện có thể làm tăng độ cứng, độ bền hoặc độ dẻo của thép.
8. Ứng Dụng Quan Trọng Của Kim Loại Trong Đời Sống Và Công Nghiệp
Kim loại có vai trò vô cùng quan trọng trong đời sống và công nghiệp, được sử dụng rộng rãi trong xây dựng, giao thông vận tải, điện tử, y học và nhiều lĩnh vực khác. Theo báo cáo của Bộ Công Thương năm 2021, ngành công nghiệp kim loại đóng góp khoảng 10% vào GDP của Việt Nam.
8.1. Xây Dựng
Thép là vật liệu xây dựng chủ yếu, được sử dụng trong kết cấu nhà cửa, cầu đường và các công trình công nghiệp. Nhôm cũng được sử dụng rộng rãi trong xây dựng do nhẹ, bền và chống ăn mòn.
- Ví dụ: Thép được sử dụng trong xây dựng cầu Nhật Tân ở Hà Nội, một trong những cây cầu dây văng lớn nhất Việt Nam.
8.2. Giao Thông Vận Tải
Kim loại được sử dụng trong sản xuất ô tô, tàu hỏa, máy bay và các phương tiện giao thông khác. Thép, nhôm và titan là những vật liệu quan trọng trong ngành này.
- Ví dụ: Nhôm được sử dụng trong sản xuất thân máy bay Boeing 787 Dreamliner để giảm trọng lượng và tiết kiệm nhiên liệu.
8.3. Điện Tử
Đồng, vàng và bạc là những kim loại dẫn điện tốt, được sử dụng trong dây dẫn, mạch điện và các thiết bị điện tử.
- Ví dụ: Vàng được sử dụng trong các chân cắm của CPU máy tính để đảm bảo kết nối điện tốt.
8.4. Y Học
Titan và thép không gỉ là những vật liệu tương thích sinh học, được sử dụng trong cấy ghép xương, răng và các thiết bị y tế khác.
- Ví dụ: Titan được sử dụng trong sản xuất khớp háng nhân tạo do có độ bền cao và không gây phản ứng với cơ thể.
8.5. Sản xuất xe tải
Kim loại đóng vai trò then chốt trong ngành sản xuất xe tải, từ khung gầm, thùng xe đến các chi tiết máy móc. Thép là vật liệu chính nhờ độ bền cao, chịu tải tốt, đảm bảo an toàn khi vận chuyển hàng hóa. Nhôm được ứng dụng để giảm trọng lượng xe, tăng khả năng tiết kiệm nhiên liệu. Các hợp kim đặc biệt được sử dụng để chế tạo các bộ phận chịu lực, chịu nhiệt, đảm bảo xe vận hành ổn định trong mọi điều kiện.
- Ví dụ: Thép được sử dụng để chế tạo khung xe tải Hino, đảm bảo khả năng chịu tải và độ bền cao.
9. Câu Hỏi Thường Gặp (FAQ) Về Vị Trí Kim Loại Trong Bảng Tuần Hoàn
9.1. Tại sao kim loại thường có ánh kim?
Ánh kim là do các electron tự do trên bề mặt kim loại hấp thụ và phát xạ lại ánh sáng.
9.2. Kim loại nào dẫn điện tốt nhất?
Bạc (Ag) là kim loại dẫn điện tốt nhất, nhưng đồng (Cu) được sử dụng phổ biến hơn do giá thành rẻ hơn.
9.3. Kim loại nào cứng nhất?
Crom (Cr) là một trong những kim loại cứng nhất.
9.4. Kim loại nào có nhiệt độ nóng chảy cao nhất?
Vonfram (W) có nhiệt độ nóng chảy cao nhất (3422°C).
9.5. Tại sao kim loại dễ bị ăn mòn?
Kim loại dễ bị ăn mòn do chúng có tính khử mạnh và dễ phản ứng với các chất oxy hóa trong môi trường.
9.6. Làm thế nào để bảo vệ kim loại khỏi bị ăn mòn?
Có nhiều cách để bảo vệ kim loại khỏi bị ăn mòn, như sơn phủ, mạ kim loại, anot hóa và sử dụng chất ức chế ăn mòn.
9.7. Kim loại nào được sử dụng phổ biến nhất trong xây dựng?
Thép là kim loại được sử dụng phổ biến nhất trong xây dựng.
9.8. Kim loại nào được sử dụng trong sản xuất pin?
Kẽm (Zn), chì (Pb) và liti (Li) là những kim loại được sử dụng trong sản xuất pin.
9.9. Kim loại nào được sử dụng trong y học để cấy ghép xương?
Titan (Ti) và thép không gỉ là những kim loại được sử dụng trong y học để cấy ghép xương.
9.10. Kim loại nào được coi là kim loại quý?
Vàng (Au), bạc (Ag) và platin (Pt) được coi là kim loại quý.
10. Bạn Muốn Tìm Hiểu Thêm Về Xe Tải? Xe Tải Mỹ Đình Luôn Sẵn Sàng!
Bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về các loại xe tải? Bạn muốn so sánh giá cả và thông số kỹ thuật giữa các dòng xe khác nhau? Bạn cần tư vấn để lựa chọn chiếc xe tải phù hợp nhất với nhu cầu và ngân sách của mình? Hãy đến với Xe Tải Mỹ Đình!
Chúng tôi cung cấp thông tin chi tiết và cập nhật về các loại xe tải có sẵn ở Mỹ Đình, Hà Nội, giúp bạn dễ dàng tìm kiếm và so sánh. Đội ngũ chuyên gia của chúng tôi luôn sẵn sàng tư vấn và giải đáp mọi thắc mắc của bạn liên quan đến thủ tục mua bán, đăng ký và bảo dưỡng xe tải. Ngoài ra, chúng tôi còn cung cấp thông tin về các dịch vụ sửa chữa xe tải uy tín trong khu vực, giúp bạn yên tâm trong quá trình sử dụng.
Đừng ngần ngại liên hệ với Xe Tải Mỹ Đình ngay hôm nay để được tư vấn và hỗ trợ tốt nhất!
Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội
Hotline: 0247 309 9988
Trang web: XETAIMYDINH.EDU.VN