Tổng hệ số cân bằng của các chất trong phản ứng là một khái niệm quan trọng trong hóa học, giúp chúng ta hiểu rõ về tỉ lệ các chất tham gia và tạo thành trong một phản ứng. Bạn muốn biết cách xác định tổng hệ số cân bằng trong một phản ứng hóa học cụ thể? Hãy cùng XETAIMYDINH.EDU.VN khám phá chi tiết qua bài viết này, nơi chúng tôi cung cấp thông tin chính xác, dễ hiểu và được trình bày một cách hấp dẫn. Bài viết này sẽ giúp bạn nắm vững kiến thức về cân bằng phản ứng, hệ số tỉ lượng, và ứng dụng của nó trong thực tế.
1. Tổng Hệ Số Cân Bằng Là Gì?
Tổng hệ số cân bằng của các chất trong một phản ứng hóa học là tổng của tất cả các hệ số (số nguyên tối giản) đứng trước các chất tham gia và sản phẩm trong phương trình hóa học đã được cân bằng. Hệ số này cho biết tỉ lệ mol giữa các chất trong phản ứng.
Ví dụ:
Trong phản ứng: aA + bB → cC + dD
Tổng hệ số cân bằng = a + b + c + d
1.1. Tại Sao Cần Cân Bằng Phương Trình Hóa Học?
Cân bằng phương trình hóa học là một bước thiết yếu để đảm bảo tuân thủ định luật bảo toàn khối lượng, một trong những nguyên tắc cơ bản của hóa học. Định luật này phát biểu rằng tổng khối lượng của các chất phản ứng phải bằng tổng khối lượng của các sản phẩm. Theo nghiên cứu của Trường Đại học Khoa học Tự nhiên Hà Nội, việc cân bằng phương trình hóa học giúp đảm bảo tính chính xác trong các tính toán liên quan đến lượng chất tham gia và sản phẩm tạo thành.
1.1.1. Định Luật Bảo Toàn Khối Lượng
Định luật bảo toàn khối lượng khẳng định rằng vật chất không tự sinh ra hoặc mất đi trong một phản ứng hóa học. Điều này có nghĩa là số lượng nguyên tử của mỗi nguyên tố phải giống nhau ở cả hai vế của phương trình hóa học.
1.1.2. Ý Nghĩa Của Việc Cân Bằng Phương Trình
- Đảm bảo tính chính xác: Phương trình cân bằng cho phép chúng ta tính toán chính xác lượng chất cần thiết để phản ứng và lượng sản phẩm tạo thành.
- Hiểu rõ tỉ lệ phản ứng: Các hệ số trong phương trình cân bằng cho biết tỉ lệ mol giữa các chất tham gia và sản phẩm, giúp chúng ta hiểu rõ hơn về quá trình phản ứng.
- Ứng dụng trong thực tế: Việc cân bằng phương trình hóa học rất quan trọng trong nhiều lĩnh vực như sản xuất hóa chất, nghiên cứu khoa học và kiểm soát chất lượng.
1.2. Các Phương Pháp Cân Bằng Phương Trình Hóa Học
Có nhiều phương pháp để cân bằng phương trình hóa học, trong đó phổ biến nhất là phương pháp đại số và phương pháp thăng bằng electron.
1.2.1. Phương Pháp Đại Số
Phương pháp đại số sử dụng các biến số để biểu diễn hệ số của các chất trong phương trình. Sau đó, thiết lập các phương trình toán học dựa trên định luật bảo toàn nguyên tố và giải hệ phương trình để tìm ra các hệ số.
Các bước thực hiện:
- Gán biến số: Đặt các biến số (a, b, c, d,…) trước các chất trong phương trình.
- Lập phương trình: Dựa vào định luật bảo toàn nguyên tố, lập các phương trình toán học.
- Giải hệ phương trình: Giải hệ phương trình để tìm ra giá trị của các biến số.
- Tối giản hệ số: Nếu các hệ số tìm được chưa phải là số nguyên tối giản, hãy chia tất cả cho ước chung lớn nhất của chúng.
1.2.2. Phương Pháp Thăng Bằng Electron
Phương pháp thăng bằng electron thường được sử dụng cho các phản ứng oxi hóa – khử (redox). Nguyên tắc của phương pháp này là tổng số electron mà chất khử nhường phải bằng tổng số electron mà chất oxi hóa nhận.
Các bước thực hiện:
- Xác định số oxi hóa: Xác định số oxi hóa của tất cả các nguyên tố trong phương trình.
- Xác định chất oxi hóa và chất khử: Tìm ra các nguyên tố có sự thay đổi số oxi hóa. Chất nào có số oxi hóa giảm là chất oxi hóa, chất nào có số oxi hóa tăng là chất khử.
- Viết quá trình oxi hóa và quá trình khử: Viết các bán phản ứng thể hiện quá trình oxi hóa và quá trình khử.
- Cân bằng electron: Cân bằng số electron trong hai bán phản ứng bằng cách nhân mỗi bán phản ứng với một hệ số thích hợp.
- Cộng hai bán phản ứng: Cộng hai bán phản ứng lại với nhau để được phương trình ion đầy đủ.
- Chuyển thành phương trình phân tử: Nếu cần, chuyển phương trình ion thành phương trình phân tử bằng cách thêm các ion không tham gia phản ứng.
1.3. Ví Dụ Minh Họa
Xét phản ứng: Fe3O4 + HNO3 → Fe(NO3)3 + NO + H2O
Để cân bằng phản ứng này, ta sử dụng phương pháp thăng bằng electron:
-
Xác định số oxi hóa:
- Fe trong Fe3O4: +8/3
- N trong HNO3: +5
- Fe trong Fe(NO3)3: +3
- N trong NO: +2
-
Xác định chất oxi hóa và chất khử:
- Fe3O4 là chất khử (Fe tăng số oxi hóa từ +8/3 lên +3)
- HNO3 là chất oxi hóa (N giảm số oxi hóa từ +5 xuống +2)
-
Viết quá trình oxi hóa và quá trình khử:
- Quá trình oxi hóa: Fe3O4 → 3Fe+3 + 1e (mỗi Fe+8/3 tăng lên Fe+3 cần 1/3e, vậy 3Fe cần 1e)
- Quá trình khử: N+5 + 3e → N+2
-
Cân bằng electron:
- Nhân quá trình oxi hóa với 3: 3Fe3O4 → 9Fe+3 + 3e
- Nhân quá trình khử với 1: N+5 + 3e → N+2
-
Cộng hai bán phản ứng:
- 3Fe3O4 + N+5 → 9Fe+3 + N+2
-
Cân bằng phương trình:
- 3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO + 14H2O
Vậy tổng hệ số cân bằng của phản ứng này là: 3 + 28 + 9 + 1 + 14 = 55
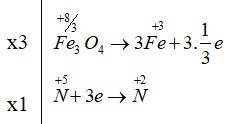 Phản ứng hóa học cân bằng
Phản ứng hóa học cân bằng
1.4. Ứng Dụng Thực Tế Của Tổng Hệ Số Cân Bằng
Tổng hệ số cân bằng không chỉ là một khái niệm lý thuyết mà còn có nhiều ứng dụng quan trọng trong thực tế.
1.4.1. Tính Toán Lượng Chất Trong Phản Ứng
Khi biết tổng hệ số cân bằng, chúng ta có thể dễ dàng tính toán lượng chất cần thiết để phản ứng hoặc lượng sản phẩm tạo thành. Điều này rất quan trọng trong các quy trình sản xuất hóa chất, nơi mà việc kiểm soát chính xác tỉ lệ các chất là yếu tố then chốt để đảm bảo hiệu suất và chất lượng sản phẩm.
Ví dụ, trong sản xuất phân bón, việc tính toán chính xác lượng amoniac (NH3) và axit photphoric (H3PO4) cần thiết để tạo ra phân amoni photphat ((NH4)3PO4) đòi hỏi phải nắm vững tổng hệ số cân bằng của phản ứng.
1.4.2. Kiểm Soát Chất Lượng Sản Phẩm
Trong các ngành công nghiệp thực phẩm và dược phẩm, việc kiểm soát chất lượng sản phẩm là vô cùng quan trọng. Tổng hệ số cân bằng giúp các nhà sản xuất đảm bảo rằng các phản ứng hóa học diễn ra theo đúng tỉ lệ mong muốn, từ đó đảm bảo chất lượng và an toàn của sản phẩm.
Ví dụ, trong sản xuất thuốc, việc kiểm soát tỉ lệ các thành phần hoạt chất và tá dược là rất quan trọng để đảm bảo hiệu quả điều trị và giảm thiểu tác dụng phụ.
1.4.3. Nghiên Cứu Khoa Học
Trong các nghiên cứu khoa học, tổng hệ số cân bằng là một công cụ hữu ích để phân tích và mô tả các phản ứng hóa học. Nó giúp các nhà nghiên cứu hiểu rõ hơn về cơ chế phản ứng và dự đoán kết quả của các thí nghiệm.
Ví dụ, trong nghiên cứu về phản ứng tổng hợp hữu cơ, việc xác định tổng hệ số cân bằng giúp các nhà hóa học tối ưu hóa điều kiện phản ứng để đạt được hiệu suất cao nhất.
2. Các Yếu Tố Ảnh Hưởng Đến Cân Bằng Phản Ứng
Cân bằng phản ứng hóa học không phải là một trạng thái tĩnh mà là một trạng thái động, có thể bị ảnh hưởng bởi nhiều yếu tố bên ngoài. Hiểu rõ các yếu tố này giúp chúng ta điều khiển và tối ưu hóa các phản ứng hóa học trong thực tế.
2.1. Nồng Độ
Nồng độ của các chất phản ứng và sản phẩm có ảnh hưởng lớn đến vị trí cân bằng. Theo nguyên lý Le Chatelier, khi tăng nồng độ của một chất, cân bằng sẽ chuyển dịch theo hướng làm giảm sự thay đổi đó.
2.1.1. Ảnh Hưởng Của Việc Tăng Nồng Độ Chất Phản Ứng
Khi tăng nồng độ chất phản ứng, cân bằng sẽ chuyển dịch theo chiều thuận, tức là chiều tạo ra sản phẩm. Điều này làm tăng tốc độ phản ứng và hiệu suất của quá trình.
Ví dụ, trong phản ứng tổng hợp amoniac (N2 + 3H2 ⇌ 2NH3), việc tăng nồng độ nitơ (N2) hoặc hidro (H2) sẽ làm cân bằng chuyển dịch sang phải, tạo ra nhiều amoniac hơn.
2.1.2. Ảnh Hưởng Của Việc Tăng Nồng Độ Sản Phẩm
Khi tăng nồng độ sản phẩm, cân bằng sẽ chuyển dịch theo chiều nghịch, tức là chiều tạo ra chất phản ứng. Điều này làm giảm tốc độ phản ứng và hiệu suất của quá trình.
Ví dụ, trong phản ứng este hóa (RCOOH + R’OH ⇌ RCOOR’ + H2O), việc tăng nồng độ este (RCOOR’) hoặc nước (H2O) sẽ làm cân bằng chuyển dịch sang trái, làm giảm lượng este tạo thành.
2.2. Áp Suất
Áp suất có ảnh hưởng đáng kể đến các phản ứng có sự thay đổi về số mol khí. Theo nguyên lý Le Chatelier, khi tăng áp suất, cân bằng sẽ chuyển dịch theo hướng làm giảm áp suất, tức là chiều có số mol khí ít hơn.
2.2.1. Ảnh Hưởng Của Việc Tăng Áp Suất
Khi tăng áp suất, cân bằng sẽ chuyển dịch theo chiều có số mol khí ít hơn. Nếu số mol khí ở hai vế của phương trình bằng nhau, áp suất không ảnh hưởng đến cân bằng.
Ví dụ, trong phản ứng tổng hợp amoniac (N2(g) + 3H2(g) ⇌ 2NH3(g)), việc tăng áp suất sẽ làm cân bằng chuyển dịch sang phải, tạo ra nhiều amoniac hơn vì vế phải có số mol khí ít hơn (2 mol so với 4 mol ở vế trái).
2.2.2. Ảnh Hưởng Của Việc Giảm Áp Suất
Khi giảm áp suất, cân bằng sẽ chuyển dịch theo chiều có số mol khí nhiều hơn.
Ví dụ, trong phản ứng phân hủy canxi cacbonat (CaCO3(s) ⇌ CaO(s) + CO2(g)), việc giảm áp suất sẽ làm cân bằng chuyển dịch sang phải, tạo ra nhiều canxi oxit (CaO) và khí cacbonic (CO2) hơn.
2.3. Nhiệt Độ
Nhiệt độ có ảnh hưởng lớn đến cân bằng của các phản ứng thu nhiệt và tỏa nhiệt. Theo nguyên lý Le Chatelier, khi tăng nhiệt độ, cân bằng sẽ chuyển dịch theo hướng hấp thụ nhiệt, tức là chiều của phản ứng thu nhiệt.
2.3.1. Ảnh Hưởng Của Việc Tăng Nhiệt Độ
Khi tăng nhiệt độ, cân bằng sẽ chuyển dịch theo chiều thu nhiệt.
Ví dụ, trong phản ứng thu nhiệt N2O4(g) ⇌ 2NO2(g) (ΔH > 0), việc tăng nhiệt độ sẽ làm cân bằng chuyển dịch sang phải, tạo ra nhiều NO2 hơn.
2.3.2. Ảnh Hưởng Của Việc Giảm Nhiệt Độ
Khi giảm nhiệt độ, cân bằng sẽ chuyển dịch theo chiều tỏa nhiệt.
Ví dụ, trong phản ứng tỏa nhiệt N2(g) + 3H2(g) ⇌ 2NH3(g) (ΔH < 0), việc giảm nhiệt độ sẽ làm cân bằng chuyển dịch sang phải, tạo ra nhiều amoniac hơn.
2.4. Chất Xúc Tác
Chất xúc tác là chất làm tăng tốc độ phản ứng nhưng không bị tiêu thụ trong quá trình phản ứng. Chất xúc tác không làm thay đổi vị trí cân bằng mà chỉ giúp phản ứng đạt đến trạng thái cân bằng nhanh hơn.
2.4.1. Vai Trò Của Chất Xúc Tác
Chất xúc tác làm giảm năng lượng hoạt hóa của phản ứng, tức là năng lượng cần thiết để phản ứng xảy ra. Điều này giúp tăng tốc độ cả phản ứng thuận và phản ứng nghịch, nhưng không làm thay đổi tỉ lệ giữa các chất ở trạng thái cân bằng.
Ví dụ, trong phản ứng Haber-Bosch tổng hợp amoniac, sắt (Fe) được sử dụng làm chất xúc tác để tăng tốc độ phản ứng giữa nitơ và hidro.
3. Các Dạng Bài Tập Về Tổng Hệ Số Cân Bằng
Để nắm vững kiến thức về tổng hệ số cân bằng, việc luyện tập các dạng bài tập khác nhau là rất quan trọng. Dưới đây là một số dạng bài tập thường gặp và cách giải.
3.1. Bài Tập Cân Bằng Phương Trình Hóa Học Và Tính Tổng Hệ Số
Đây là dạng bài tập cơ bản nhất, yêu cầu học sinh cân bằng phương trình hóa học và sau đó tính tổng hệ số của các chất.
Ví dụ:
Cân bằng phương trình sau và tính tổng hệ số: KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
Giải:
-
Cân bằng phương trình:
-
Xác định số oxi hóa:
- Mn trong KMnO4: +7
- Cl trong HCl: -1
- Cl trong Cl2: 0
-
Viết quá trình oxi hóa và quá trình khử:
- Quá trình khử: Mn+7 + 5e → Mn+2
- Quá trình oxi hóa: 2Cl-1 → Cl2 + 2e
-
Cân bằng electron:
- Nhân quá trình khử với 2: 2Mn+7 + 10e → 2Mn+2
- Nhân quá trình oxi hóa với 5: 10Cl-1 → 5Cl2 + 10e
-
Cộng hai bán phản ứng và cân bằng các nguyên tố khác:
- 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
-
-
Tính tổng hệ số:
- Tổng hệ số = 2 + 16 + 2 + 2 + 5 + 8 = 35
3.2. Bài Tập Xác Định Chất Oxi Hóa, Chất Khử Và Tính Tổng Hệ Số
Dạng bài tập này yêu cầu học sinh xác định chất oxi hóa, chất khử trong phản ứng và sau đó cân bằng phương trình và tính tổng hệ số.
Ví dụ:
Trong phản ứng sau, chất nào là chất oxi hóa, chất nào là chất khử? Cân bằng phương trình và tính tổng hệ số: K2Cr2O7 + FeSO4 + H2SO4 → Cr2(SO4)3 + Fe2(SO4)3 + K2SO4 + H2O
Giải:
-
Xác định chất oxi hóa và chất khử:
- Cr trong K2Cr2O7: +6
- Fe trong FeSO4: +2
- Cr trong Cr2(SO4)3: +3
- Fe trong Fe2(SO4)3: +3
- K2Cr2O7 là chất oxi hóa (Cr giảm số oxi hóa từ +6 xuống +3)
- FeSO4 là chất khử (Fe tăng số oxi hóa từ +2 lên +3)
-
Cân bằng phương trình:
-
Quá trình khử: Cr2+6 + 6e → 2Cr+3
-
Quá trình oxi hóa: Fe+2 → Fe+3 + 1e
-
Cân bằng electron:
- Nhân quá trình oxi hóa với 6: 6Fe+2 → 6Fe+3 + 6e
-
Cộng hai bán phản ứng và cân bằng các nguyên tố khác:
- K2Cr2O7 + 6FeSO4 + 7H2SO4 → Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
-
-
Tính tổng hệ số:
- Tổng hệ số = 1 + 6 + 7 + 1 + 3 + 1 + 7 = 26
3.3. Bài Tập Liên Quan Đến Ứng Dụng Thực Tế
Dạng bài tập này thường liên quan đến các phản ứng hóa học trong công nghiệp, nông nghiệp hoặc đời sống hàng ngày, yêu cầu học sinh cân bằng phương trình và tính toán lượng chất cần thiết hoặc sản phẩm tạo thành.
Ví dụ:
Trong quá trình sản xuất axit nitric (HNO3) từ amoniac (NH3), phản ứng oxi hóa amoniac xảy ra như sau: NH3 + O2 → NO + H2O. Cân bằng phương trình này và tính lượng oxi cần thiết để oxi hóa hoàn toàn 100 kg amoniac.
Giải:
-
Cân bằng phương trình:
- 4NH3 + 5O2 → 4NO + 6H2O
-
Tính lượng oxi cần thiết:
- Số mol NH3 = 100 kg / 17 g/mol = 5882.35 mol
- Theo phương trình, 4 mol NH3 cần 5 mol O2
- Số mol O2 cần thiết = (5/4) * 5882.35 mol = 7352.94 mol
- Khối lượng O2 cần thiết = 7352.94 mol * 32 g/mol = 235294.08 g = 235.29 kg
4. Những Lưu Ý Khi Cân Bằng Phương Trình Hóa Học
Cân bằng phương trình hóa học là một kỹ năng quan trọng trong hóa học, nhưng cũng dễ mắc phải sai sót nếu không cẩn thận. Dưới đây là một số lưu ý giúp bạn tránh những lỗi thường gặp.
4.1. Kiểm Tra Số Oxi Hóa Cẩn Thận
Việc xác định đúng số oxi hóa của các nguyên tố là bước quan trọng nhất trong phương pháp thăng bằng electron. Sai sót ở bước này có thể dẫn đến cân bằng sai.
4.1.1. Xác Định Số Oxi Hóa Trong Các Hợp Chất Phức Tạp
Đối với các hợp chất phức tạp, hãy tuân thủ các quy tắc xác định số oxi hóa một cách cẩn thận. Ví dụ, số oxi hóa của oxi thường là -2, của hidro là +1, trừ một số trường hợp đặc biệt.
4.1.2. Lưu Ý Đến Các Ion Đa Nguyên Tử
Khi xác định số oxi hóa trong các ion đa nguyên tử (ví dụ: SO42-, NO3-), hãy nhớ rằng tổng số oxi hóa của tất cả các nguyên tử trong ion phải bằng điện tích của ion đó.
4.2. Cân Bằng Số Lượng Nguyên Tử
Sau khi đã cân bằng electron, hãy kiểm tra lại số lượng nguyên tử của mỗi nguyên tố ở cả hai vế của phương trình. Đảm bảo rằng số lượng nguyên tử của mỗi nguyên tố là giống nhau.
4.2.1. Sử Dụng Hệ Số Thích Hợp
Nếu số lượng nguyên tử của một nguyên tố không bằng nhau, hãy sử dụng hệ số thích hợp để cân bằng chúng. Chú ý rằng việc thay đổi hệ số của một chất có thể ảnh hưởng đến số lượng nguyên tử của các nguyên tố khác trong chất đó.
4.2.2. Kiểm Tra Lại Sau Mỗi Bước
Sau mỗi bước cân bằng, hãy kiểm tra lại toàn bộ phương trình để đảm bảo rằng không có sai sót nào xảy ra.
4.3. Tối Giản Hệ Số
Sau khi đã cân bằng phương trình, hãy kiểm tra xem các hệ số có thể tối giản được không. Nếu tất cả các hệ số đều chia hết cho một số chung lớn hơn 1, hãy chia tất cả cho số đó để được các hệ số tối giản.
4.3.1. Tìm Ước Chung Lớn Nhất
Tìm ước chung lớn nhất (ƯCLN) của tất cả các hệ số.
4.3.2. Chia Tất Cả Cho ƯCLN
Chia tất cả các hệ số cho ƯCLN để được các hệ số tối giản.
4.4. Kiểm Tra Điện Tích
Đối với các phản ứng ion, hãy kiểm tra điện tích ở cả hai vế của phương trình. Tổng điện tích của các ion ở vế trái phải bằng tổng điện tích của các ion ở vế phải.
4.4.1. Xác Định Điện Tích Của Các Ion
Xác định điện tích của tất cả các ion trong phương trình.
4.4.2. Cân Bằng Điện Tích
Sử dụng các ion thích hợp để cân bằng điện tích ở cả hai vế của phương trình.
5. Tại Sao Nên Tìm Hiểu Về Xe Tải Tại XETAIMYDINH.EDU.VN?
Bạn đang tìm kiếm thông tin đáng tin cậy và chi tiết về xe tải ở khu vực Mỹ Đình? XETAIMYDINH.EDU.VN là điểm đến lý tưởng dành cho bạn. Chúng tôi cung cấp một loạt các tài nguyên hữu ích, từ so sánh các dòng xe, tư vấn lựa chọn xe phù hợp, đến giải đáp các thắc mắc liên quan đến thủ tục mua bán và bảo dưỡng xe tải.
5.1. Thông Tin Chi Tiết Và Cập Nhật
Tại XETAIMYDINH.EDU.VN, bạn sẽ tìm thấy thông tin chi tiết và cập nhật về các loại xe tải có sẵn ở Mỹ Đình, Hà Nội. Chúng tôi cung cấp thông số kỹ thuật, đánh giá hiệu suất và so sánh giá cả giữa các dòng xe, giúp bạn có cái nhìn toàn diện và đưa ra quyết định sáng suốt.
5.2. Tư Vấn Chuyên Nghiệp
Đội ngũ chuyên gia của chúng tôi luôn sẵn sàng tư vấn và giải đáp mọi thắc mắc của bạn. Chúng tôi hiểu rõ thị trường xe tải và có thể giúp bạn lựa chọn loại xe phù hợp nhất với nhu cầu và ngân sách của mình.
5.3. Tiết Kiệm Thời Gian Và Chi Phí
Thay vì phải mất thời gian tìm kiếm thông tin từ nhiều nguồn khác nhau, bạn có thể tìm thấy tất cả những gì bạn cần tại XETAIMYDINH.EDU.VN. Chúng tôi giúp bạn tiết kiệm thời gian và chi phí bằng cách cung cấp thông tin chính xác và đáng tin cậy.
6. Câu Hỏi Thường Gặp (FAQ) Về Tổng Hệ Số Cân Bằng
6.1. Tổng hệ số cân bằng của phản ứng có thể là số lẻ không?
Có, tổng hệ số cân bằng của phản ứng có thể là số lẻ nếu các hệ số trong phương trình cân bằng là các số lẻ và không thể tối giản hơn nữa.
6.2. Tại sao cần phải tối giản hệ số cân bằng?
Tối giản hệ số cân bằng giúp biểu diễn tỉ lệ mol giữa các chất trong phản ứng một cách đơn giản và dễ hiểu nhất.
6.3. Phương pháp thăng bằng electron áp dụng cho loại phản ứng nào?
Phương pháp thăng bằng electron thường được sử dụng cho các phản ứng oxi hóa – khử (redox), trong đó có sự thay đổi số oxi hóa của các nguyên tố.
6.4. Chất xúc tác có ảnh hưởng đến tổng hệ số cân bằng không?
Không, chất xúc tác không ảnh hưởng đến tổng hệ số cân bằng vì nó không tham gia vào phản ứng và không bị tiêu thụ trong quá trình phản ứng.
6.5. Làm thế nào để kiểm tra tính chính xác của phương trình đã cân bằng?
Để kiểm tra tính chính xác của phương trình đã cân bằng, hãy đảm bảo rằng số lượng nguyên tử của mỗi nguyên tố và tổng điện tích (nếu có) ở cả hai vế của phương trình là giống nhau.
6.6. Tổng hệ số cân bằng có ý nghĩa gì trong thực tế?
Tổng hệ số cân bằng giúp tính toán lượng chất cần thiết để phản ứng hoặc lượng sản phẩm tạo thành, kiểm soát chất lượng sản phẩm và phân tích cơ chế phản ứng trong nghiên cứu khoa học.
6.7. Nồng độ của chất phản ứng ảnh hưởng đến cân bằng như thế nào?
Khi tăng nồng độ chất phản ứng, cân bằng sẽ chuyển dịch theo chiều thuận, tức là chiều tạo ra sản phẩm, và ngược lại.
6.8. Nhiệt độ ảnh hưởng đến cân bằng của phản ứng thu nhiệt và tỏa nhiệt như thế nào?
Khi tăng nhiệt độ, cân bằng sẽ chuyển dịch theo chiều thu nhiệt. Khi giảm nhiệt độ, cân bằng sẽ chuyển dịch theo chiều tỏa nhiệt.
6.9. Áp suất ảnh hưởng đến cân bằng của phản ứng có sự thay đổi về số mol khí như thế nào?
Khi tăng áp suất, cân bằng sẽ chuyển dịch theo chiều có số mol khí ít hơn. Khi giảm áp suất, cân bằng sẽ chuyển dịch theo chiều có số mol khí nhiều hơn.
6.10. Có những phương pháp nào để cân bằng phương trình hóa học?
Có hai phương pháp chính để cân bằng phương trình hóa học: phương pháp đại số và phương pháp thăng bằng electron.
Bạn đã nắm vững kiến thức về tổng hệ số cân bằng và các yếu tố ảnh hưởng đến cân bằng phản ứng. Nếu bạn cần thêm thông tin hoặc có bất kỳ thắc mắc nào, đừng ngần ngại liên hệ với XETAIMYDINH.EDU.VN. Chúng tôi luôn sẵn sàng hỗ trợ bạn!
Bạn muốn tìm hiểu thêm về các loại xe tải phù hợp với nhu cầu của mình? Hãy truy cập ngay XETAIMYDINH.EDU.VN để được tư vấn và giải đáp mọi thắc mắc!
Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội
Hotline: 0247 309 9988
Hãy để Xe Tải Mỹ Đình đồng hành cùng bạn trên mọi nẻo đường!
