Gốc axit là một phần quan trọng trong hóa học, ảnh hưởng trực tiếp đến tính chất và ứng dụng của nhiều hợp chất. Bạn muốn hiểu rõ hơn về gốc axit, từ định nghĩa, phân loại đến tính chất và ứng dụng thực tế? Hãy cùng Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN) khám phá tất tần tật về gốc axit, giúp bạn nắm vững kiến thức và ứng dụng chúng một cách hiệu quả. Chúng tôi sẽ cung cấp những thông tin chi tiết và dễ hiểu nhất, giúp bạn tự tin chinh phục mọi bài toán hóa học và ứng dụng thực tế liên quan đến gốc axit.
1. Định Nghĩa Gốc Axit: Gốc Axit Là Gì?
Gốc axit là phần còn lại của phân tử axit sau khi một hoặc nhiều nguyên tử hydro (H+) đã được tách ra. Theo nghiên cứu của Trường Đại học Khoa học Tự nhiên Hà Nội, Khoa Hóa học, năm 2023, việc hiểu rõ về gốc axit giúp dự đoán và giải thích các phản ứng hóa học liên quan đến axit.
Ví dụ:
- Axit clohidric (HCl) khi tách nguyên tử hydro sẽ tạo thành gốc axit clorua (-Cl).
- Axit nitric (HNO3) khi tách nguyên tử hydro sẽ tạo thành gốc axit nitrat (-NO3).
- Axit sulfuric (H2SO4) khi tách nguyên tử hydro sẽ tạo thành gốc axit sunfat (=SO4) hoặc hiđrosunfat (-HSO4).
- Axit photphoric (H3PO4) khi tách nguyên tử hydro sẽ tạo thành gốc axit photphat (≡PO4), hiđrophotphat (=HPO4), hoặc đihiđrophotphat (-H2PO4).
 Gốc Axit Là Gì
Gốc Axit Là Gì
Hình ảnh minh họa gốc axit trong phân tử axit clohidric (HCl)
Gốc axit không chỉ tồn tại trong phòng thí nghiệm mà còn có mặt trong nhiều lĩnh vực đời sống. Chúng ta có thể tìm thấy gốc axit trong nước uống chưa qua xử lý, trong các loại thực phẩm có vị chua như cam, chanh và các loại trái cây khác. Tại Xe Tải Mỹ Đình, chúng tôi hiểu rằng việc nắm vững kiến thức về gốc axit sẽ giúp bạn hiểu rõ hơn về các quá trình hóa học diễn ra xung quanh chúng ta.
2. Phân Loại Gốc Axit: Có Bao Nhiêu Loại Gốc Axit?
Gốc axit được phân loại dựa trên cấu tạo và thành phần nguyên tố. Theo phân loại này, gốc axit có thể được chia thành hai loại chính: gốc axit có hydro và gốc axit không có hydro, cũng như gốc axit có oxi và gốc axit không có oxi.
2.1. Phân Loại Theo Cấu Tạo: Gốc Axit Có Hydro và Không Có Hydro
- Gốc axit có hydro: Là gốc axit vẫn còn chứa nguyên tử hydro trong công thức hóa học. Ví dụ: -HSO4 (hiđrosunfat), =HPO4 (hiđrophotphat), -H2PO4 (đihiđrophotphat).
- Gốc axit không có hydro: Là gốc axit không chứa nguyên tử hydro trong công thức hóa học. Ví dụ: -Cl (clorua), -NO3 (nitrat), =SO4 (sunfat), ≡PO4 (photphat).
2.2. Phân Loại Theo Thành Phần Nguyên Tố: Gốc Axit Có Oxi và Không Có Oxi
- Gốc axit có oxi: Là gốc axit chứa nguyên tử oxi trong công thức hóa học. Ví dụ: -NO3 (nitrat), =SO4 (sunfat), ≡PO4 (photphat).
- Gốc axit không có oxi: Là gốc axit không chứa nguyên tử oxi trong công thức hóa học. Ví dụ: -Cl (clorua), -Br (bromua), -F (florua), -I (iodua).
Hình ảnh minh họa các loại gốc axit khác nhau
Để giúp bạn dễ dàng hình dung và ghi nhớ các loại gốc axit, Xe Tải Mỹ Đình xin cung cấp bảng tổng hợp các axit thông dụng, gốc axit tương ứng, và cách gọi tên:
| STT | Công Thức Axit | Tên Gọi Axit | Khối Lượng Axit (đvC) | Công Thức Gốc Axit | Tên Gọi Gốc Axit | Hóa Trị | Khối Lượng Gốc Axit (đvC) |
|---|---|---|---|---|---|---|---|
| 1 | HCl | Axit clohidric | 36.5 | -Cl | Clorua | I | 35.5 |
| 2 | HBr | Axit bromhidric | 81 | -Br | Bromua | I | 80 |
| 3 | HF | Axit flohidric | 20 | -F | Florua | I | 19 |
| 4 | HI | Axit iothidric | 128 | -I | Iodua | I | 127 |
| 5 | HNO3 | Axit nitric | 63 | -NO3 | Nitrat | I | 62 |
| 6 | HNO2 | Axit nitrơ | 47 | -NO2 | Nitrit | I | 46 |
| 7 | H2CO3 | Axit cacbonic | 62 | =CO3 | Cacbonat | II | 60 |
| -HCO3 | Hidrocacbonat | I | 61 | ||||
| 8 | H2SO4 | Axit sulfuric | 98 | =SO4 | Sunfat | II | 96 |
| -HSO4 | Hidro sunfat | I | 97 | ||||
| 9 | H2SO3 | Axit sunfurơ | 82 | =SO3 | Sunfit | II | 80 |
| -HSO3 | Hidro sunfit | I | 81 | ||||
| 10 | H3PO4 | Axit photphoric | 98 | ≡PO4 | Photphat | III | 95 |
| -H2PO4 | Đihiđro photphat | I | 97 | ||||
| =HPO4 | Hiđro photphat | II | 96 | ||||
| 11 | H3PO3 | Axit photphorơ | 82 | ≡PO3 | Photphit | III | 79 |
| -H2PO3 | Đihiđro photphit | I | 81 | ||||
| =HPO3 | Hiđro photphit | II | 80 | ||||
| 12 | H2S | Axit sunfuhiđric | 34 | =S | Sunfua | II | 32 |
| -HS | Hiđro sunfua | I | 33 | ||||
| 13 | H2SiO3 | Axit silicic | 78 | =SiO3 | Silicat | II | 76 |
| -HSiO3 | Hiđro silicat | I | 77 |
Hi vọng bảng trên sẽ giúp bạn dễ dàng hơn trong việc nhận diện và phân loại các gốc axit thường gặp. Nếu bạn cần thêm thông tin chi tiết hoặc có bất kỳ thắc mắc nào, đừng ngần ngại liên hệ với Xe Tải Mỹ Đình để được tư vấn tận tình.
3. Tính Chất Hóa Học Của Axit: Các Phản Ứng Hóa Học Quan Trọng Của Axit
Axit có những tính chất hóa học đặc trưng, được ứng dụng rộng rãi trong nhiều lĩnh vực. Một trong những tính chất dễ nhận biết nhất là khả năng làm đổi màu quỳ tím thành đỏ. Ngoài ra, axit còn tham gia vào nhiều phản ứng quan trọng khác như phản ứng với kim loại, bazơ, oxit bazơ và muối.
3.1. Axit Tác Dụng Với Kim Loại Tạo Thành Muối và Giải Phóng Khí Hydro
Phương trình tổng quát: Axit + Kim loại → Muối + H2
Điều kiện phản ứng:
- Axit phải là axit loãng.
- Kim loại phải đứng trước hydro trong dãy hoạt động hóa học của kim loại.
Ví dụ:
- 2Na + 2HCl → 2NaCl + H2
- Fe + H2SO4 (loãng) → FeSO4 + H2
Lưu ý: Các kim loại như đồng (Cu), bạc (Ag), vàng (Au), và bạch kim (Pt) không phản ứng với axit loãng.
3.2. Axit Tác Dụng Với Bazơ Tạo Thành Muối và Nước (Phản Ứng Trung Hòa)
Phương trình tổng quát: Axit + Bazơ → Muối + H2O
Ví dụ:
- NaOH + HCl → NaCl + H2O
- Ba(OH)2 + 2HCl → BaCl2 + 2H2O
3.3. Axit Tác Dụng Với Oxit Bazơ Tạo Thành Muối và Nước
Phương trình tổng quát: Axit + Oxit bazơ → Muối + H2O
Ví dụ:
- Na2O + 2HCl → 2NaCl + H2O
- CuO + 2HCl → CuCl2 + H2O
3.4. Axit Tác Dụng Với Muối
Điều kiện phản ứng:
- Sau phản ứng phải tạo thành kết tủa hoặc khí bay hơi.
- Nếu thu được muối tan, axit ban đầu là axit yếu. Nếu thu được muối không tan, axit ban đầu là axit mạnh.
Ví dụ:
- H2SO4 + BaCl2 → BaSO4(↓) + 2HCl (BaSO4 là kết tủa)
- K2CO3 + 2HCl → 2KCl + H2O + CO2 (H2CO3 phân hủy thành H2O và CO2)
Hình ảnh minh họa các phản ứng hóa học của axit
Tại Xe Tải Mỹ Đình, chúng tôi tin rằng việc nắm vững các tính chất hóa học của axit sẽ giúp bạn hiểu rõ hơn về các ứng dụng thực tế của chúng trong đời sống và sản xuất.
4. Ứng Dụng Của Axit: Axit Được Ứng Dụng Trong Những Lĩnh Vực Nào?
Axit có vai trò quan trọng và được ứng dụng rộng rãi trong nhiều lĩnh vực khác nhau của đời sống và sản xuất. Từ công nghiệp, thực phẩm đến dược phẩm và trong cơ thể người, axit đóng vai trò không thể thiếu.
4.1. Ứng Dụng Trong Công Nghiệp
- Loại bỏ gỉ sắt: Axit được sử dụng để loại bỏ gỉ sắt trên bề mặt kim loại, làm sạch bề mặt trước khi hàn hoặc sơn.
- Chất điện phân: Axit sulfuric (H2SO4) được sử dụng làm chất điện phân trong ắc quy xe hơi.
- Sản xuất phân bón: Axit photphoric (H3PO4) là nguyên liệu quan trọng trong sản xuất phân bón.
- Điều chế chất tẩy rửa: Axit được sử dụng để điều chế các chất tẩy rửa, giúp làm sạch và loại bỏ các vết bẩn cứng đầu.
- Sản xuất dầu mỏ: Axit sulfuric được sử dụng trong quá trình tinh chế dầu mỏ.
- Sản xuất muối và axit: Axit là nguyên liệu để sản xuất các loại muối và axit khác.
- Sản xuất thuốc nổ: Axit nitric (HNO3) là thành phần quan trọng trong sản xuất thuốc nổ.
- Luyện kim: Axit được sử dụng trong quá trình luyện kim để tách kim loại từ quặng.
- Sản xuất chất dẻo: Axit được sử dụng trong quá trình sản xuất các loại chất dẻo, polyme.
- Tẩy trắng giấy: Axit được sử dụng để tẩy trắng giấy, giúp giấy trắng sáng hơn.
4.2. Ứng Dụng Trong Lĩnh Vực Thực Phẩm
Axit được sử dụng rộng rãi trong công nghiệp thực phẩm với nhiều vai trò khác nhau:
- Chất tạo màu: Axit được sử dụng để tạo màu sắc hấp dẫn cho thực phẩm.
- Điều chỉnh độ chua: Axit được sử dụng để điều chỉnh độ chua của thực phẩm, tạo hương vị đặc trưng.
- Chất chống tạo bọt: Axit được sử dụng để ngăn chặn sự tạo bọt trong quá trình chế biến thực phẩm.
- Chất chống vón: Axit được sử dụng để ngăn chặn sự vón cục của các thành phần trong thực phẩm.
- Chất chống oxy hóa: Axit được sử dụng để ngăn chặn quá trình oxy hóa, giúp bảo quản thực phẩm lâu hơn.
- Chất tạo lượng: Axit được sử dụng để tăng thể tích và độ đặc của thực phẩm.
- Giữ màu: Axit được sử dụng để giữ màu sắc tự nhiên của thực phẩm.
- Chất chuyển thể sữa: Axit được sử dụng để chuyển đổi trạng thái của sữa, tạo ra các sản phẩm như sữa chua, phô mai.
- Điều vị, tạo vị: Axit được sử dụng để tăng cường hương vị và tạo vị đặc trưng cho thực phẩm.
- Xử lý bột ngũ cốc: Axit được sử dụng để xử lý bột ngũ cốc, cải thiện chất lượng và độ bền của sản phẩm.
- Giữ ẩm: Axit được sử dụng để giữ ẩm cho thực phẩm, ngăn chặn tình trạng khô cứng.
- Chất ổn định: Axit được sử dụng để ổn định cấu trúc và chất lượng của thực phẩm.
4.3. Ứng Dụng Trong Lĩnh Vực Dược Phẩm
- Aspirin: Aspirin là một loại thuốc chứa axit acetylsalicylic, được sử dụng để giảm đau, hạ sốt và chống viêm. Aspirin đã được nghiên cứu và sử dụng từ cuối thế kỷ 19.
4.4. Vai Trò Của Axit Trong Cơ Thể Người
Axit đóng vai trò quan trọng trong nhiều quá trình sinh học của cơ thể:
- Tiêu hóa thức ăn: Axit hydrochloric (HCl) trong dạ dày giúp tiêu hóa thức ăn bằng cách phá vỡ các phân tử thức ăn có cấu trúc phức tạp.
- Tổng hợp protein: Axit tham gia vào quá trình tổng hợp các protein cần thiết cho sự phát triển và sửa chữa các mô trong cơ thể.
- Sản xuất DNA và RNA: Các axit nucleic rất cần thiết cho việc sản xuất DNA, RNA và chuyển các đặc tính di truyền sang thế hệ sau.
- Duy trì cân bằng pH: Axit cacbonic (H2CO3) đóng vai trò quan trọng trong việc duy trì và cân bằng độ pH trong cơ thể.
Hình ảnh minh họa ứng dụng của axit trong các lĩnh vực khác nhau
4.5. Lưu Ý Khi Sử Dụng Axit
Mặc dù axit có nhiều ứng dụng quan trọng, người sử dụng cần cẩn trọng khi tiếp xúc với axit và các chế phẩm từ axit. Axit có thể gây ra những tai nạn đáng tiếc như bỏng nghiêm trọng, biến dạng cơ thể, thậm chí tử vong.
- Biện pháp bảo hộ: Khi sử dụng axit, cần tuân thủ các biện pháp bảo hộ như đeo găng tay, mặc quần áo bảo hộ, đeo khẩu trang, không mở pipet bằng miệng, và tuân thủ hướng dẫn sử dụng.
- Lưu trữ axit: Không lưu trữ axit trong thùng kim loại vì axit có thể ăn mòn bình chứa. Đậy nắp kín đáo, để nơi khô ráo, tránh ánh nắng trực tiếp, và tránh bảo quản chung với các chất có tính axit để hạn chế cháy nổ.
Tại Xe Tải Mỹ Đình, chúng tôi luôn khuyến cáo người dùng cần tuân thủ nghiêm ngặt các biện pháp an toàn khi sử dụng axit để đảm bảo an toàn cho bản thân và những người xung quanh.
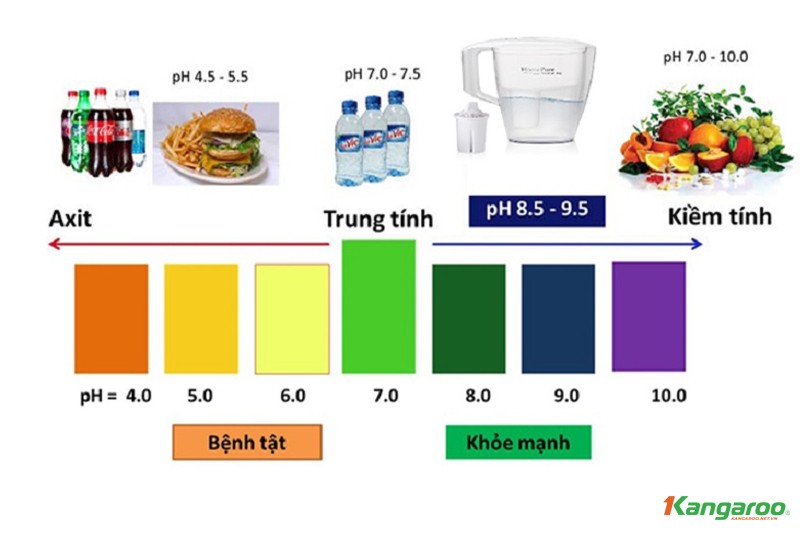
5. Gốc Axit Trong Nước Uống: Gốc Axit Ảnh Hưởng Đến Chất Lượng Nước Uống Như Thế Nào?
Gốc axit có thể xuất hiện trong nước uống từ nhiều nguồn khác nhau, bao gồm quá trình hòa tan khoáng chất tự nhiên, ô nhiễm công nghiệp, và sử dụng hóa chất trong xử lý nước. Sự hiện diện của các gốc axit này có thể ảnh hưởng đến chất lượng và độ an toàn của nước uống.
5.1. Các Gốc Axit Thường Gặp Trong Nước Uống
- Nitrat (NO3-) và Nitrit (NO2-): Thường có nguồn gốc từ phân bón nông nghiệp, nước thải sinh hoạt và công nghiệp. Nitrat có thể gây ra các vấn đề sức khỏe, đặc biệt là ở trẻ sơ sinh (hội chứng “blue baby”).
- Sunfat (SO42-): Có thể xuất hiện tự nhiên từ các khoáng chất hoặc do ô nhiễm công nghiệp. Hàm lượng sunfat cao có thể gây ra vị khó chịu và ảnh hưởng đến hệ tiêu hóa.
- Clorua (Cl-): Thường được sử dụng trong quá trình khử trùng nước. Hàm lượng clorua cao có thể gây ra vị mặn và ăn mòn đường ống dẫn nước.
- Photphat (PO43-): Có thể có nguồn gốc từ phân bón, chất thải sinh hoạt và công nghiệp. Hàm lượng photphat cao có thể gây ra tình trạng phú dưỡng, làm ô nhiễm nguồn nước.
- Cacbonat (CO32-) và Bicarbonat (HCO3-): Các gốc này có vai trò quan trọng trong việc duy trì độ pH ổn định của nước. Tuy nhiên, hàm lượng quá cao có thể gây ra hiện tượng nước cứng.
5.2. Ảnh Hưởng Của Gốc Axit Đến Sức Khỏe
- Nitrat và Nitrit: Gây ra hội chứng “blue baby” ở trẻ sơ sinh, làm giảm khả năng vận chuyển oxy của máu. Ngoài ra, nitrit có thể phản ứng với các amin trong cơ thể tạo thành các hợp chất nitrosamine, có khả năng gây ung thư.
- Sunfat: Hàm lượng cao có thể gây ra tiêu chảy và mất nước.
- Clorua: Hàm lượng cao có thể gây ra vị mặn khó chịu và ăn mòn đường ống dẫn nước.
- Photphat: Gây ra tình trạng phú dưỡng, làm ô nhiễm nguồn nước, ảnh hưởng đến hệ sinh thái và sức khỏe con người.
- Cacbonat và Bicarbonat: Gây ra hiện tượng nước cứng, làm giảm hiệu quả của xà phòng và chất tẩy rửa, gây đóng cặn trong đường ống và thiết bị gia dụng.
5.3. Giải Pháp Loại Bỏ Gốc Axit Trong Nước Uống
Để đảm bảo chất lượng và an toàn của nước uống, cần áp dụng các biện pháp loại bỏ gốc axit hiệu quả:
- Hệ thống lọc nước RO (Reverse Osmosis): Loại bỏ hầu hết các gốc axit và tạp chất có trong nước, đảm bảo nước uống tinh khiết và an toàn.
- Hệ thống lọc nước Nano: Loại bỏ các gốc axit và vi khuẩn, virus, giữ lại các khoáng chất tự nhiên có lợi cho sức khỏe.
- Sử dụng than hoạt tính: Than hoạt tính có khả năng hấp thụ các chất ô nhiễm, bao gồm một số gốc axit, giúp cải thiện chất lượng nước.
- Đun sôi nước: Đun sôi nước có thể giúp loại bỏ một số vi khuẩn và virus, nhưng không loại bỏ được các gốc axit.
Hình ảnh minh họa hệ thống lọc nước RO giúp loại bỏ gốc axit trong nước uống
Tại Xe Tải Mỹ Đình, chúng tôi khuyên bạn nên sử dụng các hệ thống lọc nước hiện đại để đảm bảo nước uống luôn tinh khiết và an toàn cho sức khỏe gia đình.
6. So Sánh Gốc Axit Mạnh và Gốc Axit Yếu: Sự Khác Biệt Giữa Các Loại Gốc Axit
Gốc axit có thể được phân loại thành gốc axit mạnh và gốc axit yếu dựa trên khả năng phân ly của axit tương ứng trong dung dịch nước. Sự khác biệt này ảnh hưởng đến tính chất hóa học và ứng dụng của chúng.
6.1. Gốc Axit Mạnh
- Định nghĩa: Gốc axit mạnh là gốc của các axit mạnh, có khả năng phân ly hoàn toàn trong dung dịch nước, tạo ra nồng độ ion H+ cao.
- Ví dụ: Clorua (Cl-), nitrat (NO3-), sunfat (SO42-), perclorat (ClO4-), bromua (Br-), iodua (I-).
- Tính chất: Các axit mạnh có khả năng ăn mòn cao, phản ứng mạnh mẽ với kim loại, bazơ và các chất khác.
- Ứng dụng: Được sử dụng rộng rãi trong công nghiệp để sản xuất hóa chất, xử lý kim loại, và làm chất xúc tác trong các phản ứng hóa học.
6.2. Gốc Axit Yếu
- Định nghĩa: Gốc axit yếu là gốc của các axit yếu, chỉ phân ly một phần trong dung dịch nước, tạo ra nồng độ ion H+ thấp.
- Ví dụ: Florua (F-), axetat (CH3COO-), cacbonat (CO32-), photphat (PO43-), sunfit (SO32-), xianua (CN-).
- Tính chất: Các axit yếu có khả năng ăn mòn thấp hơn so với axit mạnh, phản ứng chậm hơn và thường được sử dụng trong các ứng dụng cần độ kiểm soát cao.
- Ứng dụng: Được sử dụng trong sản xuất thực phẩm, dược phẩm, và trong các ứng dụng hóa học cần độ an toàn cao.
6.3. Bảng So Sánh Gốc Axit Mạnh và Gốc Axit Yếu
| Đặc Điểm | Gốc Axit Mạnh | Gốc Axit Yếu |
|---|---|---|
| Khả năng phân ly | Phân ly hoàn toàn trong dung dịch nước | Chỉ phân ly một phần trong dung dịch nước |
| Nồng độ ion H+ | Cao | Thấp |
| Tính ăn mòn | Cao | Thấp |
| Tốc độ phản ứng | Nhanh | Chậm |
| Ví dụ | Cl-, NO3-, SO42-, ClO4-, Br-, I- | F-, CH3COO-, CO32-, PO43-, SO32-, CN- |
| Ứng dụng | Sản xuất hóa chất, xử lý kim loại, chất xúc tác | Sản xuất thực phẩm, dược phẩm, ứng dụng an toàn |
Hình ảnh minh họa so sánh khả năng phân ly của axit mạnh và axit yếu
Tại Xe Tải Mỹ Đình, chúng tôi hy vọng rằng sự so sánh này sẽ giúp bạn hiểu rõ hơn về sự khác biệt giữa gốc axit mạnh và gốc axit yếu, từ đó có thể lựa chọn và sử dụng chúng một cách hiệu quả trong các ứng dụng khác nhau.
7. Cách Nhận Biết Gốc Axit: Phương Pháp Nhận Biết Gốc Axit Trong Hóa Học
Việc nhận biết gốc axit là một kỹ năng quan trọng trong hóa học, giúp xác định thành phần và tính chất của các hợp chất. Có nhiều phương pháp khác nhau để nhận biết gốc axit, từ các phản ứng đơn giản đến các kỹ thuật phân tích phức tạp.
7.1. Nhận Biết Gốc Clorua (Cl-)
- Thuốc thử: Dung dịch bạc nitrat (AgNO3).
- Phản ứng: Khi thêm dung dịch bạc nitrat vào dung dịch chứa gốc clorua, sẽ tạo ra kết tủa trắng bạc clorua (AgCl) không tan trong axit nitric (HNO3).
- Phương trình: Ag+ (aq) + Cl- (aq) → AgCl (s)
7.2. Nhận Biết Gốc Sunfat (SO42-)
- Thuốc thử: Dung dịch bari clorua (BaCl2).
- Phản ứng: Khi thêm dung dịch bari clorua vào dung dịch chứa gốc sunfat, sẽ tạo ra kết tủa trắng bari sunfat (BaSO4) không tan trong axit mạnh.
- Phương trình: Ba2+ (aq) + SO42- (aq) → BaSO4 (s)
7.3. Nhận Biết Gốc Photphat (PO43-)
- Thuốc thử: Dung dịch amoni molipdat ((NH4)2MoO4) trong axit nitric (HNO3).
- Phản ứng: Khi đun nóng dung dịch chứa gốc photphat với dung dịch amoni molipdat trong axit nitric, sẽ tạo ra kết tủa vàng amoni photphomolipdat ((NH4)3[P(Mo3O10)4]).
- Phương trình: PO43- + 12MoO42- + 3NH4+ + 24H+ → (NH4)3[P(Mo3O10)4] + 12H2O
7.4. Nhận Biết Gốc Cacbonat (CO32-)
- Thuốc thử: Axit clohidric (HCl) hoặc axit sulfuric (H2SO4).
- Phản ứng: Khi thêm axit vào dung dịch chứa gốc cacbonat, sẽ tạo ra khí cacbon đioxit (CO2) không màu, không mùi, làm đục nước vôi trong.
- Phương trình: CO32- (aq) + 2H+ (aq) → H2O (l) + CO2 (g)
- CO2 (g) + Ca(OH)2 (aq) → CaCO3 (s) + H2O (l)
7.5. Nhận Biết Gốc Nitrat (NO3-)
- Thuốc thử: Phản ứng với đồng (Cu) và axit sulfuric đặc (H2SO4).
- Phản ứng: Khi đun nóng dung dịch chứa gốc nitrat với đồng và axit sulfuric đặc, sẽ tạo ra khí nitơ đioxit (NO2) màu nâu đỏ.
- Phương trình: 2NO3- + Cu + 4H+ → Cu2+ + 2NO2 + 2H2O
7.6. Bảng Tóm Tắt Các Phương Pháp Nhận Biết Gốc Axit
| Gốc Axit | Thuốc Thử | Hiện Tượng | Phương Trình Phản Ứng |
|---|---|---|---|
| Cl- | AgNO3 | Kết tủa trắng AgCl không tan trong HNO3 | Ag+ (aq) + Cl- (aq) → AgCl (s) |
| SO42- | BaCl2 | Kết tủa trắng BaSO4 không tan trong axit mạnh | Ba2+ (aq) + SO42- (aq) → BaSO4 (s) |
| PO43- | (NH4)2MoO4, HNO3 | Kết tủa vàng (NH4)3[P(Mo3O10)4] | PO43- + 12MoO42- + 3NH4+ + 24H+ → (NH4)3[P(Mo3O10)4] + 12H2O |
| CO32- | HCl hoặc H2SO4 | Khí CO2 làm đục nước vôi trong | CO32- (aq) + 2H+ (aq) → H2O (l) + CO2 (g); CO2 (g) + Ca(OH)2 (aq) → CaCO3 (s) + H2O (l) |
| NO3- | Cu, H2SO4 đặc | Khí NO2 màu nâu đỏ | 2NO3- + Cu + 4H+ → Cu2+ + 2NO2 + 2H2O |
Hình ảnh minh họa phản ứng nhận biết gốc clorua bằng dung dịch bạc nitrat
Tại Xe Tải Mỹ Đình, chúng tôi hi vọng rằng các phương pháp nhận biết gốc axit này sẽ giúp bạn tự tin hơn trong việc thực hiện các thí nghiệm hóa học và phân tích các hợp chất.
8. Ảnh Hưởng Của Gốc Axit Đến Môi Trường: Tác Động Của Gốc Axit Đến Hệ Sinh Thái
Gốc axit có thể gây ra những tác động tiêu cực đến môi trường, ảnh hưởng đến hệ sinh thái và sức khỏe con người. Việc hiểu rõ về những ảnh hưởng này giúp chúng ta có những biện pháp bảo vệ môi trường hiệu quả hơn.
8.1. Ô Nhiễm Nước
- Axit hóa nguồn nước: Các gốc axit như sunfat (SO42-) và nitrat (NO3-) có thể gây ra hiện tượng axit hóa nguồn nước, làm giảm độ pH của nước, ảnh hưởng đến đời sống của các sinh vật thủy sinh.
- Phú dưỡng: Gốc photphat (PO43-) có thể gây ra tình trạng phú dưỡng, làm tăng sự phát triển của tảo và các loại thực vật thủy sinh khác, gây thiếu oxy trong nước và ảnh hưởng đến các loài động vật thủy sinh.
- Ô nhiễm kim loại nặng: Axit có thể hòa tan các kim loại nặng từ đất và đá, làm ô nhiễm nguồn nước và gây hại cho sức khỏe con người khi sử dụng nước bị ô nhiễm.
8.2. Ô Nhiễm Đất
- Axit hóa đất: Các gốc axit có thể gây ra hiện tượng axit hóa đất, làm giảm độ pH của đất, ảnh hưởng đến khả năng hấp thụ dinh dưỡng của cây trồng và gây suy thoái đất.
- Ô nhiễm kim loại nặng: Axit có thể hòa tan các kim