Electron không bị hút vào hạt nhân nguyên tử vì chúng tồn tại ở trạng thái năng lượng xác định và tuân theo nguyên lý bất định Heisenberg. Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN) sẽ giúp bạn khám phá sâu hơn về vấn đề này. Điều này liên quan đến cơ học lượng tử, đám mây electron, và thế năng tương tác giữa các hạt.
1. Hiểu Rõ Về Cấu Tạo và Hoạt Động Của Nguyên Tử
1.1 Mô Hình Cũ và Những Hạn Chế Cần Khắc Phục
Trước đây, chúng ta thường được dạy rằng electron quay quanh hạt nhân giống như các hành tinh quay quanh Mặt Trời. Tuy nhiên, mô hình này đã lỗi thời và không còn phù hợp với vật lý lượng tử hiện đại.
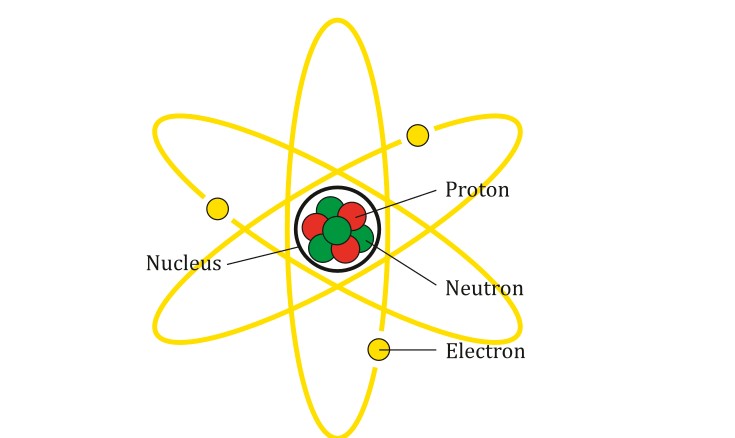 mô hình nguyên tử
mô hình nguyên tử
1.2 Mô Hình Lượng Tử Hiện Đại Về Nguyên Tử
Vào những năm 1920, nhà vật lý Niels Bohr đã cố gắng giải thích tại sao electron có thể quay quanh hạt nhân mà không mất năng lượng. Đến năm 1927, Werner Heisenberg đưa ra nguyên lý bất định, mở ra một cách hiểu mới về nguyên tử. Theo đó:
- Electron không còn được coi là hạt vật lý có vị trí và vận tốc xác định.
- Electron tồn tại dưới dạng đám mây xác suất, nghĩa là không thể biết chính xác vị trí và quỹ đạo của electron tại một thời điểm nhất định.
- Chỉ có thể tính toán xác suất tìm thấy electron ở một vị trí cụ thể trong một thời điểm nhất định.
1.3 Electron Vừa Là Hạt, Vừa Là Sóng
Electron hoạt động trong nguyên tử như một hệ khép kín, nơi năng lượng luôn được bảo toàn. Khi một hạt proton hình thành trong không gian, nó sẽ ngay lập tức hút một electron mang điện tích trái dấu từ môi trường bên ngoài. Electron này hoạt động như một đám mây bao quanh proton và được mô tả bằng hàm xác suất. Điều này có nghĩa là electron vừa là hạt, vừa là sóng. Từ khi nguyên tử hình thành, electron đã chuyển động xung quanh hạt nhân như một làn sóng và sóng thì không bao giờ dừng lại.
2. Tại Sao Electron Không Bị Hút Vào Hạt Nhân?
2.1 Tương Tác Điện Từ và Đám Mây Electron
Đám mây electron tương tác với proton thông qua lực điện từ trái dấu, bản chất của lực này là sự trao đổi liên tục các photon.
- Nếu khoảng cách giữa đám mây electron và hạt proton luôn không đổi, nguyên tử hoạt động ổn định.
- Khi nguyên tử nhận thêm một photon từ môi trường, khoảng cách giữa đám mây electron và proton sẽ tăng lên, thể tích của đám mây cũng tăng.
2.2 Động Năng và Thế Năng Trong Nguyên Tử
Khi thể tích của đám mây lớn hơn, động năng của electron giảm xuống, trong khi thế năng lại tăng lên. Đến khi mức năng lượng giảm xuống, đám mây trở lại thể tích ban đầu và một hạt photon sẽ bị bắn ra ngoài.
- Động năng chính là rào cản ngăn không cho electron bị hút vào hạt nhân.
- Khi thể tích đám mây tăng lên, thế năng của nguyên tử cũng tăng lên, giữ chân electron không bị bay ra ngoài.
Để dễ hình dung, hãy tưởng tượng một vận động viên cử tạ. Thế năng tăng lên khi khoảng cách giữa hai vật tăng lên. Khi nhấc tạ lên khỏi mặt đất, thế năng của nó bắt đầu tăng lên, đó là lý do tại sao việc nhấc tạ càng cao càng khó.
2.3 Các Trường Hợp Đặc Biệt
Tương tự, electron sẽ không bị hút vào hoặc bay ra khỏi hạt nhân trừ một số trường hợp đặc biệt. Ví dụ, khi một nguyên tử phân rã thành nguyên tử khác, electron có thể bị hút vào hạt nhân do hạt nhân bị dư thừa proton. Proton dư thừa này sẽ hút electron vào tạo thành hạt neutron. Khối lượng của hạt neutron lớn hơn tổng khối lượng của proton và electron cộng lại. Vì vậy, để quá trình này xảy ra, cần bù đắp thêm năng lượng và khối lượng cho nó.
2.4 Kết Luận Về Chuyển Động Của Electron
Như vậy, electron không quay quanh hạt nhân như các hành tinh quay quanh Mặt Trời, mà hoạt động giống như một đám mây xác suất. Khi thể tích đám mây càng lớn, xác suất tìm thấy một hạt càng nhỏ (nhưng không bao giờ bằng 0). Khi thể tích giảm xuống, xác suất tìm thấy một hạt càng cao (nhưng không bao giờ bằng 100%).
3. Các Yếu Tố Ảnh Hưởng Đến Vị Trí Của Electron
3.1 Năng Lượng Của Electron
Năng lượng của electron là một yếu tố quyết định vị trí của nó trong nguyên tử. Electron chỉ có thể tồn tại ở các mức năng lượng nhất định, gọi là các orbital. Mỗi orbital tương ứng với một vùng không gian xung quanh hạt nhân, nơi electron có khả năng được tìm thấy cao nhất.
3.2 Số Lượng Tử
Vị trí và trạng thái của electron được mô tả bằng các số lượng tử, bao gồm:
- Số lượng tử chính (n): Xác định mức năng lượng của electron (n = 1, 2, 3,…).
- Số lượng tử góc (l): Xác định hình dạng của orbital (l = 0, 1, 2,…, n-1).
- Số lượng tử từ (ml): Xác định hướng của orbital trong không gian (ml = -l, -l+1,…, 0,…, l-1, l).
- Số lượng tử spin (ms): Mô tả moment động lượng spin của electron (ms = +1/2 hoặc -1/2).
3.3 Nguyên Lý Loại Trừ Pauli
Nguyên lý loại trừ Pauli nói rằng không có hai electron nào trong cùng một nguyên tử có thể có cùng một bộ bốn số lượng tử. Điều này có nghĩa là mỗi orbital chỉ có thể chứa tối đa hai electron, và chúng phải có spin ngược nhau.
4. Ứng Dụng Thực Tế Của Hiểu Biết Về Nguyên Tử
4.1 Trong Công Nghệ
Hiểu biết về cấu trúc nguyên tử và cách electron hoạt động có nhiều ứng dụng quan trọng trong công nghệ, ví dụ:
- Điện tử: Thiết kế và chế tạo các linh kiện điện tử như transistor, vi mạch, dựa trên sự kiểm soát dòng electron trong vật liệu bán dẫn.
- Vật liệu: Phát triển các vật liệu mới với các tính chất đặc biệt bằng cách điều chỉnh cấu trúc nguyên tử và tương tác giữa các electron.
- Năng lượng: Nghiên cứu và phát triển các nguồn năng lượng mới như pin mặt trời, pin nhiên liệu, dựa trên các quá trình trao đổi electron trong các phản ứng hóa học.
4.2 Trong Y Học
Trong y học, kiến thức về nguyên tử và electron được ứng dụng trong:
- Chẩn đoán hình ảnh: Sử dụng các kỹ thuật như chụp X-quang, chụp cắt lớp vi tính (CT), chụp cộng hưởng từ (MRI) để tạo ra hình ảnh về cấu trúc bên trong cơ thể dựa trên sự tương tác của electron với các hạt và trường khác nhau.
- Điều trị ung thư: Sử dụng xạ trị để tiêu diệt tế bào ung thư bằng cách phá hủy DNA của chúng thông qua tương tác với electron.
4.3 Trong Các Lĩnh Vực Khác
Ngoài ra, hiểu biết về nguyên tử và electron còn có ứng dụng trong nhiều lĩnh vực khác như:
- Hóa học: Nghiên cứu và tổng hợp các hợp chất hóa học mới.
- Vật lý: Nghiên cứu các hiện tượng vật lý ở cấp độ nguyên tử và hạ nguyên tử.
- Khoa học vật liệu: Phát triển các vật liệu mới với các tính chất đặc biệt.
5. Ý Định Tìm Kiếm Liên Quan Đến Từ Khóa Chính
Để hiểu rõ hơn về những gì người dùng quan tâm khi tìm kiếm về “Tại Sao Electron Không Bị Hút Vào Hạt Nhân”, chúng ta có thể xác định một số ý định tìm kiếm chính sau:
- Giải thích đơn giản: Người dùng muốn một lời giải thích dễ hiểu, không quá phức tạp về mặt kỹ thuật, dành cho người không chuyên.
- Cơ chế hoạt động: Người dùng muốn hiểu rõ cơ chế vật lý và hóa học đằng sau hiện tượng này, bao gồm các lực tác động và các yếu tố ảnh hưởng.
- Ứng dụng thực tế: Người dùng muốn biết kiến thức này có ứng dụng gì trong thực tế, ví dụ như trong công nghệ, y học, hay các lĩnh vực khác.
- So sánh với mô hình cũ: Người dùng muốn so sánh mô hình hiện đại với mô hình cổ điển (electron quay quanh hạt nhân như hành tinh) để hiểu rõ hơn sự khác biệt.
- Các yếu tố ảnh hưởng: Người dùng muốn biết những yếu tố nào ảnh hưởng đến vị trí và trạng thái của electron trong nguyên tử.
6. FAQ – Các Câu Hỏi Thường Gặp Về Electron Và Hạt Nhân
6.1 Electron có rơi vào hạt nhân không?
Không, electron không rơi vào hạt nhân do tuân theo các định luật của cơ học lượng tử, đặc biệt là nguyên lý bất định Heisenberg và sự tồn tại của các mức năng lượng lượng tử hóa.
6.2 Điều gì xảy ra nếu electron rơi vào hạt nhân?
Nếu electron rơi vào hạt nhân, nguyên tử sẽ không ổn định và vật chất sẽ không tồn tại như chúng ta biết.
6.3 Electron di chuyển như thế nào xung quanh hạt nhân?
Electron không di chuyển theo quỹ đạo cố định mà tồn tại dưới dạng đám mây xác suất, biểu thị khả năng tìm thấy electron ở một vị trí nhất định xung quanh hạt nhân.
6.4 Tại sao electron không mất năng lượng khi di chuyển xung quanh hạt nhân?
Theo cơ học lượng tử, electron chỉ có thể tồn tại ở các mức năng lượng nhất định và không bức xạ năng lượng khi ở trong các trạng thái dừng này.
6.5 Lực nào giữ electron xung quanh hạt nhân?
Lực điện từ (lực hút giữa điện tích âm của electron và điện tích dương của hạt nhân) giữ electron xung quanh hạt nhân.
6.6 Thế nào là orbital nguyên tử?
Orbital nguyên tử là một hàm toán học mô tả hành vi giống như sóng của một electron trong một nguyên tử. Hàm này có thể được sử dụng để tính toán xác suất tìm thấy bất kỳ electron cụ thể nào của nguyên tử ở bất kỳ vùng cụ thể nào xung quanh hạt nhân của nguyên tử.
6.7 Các số lượng tử ảnh hưởng đến vị trí của electron như thế nào?
Các số lượng tử (n, l, ml, ms) xác định mức năng lượng, hình dạng, hướng và spin của electron, từ đó xác định vị trí và trạng thái của electron trong nguyên tử.
6.8 Nguyên lý loại trừ Pauli là gì?
Nguyên lý loại trừ Pauli nói rằng không có hai electron nào trong cùng một nguyên tử có thể có cùng một bộ bốn số lượng tử.
6.9 Ứng dụng của việc hiểu về cấu trúc nguyên tử là gì?
Hiểu về cấu trúc nguyên tử có nhiều ứng dụng trong công nghệ, y học, hóa học, vật lý và khoa học vật liệu.
6.10 Tại sao electron vừa là hạt vừa là sóng?
Theo lý thuyết lưỡng tính sóng hạt, các hạt vi mô như electron có thể thể hiện cả tính chất sóng và tính chất hạt tùy thuộc vào cách chúng ta quan sát và đo lường.
7. Xe Tải Mỹ Đình – Nơi Cung Cấp Thông Tin Chi Tiết Về Xe Tải
Tại Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN), chúng tôi không chỉ cung cấp thông tin về xe tải mà còn mong muốn mang đến những kiến thức khoa học hữu ích và thú vị cho cộng đồng. Giống như cách electron vận hành trong nguyên tử, chúng tôi luôn nỗ lực để mang đến những thông tin chính xác và đáng tin cậy nhất cho khách hàng.
7.1 Dịch Vụ Tư Vấn Chuyên Nghiệp
Nếu bạn đang tìm kiếm một chiếc xe tải phù hợp với nhu cầu của mình, đừng ngần ngại liên hệ với chúng tôi. Đội ngũ chuyên gia của Xe Tải Mỹ Đình sẽ tư vấn và giúp bạn lựa chọn chiếc xe tải ưng ý nhất.
7.2 Thông Tin Chi Tiết và Cập Nhật
Chúng tôi cung cấp thông tin chi tiết và cập nhật về các loại xe tải có sẵn ở Mỹ Đình, Hà Nội. Bạn có thể dễ dàng so sánh giá cả và thông số kỹ thuật giữa các dòng xe khác nhau.
7.3 Giải Đáp Thắc Mắc
Chúng tôi sẵn sàng giải đáp mọi thắc mắc của bạn liên quan đến thủ tục mua bán, đăng ký và bảo dưỡng xe tải.
Liên hệ ngay với Xe Tải Mỹ Đình để được tư vấn và giải đáp mọi thắc mắc:
- Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội.
- Hotline: 0247 309 9988
- Trang web: XETAIMYDINH.EDU.VN
Hãy đến với Xe Tải Mỹ Đình để trải nghiệm dịch vụ chuyên nghiệp và tận tâm nhất!