Số Oxi Hoá Của Fes2 là một khái niệm quan trọng trong hóa học, đặc biệt khi nghiên cứu về khoáng vật pyrite và các phản ứng liên quan đến nó. Xe Tải Mỹ Đình sẽ cung cấp thông tin chi tiết về số oxi hoá của FeS2, giúp bạn hiểu rõ hơn về cấu trúc và tính chất hóa học của hợp chất này. Khám phá ngay về pyrite, số oxi hóa sắt, và số oxi hóa lưu huỳnh.
1. Số Oxi Hoá Của FeS2 Là Gì?
Số oxi hoá của Fe (sắt) trong FeS2 là +2 và của S (lưu huỳnh) là -1. Điều này có nghĩa là mỗi nguyên tử sắt mất 2 electron, trong khi mỗi nguyên tử lưu huỳnh nhận 1 electron.
Để hiểu rõ hơn, chúng ta sẽ đi sâu vào cấu trúc và cách xác định số oxi hoá của từng nguyên tố trong hợp chất này.
1.1. Định Nghĩa Số Oxi Hoá
Số oxi hoá là điện tích giả định của một nguyên tử trong một hợp chất nếu tất cả các liên kết là ion. Đây là một công cụ hữu ích để theo dõi sự chuyển dịch electron trong các phản ứng hóa học.
1.2. Quy Tắc Xác Định Số Oxi Hoá
Để xác định số oxi hoá, chúng ta tuân theo các quy tắc sau:
- Số oxi hoá của một nguyên tố tự do là 0 (ví dụ: Fe, S).
- Số oxi hoá của một ion đơn nguyên tử bằng điện tích của ion đó (ví dụ: Na+ có số oxi hoá +1, Cl- có số oxi hoá -1).
- Số oxi hoá của oxygen thường là -2 (trừ trong các peroxid như H2O2, số oxi hoá là -1).
- Số oxi hoá của hydrogen thường là +1 (trừ trong các hydrua kim loại như NaH, số oxi hoá là -1).
- Tổng số oxi hoá của tất cả các nguyên tử trong một phân tử hoặc ion đa nguyên tử bằng điện tích của phân tử hoặc ion đó.
2. Xác Định Số Oxi Hoá Trong FeS2
Áp dụng các quy tắc trên, ta có thể xác định số oxi hoá của Fe và S trong FeS2 như sau:
- FeS2 là một hợp chất trung hòa: Tổng số oxi hoá của tất cả các nguyên tử trong FeS2 phải bằng 0.
- Giả sử số oxi hoá của Fe là x và của S là y: Ta có phương trình: x + 2y = 0
Để giải phương trình này, chúng ta cần thêm thông tin về cấu trúc của FeS2.
2.1. Cấu Trúc Của FeS2
FeS2 có cấu trúc đặc biệt, trong đó hai nguyên tử lưu huỳnh liên kết với nhau tạo thành ion disulfua (S2)2-. Ion disulfua này có điện tích -2, và để cân bằng điện tích, sắt phải có điện tích +2.
2.2. Tính Toán Số Oxi Hoá
- Vì Fe có điện tích +2, số oxi hoá của Fe là +2.
- Vì ion disulfua (S2) có điện tích -2, mỗi nguyên tử S có điện tích -1. Vậy số oxi hoá của S là -1.
Vậy, số oxi hoá của Fe trong FeS2 là +2 và của S là -1.
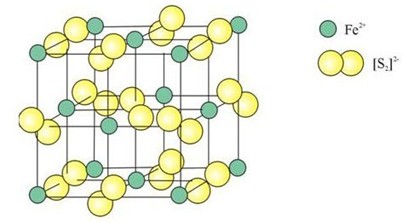 Cấu trúc tinh thể của Pyrite (FeS2) cho thấy các ion sắt và disulfua
Cấu trúc tinh thể của Pyrite (FeS2) cho thấy các ion sắt và disulfua
3. Tại Sao Lưu Huỳnh Trong FeS2 Có Số Oxi Hoá -1?
Lưu huỳnh thường có số oxi hoá -2 khi liên kết với các kim loại, nhưng trong FeS2, nó có số oxi hoá -1 do sự hình thành ion disulfua (S2)2-.
3.1. Liên Kết Cộng Hoá Trị Trong Ion Disulfua
Trong ion disulfua, hai nguyên tử lưu huỳnh liên kết với nhau bằng một liên kết cộng hoá trị. Mỗi nguyên tử lưu huỳnh đóng góp một electron để tạo thành liên kết này. Do đó, mỗi nguyên tử lưu huỳnh chỉ cần nhận thêm một electron để đạt cấu hình electron bền vững.
3.2. Sự Chia Sẻ Electron
Khi lưu huỳnh liên kết với sắt, nó chỉ nhận một electron từ sắt và chia sẻ electron còn lại với nguyên tử lưu huỳnh khác trong ion disulfua. Điều này dẫn đến số oxi hoá -1 cho mỗi nguyên tử lưu huỳnh.
4. Ứng Dụng Của FeS2
FeS2, còn gọi là pyrite hoặc “vàng của kẻ ngốc”, có nhiều ứng dụng quan trọng trong công nghiệp và khoa học.
4.1. Sản Xuất Axit Sunfuric (H2SO4)
FeS2 được sử dụng rộng rãi trong sản xuất axit sunfuric, một hóa chất quan trọng được sử dụng trong nhiều ngành công nghiệp khác nhau.
Quy trình:
- Đốt FeS2: FeS2 được đốt trong không khí để tạo ra khí sulfur dioxide (SO2).
4 FeS2(r) + 11 O2(k) → 2 Fe2O3(r) + 8 SO2(k) - Oxi hóa SO2 thành SO3: SO2 được oxi hóa tiếp thành sulfur trioxide (SO3) bằng xúc tác vanadium(V) oxit (V2O5).
2 SO2(k) + O2(k) → 2 SO3(k) - Hấp thụ SO3 vào H2SO4: SO3 được hấp thụ vào axit sunfuric đậm đặc để tạo ra oleum (H2S2O7), sau đó oleum được pha loãng với nước để tạo ra axit sunfuric.
SO3(k) + H2SO4(l) → H2S2O7(l) H2S2O7(l) + H2O(l) → 2 H2SO4(l)
4.2. Sản Xuất Giấy
Axit sunfuric được sử dụng trong quá trình sản xuất giấy để tẩy trắng bột giấy và loại bỏ các tạp chất.
4.3. Sản Xuất Phân Bón
Axit sunfuric là một thành phần quan trọng trong sản xuất phân bón, đặc biệt là phân superphosphate.
4.4. Trong Công Nghiệp Khai Khoáng
FeS2 có thể được sử dụng để thu hồi kim loại quý như vàng và bạc. Trong quá trình này, FeS2 được oxi hóa để giải phóng các kim loại quý bị mắc kẹt trong cấu trúc của nó.
4.5. Vật Liệu Bán Dẫn
FeS2 cũng có tiềm năng được sử dụng làm vật liệu bán dẫn trong các thiết bị điện tử. Nghiên cứu đã chỉ ra rằng FeS2 có thể được sử dụng trong các tế bào quang điện và các ứng dụng điện tử khác.
5. Tính Chất Vật Lý Của FeS2
FeS2 có một số tính chất vật lý đặc trưng:
- Màu sắc: Vàng đồng hoặc vàng thau, đôi khi có ánh kim.
- Độ cứng: 6-6.5 trên thang Mohs.
- Tỷ trọng: 4.95 – 5.10 g/cm³.
- Ánh: Kim loại.
- Vết vạch: Đen hoặc xanh đen.
- Hình dạng tinh thể: Thường gặp ở dạng khối, hạt, hoặc tinh thể lập phương.
6. Phản Ứng Hóa Học Của FeS2
FeS2 tham gia vào nhiều phản ứng hóa học quan trọng.
6.1. Phản Ứng Oxi Hoá
Khi nung nóng trong không khí, FeS2 bị oxi hóa tạo thành oxit sắt(III) và khí sulfur dioxide.
4 FeS2(r) + 11 O2(k) → 2 Fe2O3(r) + 8 SO2(k)6.2. Phản Ứng Với Axit
FeS2 có thể phản ứng với axit mạnh để tạo ra khí hydrogen sulfide (H2S).
FeS2(r) + 2 HCl(aq) → FeCl2(aq) + H2S(k) + S(r)6.3. Phản Ứng Với Chất Oxi Hoá Mạnh
FeS2 có thể phản ứng với các chất oxi hoá mạnh như axit nitric (HNO3) để tạo ra các sản phẩm oxi hoá cao hơn.
FeS2 + 8 HNO3 → Fe(NO3)3 + 2 H2SO4 + 5 NO7. So Sánh FeS2 Với Các Hợp Chất Khác Của Sắt Và Lưu Huỳnh
Để hiểu rõ hơn về FeS2, chúng ta có thể so sánh nó với các hợp chất khác của sắt và lưu huỳnh.
| Hợp chất | Số oxi hoá của Fe | Số oxi hoá của S | Ứng dụng |
|---|---|---|---|
| FeS2 (Pyrite) | +2 | -1 | Sản xuất H2SO4, khai khoáng |
| FeS (Troilite) | +2 | -2 | Nghiên cứu địa chất |
| Fe2O3 (Hematite) | +3 | -2 (của O) | Sản xuất gang thép |
| H2S (Hydrogen sulfide) | +1 (của H) | -2 | Sản xuất hóa chất, xử lý nước thải |
| SO2 (Sulfur dioxide) | +4 (của S) | -2 (của O) | Chất khử trùng, bảo quản thực phẩm |
| SO3 (Sulfur trioxide) | +6 (của S) | -2 (của O) | Sản xuất axit sunfuric |
| FeSO4 (Iron(II) sulfate) | +2 | +6 (của S trong SO4) | Xử lý nước, thuốc trừ sâu |
8. Ảnh Hưởng Của Số Oxi Hoá Đến Tính Chất Hóa Học
Số oxi hoá của các nguyên tố trong một hợp chất ảnh hưởng lớn đến tính chất hóa học của hợp chất đó.
8.1. Tính Chất Oxi Hoá – Khử
Số oxi hoá cho biết khả năng của một nguyên tử tham gia vào các phản ứng oxi hoá – khử. Các nguyên tử có số oxi hoá thấp có xu hướng bị oxi hoá (mất electron), trong khi các nguyên tử có số oxi hoá cao có xu hướng bị khử (nhận electron).
8.2. Độ Bền Của Hợp Chất
Số oxi hoá cũng ảnh hưởng đến độ bền của hợp chất. Các hợp chất với số oxi hoá phù hợp thường bền hơn so với các hợp chất có số oxi hoá không phù hợp.
8.3. Khả Năng Tạo Phức
Số oxi hoá ảnh hưởng đến khả năng của một ion kim loại tạo phức với các phối tử. Các ion kim loại có số oxi hoá cao thường có khả năng tạo phức mạnh hơn.
9. Tại Sao Nên Tìm Hiểu Về Số Oxi Hoá Của FeS2?
Việc hiểu rõ về số oxi hoá của FeS2 không chỉ quan trọng trong hóa học mà còn có nhiều ứng dụng thực tiễn.
9.1. Ứng Dụng Trong Khoa Học Vật Liệu
Hiểu biết về cấu trúc và tính chất của FeS2 giúp các nhà khoa học vật liệu phát triển các vật liệu mới với các tính chất đặc biệt.
9.2. Ứng Dụng Trong Công Nghiệp
FeS2 là một nguồn nguyên liệu quan trọng cho sản xuất axit sunfuric và các hóa chất khác. Việc hiểu rõ về các phản ứng của FeS2 giúp tối ưu hóa quy trình sản xuất.
9.3. Ứng Dụng Trong Bảo Vệ Môi Trường
FeS2 có thể gây ra các vấn đề môi trường như ô nhiễm axit mỏ. Việc hiểu rõ về các phản ứng của FeS2 giúp phát triển các phương pháp xử lý và ngăn ngừa ô nhiễm.
10. Các Câu Hỏi Thường Gặp Về Số Oxi Hoá Của FeS2 (FAQ)
10.1. Số oxi hoá của Fe trong FeS2 là bao nhiêu?
Số oxi hoá của Fe trong FeS2 là +2.
10.2. Số oxi hoá của S trong FeS2 là bao nhiêu?
Số oxi hoá của S trong FeS2 là -1.
10.3. Tại sao S trong FeS2 có số oxi hoá -1 mà không phải -2?
Do sự hình thành ion disulfua (S2)2-, trong đó hai nguyên tử S liên kết với nhau bằng liên kết cộng hoá trị, mỗi nguyên tử S chỉ cần nhận thêm 1 electron để đạt cấu hình bền.
10.4. FeS2 có những ứng dụng gì?
FeS2 được sử dụng trong sản xuất axit sunfuric, sản xuất giấy, sản xuất phân bón, công nghiệp khai khoáng và làm vật liệu bán dẫn.
10.5. FeS2 có độc hại không?
FeS2 không độc hại, nhưng các sản phẩm phản ứng của nó như SO2 và H2S có thể gây hại cho sức khỏe và môi trường.
10.6. Làm thế nào để phân biệt FeS2 với vàng thật?
FeS2 có màu vàng đồng hoặc vàng thau, nhưng nó cứng hơn vàng thật và có vết vạch màu đen hoặc xanh đen. Vàng thật mềm hơn và có vết vạch màu vàng.
10.7. FeS2 có tan trong nước không?
FeS2 không tan trong nước.
10.8. Phản ứng của FeS2 với axit clohydric (HCl) tạo ra sản phẩm gì?
Phản ứng của FeS2 với HCl tạo ra FeCl2, H2S và S.
10.9. FeS2 có vai trò gì trong tự nhiên?
FeS2 là một khoáng vật phổ biến trong tự nhiên, có mặt trong nhiều loại đá và quặng. Nó cũng đóng vai trò quan trọng trong các chu trình địa hóa.
10.10. Làm thế nào để bảo quản FeS2?
FeS2 nên được bảo quản ở nơi khô ráo, thoáng mát, tránh tiếp xúc với axit và các chất oxi hoá mạnh.
Kết Luận
Hiểu rõ về số oxi hoá của FeS2 là rất quan trọng để nắm bắt tính chất và ứng dụng của hợp chất này. Hy vọng bài viết này của Xe Tải Mỹ Đình đã cung cấp cho bạn những thông tin hữu ích và chi tiết nhất.
Nếu bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải ở Mỹ Đình, đừng ngần ngại truy cập XETAIMYDINH.EDU.VN. Chúng tôi cung cấp thông tin cập nhật về các loại xe tải, so sánh giá cả, tư vấn lựa chọn xe phù hợp, và giải đáp mọi thắc mắc của bạn. Hãy liên hệ với chúng tôi ngay hôm nay để được tư vấn miễn phí!
Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội
Hotline: 0247 309 9988
Trang web: XETAIMYDINH.EDU.VN
