Sơ đồ Tư Duy Axit Bazơ Muối là công cụ hữu ích giúp bạn hệ thống hóa kiến thức hóa học một cách trực quan và dễ hiểu, đồng thời nó giúp bạn nắm vững các khái niệm, tính chất và mối quan hệ giữa axit, bazơ và muối. Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN) sẽ cung cấp cho bạn những thông tin chi tiết về sơ đồ tư duy axit bazơ muối, từ đó bạn có thể tự tin chinh phục môn Hóa học. Chúng tôi cam kết mang đến cho bạn kiến thức toàn diện, chính xác và dễ áp dụng, giúp bạn vượt qua mọi thử thách trong học tập và công việc liên quan đến hóa học.
1. Định Nghĩa Sơ Đồ Tư Duy Axit Bazơ Muối Là Gì?
Sơ đồ tư duy axit bazơ muối là một công cụ trực quan hóa kiến thức, giúp hệ thống hóa các khái niệm, tính chất hóa học và mối quan hệ giữa axit, bazơ và muối một cách logic và dễ hiểu. Nó cho phép người học nắm bắt thông tin một cách nhanh chóng, ghi nhớ lâu hơn và áp dụng kiến thức vào giải quyết các bài tập, tình huống thực tế một cách hiệu quả. Theo nghiên cứu của Trường Đại học Sư phạm Hà Nội năm 2023, việc sử dụng sơ đồ tư duy giúp tăng khả năng ghi nhớ kiến thức lên đến 30% so với phương pháp học truyền thống.
1.1. Các Thành Phần Cơ Bản Của Sơ Đồ Tư Duy Axit Bazơ Muối
Một sơ đồ tư duy axit bazơ muối thường bao gồm các thành phần chính sau:
- Chủ đề trung tâm: Thường là “Axit – Bazơ – Muối” hoặc một chủ đề cụ thể hơn như “Phản ứng trung hòa”.
- Các nhánh chính: Đại diện cho các khái niệm lớn liên quan, ví dụ như “Axit”, “Bazơ”, “Muối”, “Tính chất hóa học”, “Ứng dụng”.
- Các nhánh phụ: Chi tiết hóa các nhánh chính, ví dụ, dưới nhánh “Axit” có thể có “Định nghĩa”, “Phân loại”, “Tên gọi”, “Tính chất hóa học đặc trưng”.
- Các từ khóa và hình ảnh: Sử dụng ngắn gọn, súc tích để gợi nhớ kiến thức.
- Màu sắc và biểu tượng: Giúp phân biệt các phần khác nhau của sơ đồ và tăng tính sinh động.
1.2. Lợi Ích Của Việc Sử Dụng Sơ Đồ Tư Duy Trong Hóa Học
Sử dụng sơ đồ tư duy axit bazơ muối mang lại nhiều lợi ích thiết thực:
- Hệ thống hóa kiến thức: Giúp người học sắp xếp thông tin một cách logic, dễ dàng nhìn thấy mối liên hệ giữa các khái niệm.
- Tăng khả năng ghi nhớ: Hình ảnh và màu sắc kích thích não bộ, giúp ghi nhớ kiến thức lâu hơn.
- Tiết kiệm thời gian học tập: Dễ dàng ôn tập và xem lại kiến thức một cách nhanh chóng.
- Phát triển tư duy: Rèn luyện khả năng phân tích, tổng hợp và liên kết thông tin.
- Ứng dụng thực tế: Giúp người học hiểu rõ bản chất của các phản ứng hóa học và ứng dụng chúng vào thực tế.
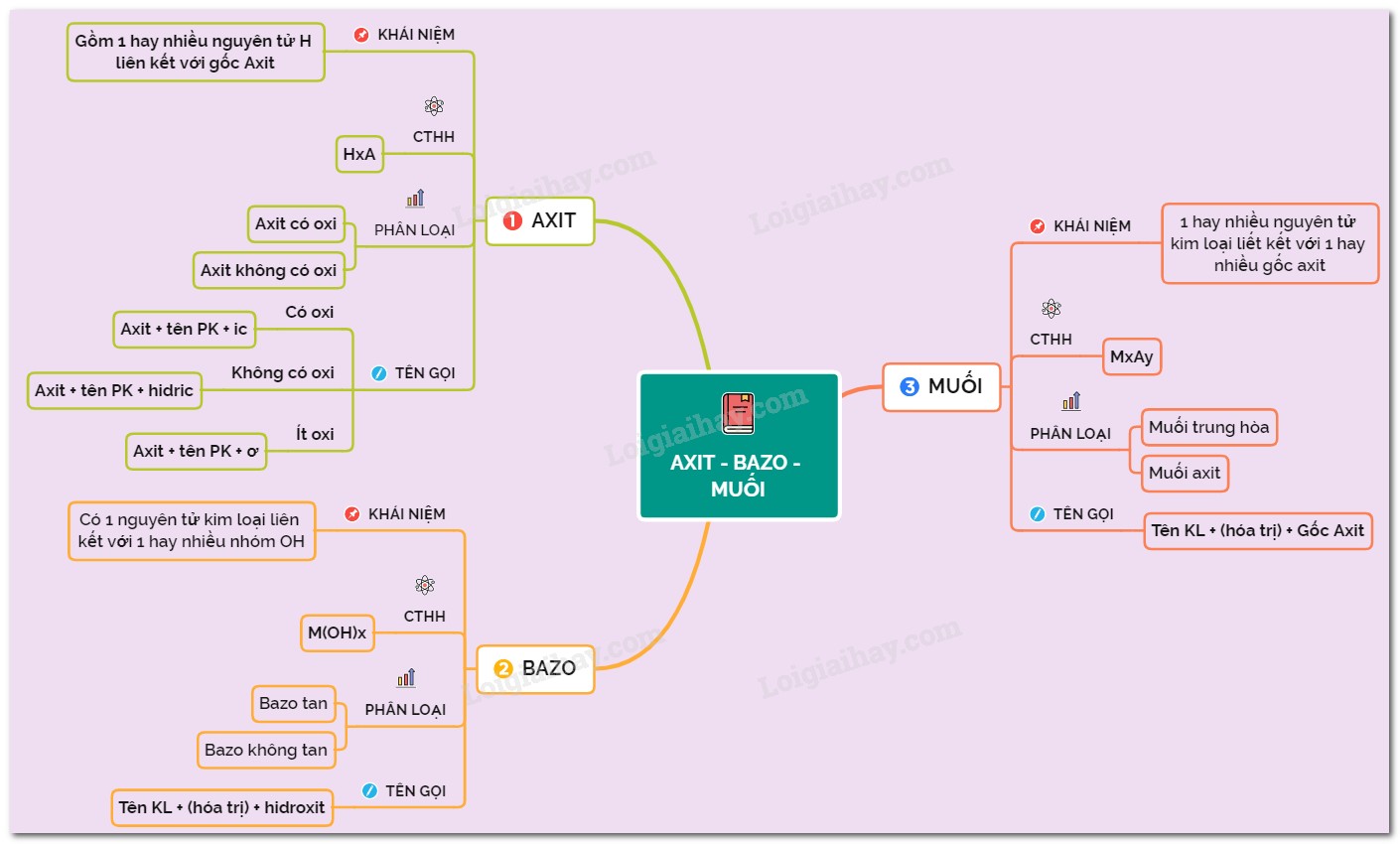 Sơ đồ tư duy Axit – Bazơ – Muối giúp bạn hệ thống kiến thức một cách logic
Sơ đồ tư duy Axit – Bazơ – Muối giúp bạn hệ thống kiến thức một cách logic
2. Axit: Khái Niệm, Phân Loại, Tính Chất Và Ứng Dụng
Axit là một trong những khái niệm cơ bản và quan trọng nhất trong hóa học. Để hiểu rõ về axit, chúng ta cần đi sâu vào định nghĩa, phân loại, tính chất hóa học đặc trưng và các ứng dụng thực tế của chúng.
2.1. Định Nghĩa Axit
Theo định nghĩa Arrhenius, axit là chất khi tan trong nước sẽ phân ly ra ion hydro (H⁺). Ví dụ, axit clohidric (HCl) khi tan trong nước sẽ tạo thành ion H⁺ và ion clorua (Cl⁻).
HCl → H⁺ + Cl⁻
Định nghĩa Bronsted-Lowry mở rộng hơn, coi axit là chất có khả năng nhường proton (H⁺) cho chất khác. Theo định nghĩa Lewis, axit là chất có khả năng nhận một cặp electron từ chất khác.
2.2. Phân Loại Axit
Axit được phân loại theo nhiều cách khác nhau, tùy thuộc vào tiêu chí sử dụng.
- Theo nguồn gốc:
- Axit vô cơ: HCl, H₂SO₄, HNO₃,…
- Axit hữu cơ: CH₃COOH, C₆H₅COOH,…
- Theo số lượng nguyên tử hydro có thể phân ly:
- Axit một nấc: HCl, HNO₃, CH₃COOH,…
- Axit nhiều nấc: H₂SO₄, H₃PO₄,…
- Theo độ mạnh:
- Axit mạnh: HCl, H₂SO₄, HNO₃,… (phân ly hoàn toàn trong nước)
- Axit yếu: CH₃COOH, H₂CO₃,… (phân ly không hoàn toàn trong nước)
- Theo sự có mặt của oxi:
- Axit có oxi: H₂SO₄, HNO₃, H₃PO₄,…
- Axit không có oxi: HCl, H₂S, HBr,…
2.3. Tính Chất Hóa Học Của Axit
Axit có những tính chất hóa học đặc trưng sau:
- Tác dụng với chất chỉ thị: Làm đổi màu chất chỉ thị (ví dụ, quỳ tím hóa đỏ).
- Tác dụng với kim loại đứng trước hydro trong dãy hoạt động hóa học: Tạo thành muối và giải phóng khí hydro.
- Ví dụ: Fe + 2HCl → FeCl₂ + H₂
- Tác dụng với oxit bazơ: Tạo thành muối và nước.
- Ví dụ: CuO + H₂SO₄ → CuSO₄ + H₂O
- Tác dụng với bazơ (phản ứng trung hòa): Tạo thành muối và nước.
- Ví dụ: NaOH + HCl → NaCl + H₂O
- Tác dụng với muối của axit yếu hơn: Tạo thành muối mới và axit mới.
- Ví dụ: CaCO₃ + 2HCl → CaCl₂ + H₂O + CO₂
2.4. Ứng Dụng Của Axit Trong Đời Sống Và Công Nghiệp
Axit có nhiều ứng dụng quan trọng trong đời sống và công nghiệp:
- Sản xuất phân bón: H₂SO₄, HNO₃ được sử dụng để sản xuất phân bón hóa học.
- Sản xuất chất tẩy rửa: HCl được sử dụng trong các chất tẩy rửa gia dụng và công nghiệp.
- Sản xuất thuốc: Nhiều axit được sử dụng trong sản xuất thuốc, ví dụ như axit acetylsalicylic (aspirin).
- Sản xuất nhựa và sợi tổng hợp: Axit được sử dụng làm chất xúc tác hoặc nguyên liệu trong quá trình sản xuất.
- Xử lý bề mặt kim loại: Axit được sử dụng để làm sạch và loại bỏ oxit trên bề mặt kim loại trước khi sơn hoặc mạ.
Hiểu rõ về axit giúp chúng ta áp dụng chúng một cách an toàn và hiệu quả trong nhiều lĩnh vực khác nhau. Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN) luôn sẵn sàng cung cấp thêm thông tin chi tiết và giải đáp mọi thắc mắc của bạn về axit.
3. Bazơ: Khái Niệm, Phân Loại, Tính Chất Và Ứng Dụng
Bazơ là một hợp chất hóa học quan trọng, đóng vai trò thiết yếu trong nhiều quá trình công nghiệp và sinh học. Để hiểu rõ về bazơ, chúng ta cần nắm vững khái niệm, phân loại, tính chất hóa học và các ứng dụng thực tế của chúng.
3.1. Định Nghĩa Bazơ
Theo định nghĩa Arrhenius, bazơ là chất khi tan trong nước sẽ phân ly ra ion hydroxit (OH⁻). Ví dụ, natri hydroxit (NaOH) khi tan trong nước sẽ tạo thành ion Na⁺ và ion OH⁻.
NaOH → Na⁺ + OH⁻
Định nghĩa Bronsted-Lowry mở rộng hơn, coi bazơ là chất có khả năng nhận proton (H⁺) từ chất khác. Theo định nghĩa Lewis, bazơ là chất có khả năng nhường một cặp electron cho chất khác.
3.2. Phân Loại Bazơ
Bazơ được phân loại theo nhiều cách khác nhau, tùy thuộc vào tiêu chí sử dụng.
- Theo độ tan trong nước:
- Bazơ tan (kiềm): NaOH, KOH, Ca(OH)₂, Ba(OH)₂,…
- Bazơ không tan: Cu(OH)₂, Fe(OH)₃, Mg(OH)₂,…
- Theo số lượng nhóm hydroxit (OH⁻) trong phân tử:
- Bazơ một nấc: NaOH, KOH,…
- Bazơ nhiều nấc: Ca(OH)₂, Fe(OH)₃,…
- Theo độ mạnh:
- Bazơ mạnh: NaOH, KOH, Ca(OH)₂, Ba(OH)₂,… (phân ly hoàn toàn trong nước)
- Bazơ yếu: NH₄OH, Fe(OH)₃,… (phân ly không hoàn toàn trong nước)
3.3. Tính Chất Hóa Học Của Bazơ
Bazơ có những tính chất hóa học đặc trưng sau:
- Tác dụng với chất chỉ thị: Làm đổi màu chất chỉ thị (ví dụ, quỳ tím hóa xanh, phenolphtalein hóa hồng).
- Tác dụng với axit (phản ứng trung hòa): Tạo thành muối và nước.
- Ví dụ: NaOH + HCl → NaCl + H₂O
- Tác dụng với oxit axit: Tạo thành muối.
- Ví dụ: 2NaOH + CO₂ → Na₂CO₃ + H₂O
- Tác dụng với muối: Tạo thành muối mới và bazơ mới (điều kiện: sản phẩm phải có chất kết tủa hoặc chất khí).
- Ví dụ: 2NaOH + CuCl₂ → Cu(OH)₂↓ + 2NaCl
- Một số bazơ lưỡng tính tác dụng với dung dịch bazơ mạnh:
- Ví dụ: Al(OH)₃ + NaOH → NaAlO₂ + 2H₂O
3.4. Ứng Dụng Của Bazơ Trong Đời Sống Và Công Nghiệp
Bazơ có nhiều ứng dụng quan trọng trong đời sống và công nghiệp:
- Sản xuất xà phòng: NaOH và KOH được sử dụng để sản xuất xà phòng.
- Sản xuất giấy: NaOH được sử dụng trong quá trình sản xuất giấy từ bột gỗ.
- Sản xuất thuốc: Nhiều bazơ được sử dụng trong sản xuất thuốc, ví dụ như magie hydroxit (Mg(OH)₂) trong thuốc trị đau dạ dày.
- Xử lý nước: Ca(OH)₂ được sử dụng để làm mềm nước cứng và trung hòa axit trong nước thải.
- Sản xuất hóa chất: Bazơ được sử dụng làm nguyên liệu để sản xuất nhiều hóa chất khác.
Hiểu rõ về bazơ giúp chúng ta sử dụng chúng một cách an toàn và hiệu quả trong nhiều lĩnh vực khác nhau. Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN) luôn sẵn sàng cung cấp thêm thông tin chi tiết và giải đáp mọi thắc mắc của bạn về bazơ.
4. Muối: Khái Niệm, Phân Loại, Tính Chất Và Ứng Dụng
Muối là một hợp chất hóa học phổ biến, được tạo thành từ phản ứng giữa axit và bazơ. Để hiểu rõ về muối, chúng ta cần nắm vững khái niệm, phân loại, tính chất hóa học và các ứng dụng thực tế của chúng.
4.1. Định Nghĩa Muối
Muối là hợp chất được tạo thành khi thay thế một hay nhiều ion H⁺ trong phân tử axit bằng một hay nhiều ion kim loại hoặc ion amoni (NH₄⁺). Ví dụ, natri clorua (NaCl) được tạo thành khi thay thế ion H⁺ trong axit clohidric (HCl) bằng ion Na⁺.
4.2. Phân Loại Muối
Muối được phân loại theo nhiều cách khác nhau, tùy thuộc vào tiêu chí sử dụng.
- Theo thành phần:
- Muối trung hòa: Là muối mà trong đó tất cả các ion H⁺ trong axit đã được thay thế bằng ion kim loại hoặc ion amoni. Ví dụ: NaCl, K₂SO₄, CaCO₃,…
- Muối axit: Là muối mà trong đó vẫn còn ion H⁺ trong gốc axit chưa được thay thế bằng ion kim loại hoặc ion amoni. Ví dụ: NaHCO₃, NaHSO₄,…
- Muối hỗn tạp: Là muối được tạo bởi hai hoặc nhiều cation hoặc anion khác nhau. Ví dụ: CaMg(CO₃)₂
- Theo khả năng tan trong nước:
- Muối tan: NaCl, KNO₃,…
- Muối không tan: CaCO₃, AgCl,…
4.3. Tính Chất Hóa Học Của Muối
Muối có những tính chất hóa học đặc trưng sau:
- Tác dụng với kim loại: Muối của kim loại kém hoạt động hơn có thể bị kim loại mạnh hơn đẩy ra khỏi dung dịch.
- Ví dụ: Fe + CuSO₄ → FeSO₄ + Cu
- Tác dụng với axit: Muối của axit yếu hơn có thể tác dụng với axit mạnh hơn để tạo thành muối mới và axit mới.
- Ví dụ: CaCO₃ + 2HCl → CaCl₂ + H₂O + CO₂
- Tác dụng với bazơ: Tạo thành muối mới và bazơ mới (điều kiện: sản phẩm phải có chất kết tủa hoặc chất khí).
- Ví dụ: CuCl₂ + 2NaOH → Cu(OH)₂↓ + 2NaCl
- Phản ứng trao đổi: Hai muối tác dụng với nhau tạo thành hai muối mới (điều kiện: sản phẩm phải có chất kết tủa).
- Ví dụ: AgNO₃ + NaCl → AgCl↓ + NaNO₃
- Phản ứng nhiệt phân: Một số muối bị phân hủy ở nhiệt độ cao.
- Ví dụ: CaCO₃ → CaO + CO₂
4.4. Ứng Dụng Của Muối Trong Đời Sống Và Công Nghiệp
Muối có nhiều ứng dụng quan trọng trong đời sống và công nghiệp:
- Gia vị: NaCl (muối ăn) là gia vị không thể thiếu trong nấu ăn.
- Bảo quản thực phẩm: Muối được sử dụng để bảo quản thực phẩm bằng cách ức chế sự phát triển của vi khuẩn.
- Sản xuất hóa chất: Nhiều muối được sử dụng làm nguyên liệu để sản xuất các hóa chất khác, ví dụ như Na₂CO₃ (soda), NaOH (xút).
- Sản xuất phân bón: Một số muối được sử dụng làm phân bón, ví dụ như (NH₄)₂SO₄.
- Y học: Nhiều muối được sử dụng trong y học, ví dụ như MgSO₄ (thuốc nhuận tràng), NaCl (dung dịch truyền).
Hiểu rõ về muối giúp chúng ta sử dụng chúng một cách an toàn và hiệu quả trong nhiều lĩnh vực khác nhau. Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN) luôn sẵn sàng cung cấp thêm thông tin chi tiết và giải đáp mọi thắc mắc của bạn về muối.
5. Phản Ứng Trung Hòa: Bản Chất, Ứng Dụng Và Các Yếu Tố Ảnh Hưởng
Phản ứng trung hòa là một phản ứng hóa học quan trọng, xảy ra khi axit tác dụng với bazơ, tạo thành muối và nước. Hiểu rõ về phản ứng trung hòa giúp chúng ta ứng dụng nó trong nhiều lĩnh vực khác nhau.
5.1. Bản Chất Của Phản Ứng Trung Hòa
Phản ứng trung hòa là phản ứng giữa ion H⁺ (từ axit) và ion OH⁻ (từ bazơ) tạo thành nước (H₂O). Phương trình ion thu gọn của phản ứng trung hòa là:
H⁺ + OH⁻ → H₂O
Phản ứng trung hòa là phản ứng tỏa nhiệt, vì sự hình thành liên kết O-H trong phân tử nước giải phóng năng lượng.
5.2. Ứng Dụng Của Phản Ứng Trung Hòa
Phản ứng trung hòa có nhiều ứng dụng quan trọng trong đời sống và công nghiệp:
- Xử lý nước thải: Phản ứng trung hòa được sử dụng để trung hòa axit hoặc bazơ trong nước thải trước khi thải ra môi trường. Ví dụ, sử dụng Ca(OH)₂ để trung hòa axit trong nước thải công nghiệp.
- Sản xuất muối: Phản ứng trung hòa được sử dụng để sản xuất các loại muối khác nhau. Ví dụ, sản xuất NaCl từ phản ứng giữa HCl và NaOH.
- Điều chỉnh độ pH của đất: Phản ứng trung hòa được sử dụng để điều chỉnh độ pH của đất trong nông nghiệp. Ví dụ, sử dụng vôi (CaCO₃) để trung hòa đất chua.
- Sản xuất thuốc: Phản ứng trung hòa được sử dụng trong sản xuất một số loại thuốc, ví dụ như thuốc trị đau dạ dày chứa Mg(OH)₂ hoặc Al(OH)₃ để trung hòa axit trong dạ dày.
- Chuẩn độ axit-bazơ: Phản ứng trung hòa là cơ sở của phương pháp chuẩn độ axit-bazơ, được sử dụng để xác định nồng độ của dung dịch axit hoặc bazơ.
5.3. Các Yếu Tố Ảnh Hưởng Đến Phản Ứng Trung Hòa
Hiệu quả của phản ứng trung hòa có thể bị ảnh hưởng bởi một số yếu tố:
- Nồng độ của axit và bazơ: Nồng độ càng cao, phản ứng xảy ra càng nhanh và hoàn toàn hơn.
- Độ mạnh của axit và bazơ: Axit mạnh và bazơ mạnh sẽ phản ứng nhanh và hoàn toàn hơn so với axit yếu và bazơ yếu.
- Nhiệt độ: Nhiệt độ cao thường làm tăng tốc độ phản ứng.
- Chất xúc tác: Một số chất xúc tác có thể làm tăng tốc độ phản ứng.
5.4. Ví Dụ Về Phản Ứng Trung Hòa
Dưới đây là một số ví dụ về phản ứng trung hòa:
- HCl (axit clohidric) + NaOH (natri hydroxit) → NaCl (natri clorua) + H₂O (nước)
- H₂SO₄ (axit sulfuric) + 2KOH (kali hydroxit) → K₂SO₄ (kali sulfat) + 2H₂O (nước)
- CH₃COOH (axit axetic) + NH₄OH (amoni hydroxit) → CH₃COONH₄ (amoni axetat) + H₂O (nước)
Hiểu rõ về phản ứng trung hòa giúp chúng ta ứng dụng nó một cách hiệu quả trong nhiều lĩnh vực khác nhau. Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN) luôn sẵn sàng cung cấp thêm thông tin chi tiết và giải đáp mọi thắc mắc của bạn về phản ứng trung hòa.
6. Mối Quan Hệ Giữa Axit, Bazơ Và Muối Trong Hóa Học
Axit, bazơ và muối là ba loại hợp chất hóa học có mối quan hệ mật thiết với nhau. Hiểu rõ mối quan hệ này giúp chúng ta nắm vững kiến thức hóa học một cách hệ thống và toàn diện.
6.1. Axit Và Bazơ
Axit và bazơ có tính chất đối lập nhau. Axit có khả năng nhường proton (H⁺), trong khi bazơ có khả năng nhận proton. Khi axit và bazơ tác dụng với nhau, chúng sẽ trung hòa lẫn nhau, tạo thành muối và nước. Phản ứng này được gọi là phản ứng trung hòa.
Axit + Bazơ → Muối + Nước
Ví dụ: HCl + NaOH → NaCl + H₂O
6.2. Axit Và Muối
Muối có thể được tạo thành từ phản ứng giữa axit và kim loại, oxit bazơ hoặc bazơ.
- Axit + Kim loại → Muối + Hydro
- Ví dụ: Fe + 2HCl → FeCl₂ + H₂
- Axit + Oxit bazơ → Muối + Nước
- Ví dụ: CuO + H₂SO₄ → CuSO₄ + H₂O
- Axit + Bazơ → Muối + Nước
- Ví dụ: NaOH + HCl → NaCl + H₂O
Ngoài ra, axit có thể tác dụng với muối của axit yếu hơn để tạo thành muối mới và axit mới.
- Axit + Muối (của axit yếu hơn) → Muối mới + Axit mới
- Ví dụ: CaCO₃ + 2HCl → CaCl₂ + H₂O + CO₂
6.3. Bazơ Và Muối
Bazơ có thể tác dụng với muối để tạo thành muối mới và bazơ mới (điều kiện: sản phẩm phải có chất kết tủa hoặc chất khí).
- Bazơ + Muối → Muối mới + Bazơ mới
- Ví dụ: CuCl₂ + 2NaOH → Cu(OH)₂↓ + 2NaCl
6.4. Tính Chất Lưỡng Tính
Một số chất vừa có tính chất của axit, vừa có tính chất của bazơ, được gọi là chất lưỡng tính. Ví dụ, Al(OH)₃ có thể tác dụng với cả axit và bazơ:
- Với axit: Al(OH)₃ + 3HCl → AlCl₃ + 3H₂O
- Với bazơ: Al(OH)₃ + NaOH → NaAlO₂ + 2H₂O
6.5. Mối Quan Hệ Tổng Quát
Tóm lại, axit, bazơ và muối có mối quan hệ chặt chẽ với nhau thông qua các phản ứng hóa học. Hiểu rõ mối quan hệ này giúp chúng ta dự đoán được sản phẩm của các phản ứng và ứng dụng chúng trong thực tế.
7. Hướng Dẫn Chi Tiết Cách Vẽ Sơ Đồ Tư Duy Axit Bazơ Muối Hiệu Quả
Để vẽ một sơ đồ tư duy axit bazơ muối hiệu quả, bạn có thể làm theo các bước sau:
7.1. Chuẩn Bị
- Giấy, bút, thước kẻ, màu sắc: Sử dụng giấy A4 hoặc lớn hơn để có đủ không gian. Chuẩn bị bút chì, bút bi, bút màu để vẽ và trang trí.
- Kiến thức nền tảng: Nắm vững các khái niệm cơ bản về axit, bazơ, muối, tính chất hóa học và mối quan hệ giữa chúng.
7.2. Các Bước Thực Hiện
- Xác định chủ đề trung tâm: Viết “Axit – Bazơ – Muối” hoặc một chủ đề cụ thể hơn vào giữa trang giấy và khoanh tròn lại.
- Vẽ các nhánh chính: Từ chủ đề trung tâm, vẽ các nhánh lớn tỏa ra, mỗi nhánh đại diện cho một khái niệm quan trọng, ví dụ:
- Axit
- Bazơ
- Muối
- Tính chất hóa học
- Ứng dụng
- Phát triển các nhánh phụ: Từ mỗi nhánh chính, vẽ các nhánh nhỏ hơn để chi tiết hóa các khái niệm. Ví dụ:
- Dưới nhánh “Axit”:
- Định nghĩa
- Phân loại
- Tên gọi
- Tính chất hóa học đặc trưng
- Ví dụ
- Dưới nhánh “Bazơ”:
- Định nghĩa
- Phân loại
- Tên gọi
- Tính chất hóa học đặc trưng
- Ví dụ
- Dưới nhánh “Muối”:
- Định nghĩa
- Phân loại
- Tên gọi
- Tính chất hóa học đặc trưng
- Ví dụ
- Dưới nhánh “Tính chất hóa học”:
- Tác dụng với kim loại
- Tác dụng với oxit
- Tác dụng với axit/bazơ
- Phản ứng trung hòa
- Dưới nhánh “Ứng dụng”:
- Trong công nghiệp
- Trong nông nghiệp
- Trong y học
- Trong đời sống
- Dưới nhánh “Axit”:
- Sử dụng từ khóa và hình ảnh: Thay vì viết cả câu, hãy sử dụng các từ khóa ngắn gọn, súc tích để gợi nhớ kiến thức. Sử dụng hình ảnh, biểu tượng để minh họa các khái niệm, công thức hóa học, phản ứng hóa học.
- Sử dụng màu sắc và biểu tượng: Sử dụng màu sắc khác nhau cho các nhánh chính để dễ phân biệt. Sử dụng biểu tượng để làm nổi bật các ý quan trọng.
- Liên kết các nhánh: Sử dụng mũi tên hoặc đường kẻ để chỉ ra mối liên hệ giữa các nhánh.
- Xem lại và chỉnh sửa: Sau khi hoàn thành, hãy xem lại toàn bộ sơ đồ để đảm bảo tính chính xác và logic. Chỉnh sửa và bổ sung nếu cần thiết.
7.3. Mẹo Để Vẽ Sơ Đồ Tư Duy Hiệu Quả Hơn
- Bắt đầu từ trung tâm: Luôn bắt đầu từ chủ đề trung tâm và phát triển ra các nhánh xung quanh.
- Sử dụng từ khóa: Chỉ sử dụng các từ khóa quan trọng để tiết kiệm không gian và tăng khả năng ghi nhớ.
- Sử dụng hình ảnh: Hình ảnh giúp kích thích não bộ và tăng khả năng ghi nhớ.
- Sử dụng màu sắc: Màu sắc giúp phân biệt các phần khác nhau của sơ đồ và tăng tính sinh động.
- Giữ cho sơ đồ đơn giản: Không nên quá tải sơ đồ với quá nhiều thông tin. Tập trung vào các ý chính và các mối liên hệ quan trọng.
- Cập nhật thường xuyên: Sơ đồ tư duy nên được cập nhật thường xuyên để phản ánh kiến thức mới và củng cố kiến thức cũ.
8. Các Ví Dụ Về Sơ Đồ Tư Duy Axit Bazơ Muối
Để giúp bạn hình dung rõ hơn về cách vẽ sơ đồ tư duy axit bazơ muối, dưới đây là một số ví dụ minh họa:
8.1. Ví Dụ 1: Sơ Đồ Tư Duy Tổng Quan Về Axit, Bazơ, Muối
- Chủ đề trung tâm: Axit – Bazơ – Muối
- Các nhánh chính:
- Axit: Định nghĩa, Phân loại, Tính chất, Ứng dụng, Ví dụ
- Bazơ: Định nghĩa, Phân loại, Tính chất, Ứng dụng, Ví dụ
- Muối: Định nghĩa, Phân loại, Tính chất, Ứng dụng, Ví dụ
- Phản ứng trung hòa: Định nghĩa, Ứng dụng, Các yếu tố ảnh hưởng
- Mối quan hệ: Axit-Bazơ, Axit-Muối, Bazơ-Muối
8.2. Ví Dụ 2: Sơ Đồ Tư Duy Chi Tiết Về Axit
- Chủ đề trung tâm: Axit
- Các nhánh chính:
- Định nghĩa: Arrhenius, Bronsted-Lowry, Lewis
- Phân loại: Theo nguồn gốc, Theo số nấc, Theo độ mạnh, Theo oxi
- Tính chất: Tác dụng chất chỉ thị, Tác dụng kim loại, Tác dụng oxit bazơ, Tác dụng bazơ, Tác dụng muối
- Ứng dụng: Sản xuất phân bón, Sản xuất chất tẩy rửa, Sản xuất thuốc, Sản xuất nhựa
- Ví dụ: HCl, H₂SO₄, HNO₃, CH₃COOH
8.3. Ví Dụ 3: Sơ Đồ Tư Duy Về Phản Ứng Trung Hòa
- Chủ đề trung tâm: Phản ứng trung hòa
- Các nhánh chính:
- Định nghĩa: Phản ứng giữa axit và bazơ tạo thành muối và nước
- Bản chất: H⁺ + OH⁻ → H₂O
- Ứng dụng: Xử lý nước thải, Sản xuất muối, Điều chỉnh pH đất, Sản xuất thuốc, Chuẩn độ
- Các yếu tố ảnh hưởng: Nồng độ, Độ mạnh, Nhiệt độ, Chất xúc tác
- Ví dụ: HCl + NaOH, H₂SO₄ + KOH, CH₃COOH + NH₄OH
9. Các Lưu Ý Quan Trọng Khi Học Về Axit, Bazơ, Muối
Khi học về axit, bazơ, muối, cần lưu ý những điểm sau để nắm vững kiến thức và tránh sai sót:
9.1. Nắm Vững Định Nghĩa
Hiểu rõ định nghĩa của axit, bazơ, muối theo các thuyết khác nhau (Arrhenius, Bronsted-Lowry, Lewis) để có cái nhìn toàn diện.
9.2. Phân Loại Chính Xác
Phân loại axit, bazơ, muối theo các tiêu chí khác nhau để hiểu rõ tính chất của từng loại.
9.3. Ghi Nhớ Tính Chất Hóa Học
Nắm vững các tính chất hóa học đặc trưng của axit, bazơ, muối và các điều kiện xảy ra phản ứng.
9.4. Hiểu Bản Chất Phản Ứng
Hiểu rõ bản chất của các phản ứng hóa học, đặc biệt là phản ứng trung hòa, để dự đoán sản phẩm và viết phương trình phản ứng chính xác.
9.5. Áp Dụng Vào Bài Tập
Làm nhiều bài tập vận dụng để củng cố kiến thức và rèn luyện kỹ năng giải bài tập.
9.6. An Toàn Trong Thí Nghiệm
Khi thực hiện các thí nghiệm với axit, bazơ, muối, cần tuân thủ các quy tắc an toàn để tránh tai nạn.
9.7. Liên Hệ Thực Tế
Tìm hiểu về các ứng dụng của axit, bazơ, muối trong đời sống và công nghiệp để thấy được tầm quan trọng của chúng.
10. FAQ – Các Câu Hỏi Thường Gặp Về Axit, Bazơ, Muối
Dưới đây là một số câu hỏi thường gặp về axit, bazơ, muối:
10.1. Axit mạnh là gì? Axit yếu là gì?
Axit mạnh là axit phân ly hoàn toàn trong nước, tạo ra nhiều ion H⁺. Axit yếu là axit phân ly không hoàn toàn trong nước, tạo ra ít ion H⁺.
10.2. Bazơ mạnh là gì? Bazơ yếu là gì?
Bazơ mạnh là bazơ phân ly hoàn toàn trong nước, tạo ra nhiều ion OH⁻. Bazơ yếu là bazơ phân ly không hoàn toàn trong nước, tạo ra ít ion OH⁻.
10.3. Làm thế nào để nhận biết dung dịch axit?
Dung dịch axit làm quỳ tím hóa đỏ, phenolphtalein không màu.
10.4. Làm thế nào để nhận biết dung dịch bazơ?
Dung dịch bazơ làm quỳ tím hóa xanh, phenolphtalein hóa hồng.
10.5. Phản ứng trung hòa là gì?
Phản ứng trung hòa là phản ứng giữa axit và bazơ tạo thành muối và nước.
10.6. Muối axit là gì?
Muối axit là muối mà trong gốc axit vẫn còn nguyên tử hydro có thể thay thế bằng kim loại.
10.7. Muối trung hòa là gì?
Muối trung hòa là muối mà trong gốc axit không còn nguyên tử hydro có thể thay thế bằng kim loại.
10.8. Chất lưỡng tính là gì?
Chất lưỡng tính là chất vừa có tính chất của axit, vừa có tính chất của bazơ.
10.9. Tại sao cần trung hòa axit trong nước thải?
Để bảo vệ môi trường và sức khỏe con người. Nước thải có độ axit cao có thể gây ăn mòn đường ống, ô nhiễm nguồn nước và ảnh hưởng đến sinh vật sống.
10.10. Ứng dụng của phản ứng trung hòa trong y học là gì?
Phản ứng trung hòa được sử dụng để sản xuất thuốc trị đau dạ dày, giúp trung hòa axit trong dạ dày.
Hy vọng những thông tin trên giúp bạn hiểu rõ hơn về axit, bazơ, muối và cách vẽ sơ đồ tư duy hiệu quả. Nếu bạn có bất kỳ thắc mắc nào, đừng ngần ngại liên hệ với Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN) để được tư vấn và giải đáp. Chúng tôi luôn sẵn sàng hỗ trợ bạn trên con đường chinh phục kiến thức hóa học. Địa chỉ của chúng tôi là Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội. Hotline: 0247 309 9988. Hãy truy cập trang web XETAIMYDINH.EDU.VN để tìm hiểu thêm thông tin chi tiết và khám phá những điều thú vị về thế giới xe tải.