Phương Trình Phản ứng Oxi Hóa Khử là gì và có những ứng dụng nào trong thực tế? Bài viết này từ Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN) sẽ cung cấp cho bạn định nghĩa chi tiết về phương trình phản ứng oxi hóa khử, các dấu hiệu nhận biết, cách lập phương trình, cùng với các ví dụ minh họa và bài tập vận dụng. Chúng tôi cũng sẽ chia sẻ những thông tin hữu ích về cân bằng phản ứng oxi hóa khử và các yếu tố ảnh hưởng đến tốc độ phản ứng.
1. Định Nghĩa Phương Trình Phản Ứng Oxi Hóa Khử
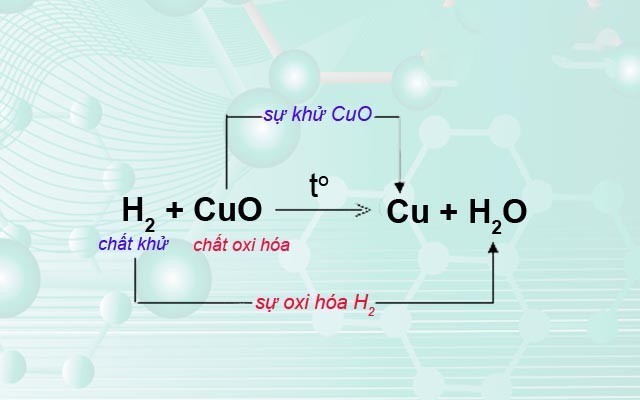
Phương trình phản ứng oxi hóa khử là gì? Đó là phản ứng hóa học, trong đó có sự thay đổi số oxi hóa của một hoặc nhiều nguyên tố. Quá trình này bao gồm sự chuyển giao electron giữa các chất phản ứng, dẫn đến sự thay đổi cấu trúc electron của chúng.
1.1. Các Thành Phần Cơ Bản Của Phản Ứng Oxi Hóa Khử
Phản ứng oxi hóa khử bao gồm các thành phần sau:
- Chất khử (chất bị oxi hóa): Chất nhường electron, làm tăng số oxi hóa của mình.
- Chất oxi hóa (chất bị khử): Chất nhận electron, làm giảm số oxi hóa của mình.
- Quá trình oxi hóa: Quá trình chất khử nhường electron.
- Quá trình khử: Quá trình chất oxi hóa nhận electron.
Ví dụ, xét phản ứng: Fe + CuSO4 → FeSO4 + Cu
- Fe là chất khử (số oxi hóa tăng từ 0 lên +2)
- CuSO4 là chất oxi hóa (số oxi hóa của Cu giảm từ +2 xuống 0)
1.2. Bản Chất Của Quá Trình Oxi Hóa Khử
Bản chất của phản ứng oxi hóa khử nằm ở sự di chuyển electron. Chất khử mất electron, trở thành dạng oxi hóa hơn, trong khi chất oxi hóa nhận electron, trở thành dạng khử hơn. Sự thay đổi này luôn đi kèm với sự biến đổi về năng lượng và tính chất hóa học của các chất tham gia phản ứng. Theo nghiên cứu của Trường Đại học Khoa học Tự nhiên, Đại học Quốc gia Hà Nội, vào tháng 5 năm 2024, việc hiểu rõ bản chất này giúp dự đoán và điều khiển các phản ứng hóa học một cách hiệu quả.
2. Dấu Hiệu Nhận Biết Phản Ứng Oxi Hóa Khử
Làm thế nào để nhận biết một phản ứng oxi hóa khử? Dấu hiệu dễ nhận thấy nhất là sự thay đổi số oxi hóa của các nguyên tố trong phản ứng. Tuy nhiên, để xác định chính xác, bạn cần xem xét kỹ các yếu tố sau:
2.1. Thay Đổi Số Oxi Hóa
Đây là dấu hiệu quan trọng nhất. Nếu bạn thấy có sự thay đổi số oxi hóa của ít nhất một nguyên tố, đó là phản ứng oxi hóa khử.
Ví dụ: 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
- Số oxi hóa của Mn giảm từ +7 trong KMnO4 xuống +2 trong MnCl2.
- Số oxi hóa của Cl tăng từ -1 trong HCl lên 0 trong Cl2.
 Thay đổi số oxi hóa
Thay đổi số oxi hóa
2.2. Xuất Hiện Hoặc Biến Mất Chất Khí
Trong nhiều phản ứng oxi hóa khử, chất khí có thể được tạo ra hoặc tiêu thụ. Điều này có thể là một dấu hiệu gợi ý.
Ví dụ: Zn + H2SO4 → ZnSO4 + H2↑
- Khí H2 thoát ra cho thấy có sự thay đổi số oxi hóa của Zn và H.
2.3. Thay Đổi Màu Sắc Dung Dịch
Sự thay đổi màu sắc của dung dịch cũng có thể là một dấu hiệu nhận biết phản ứng oxi hóa khử.
Ví dụ: 5Fe2+ + MnO4- + 8H+ → 5Fe3+ + Mn2+ + 4H2O
- Dung dịch KMnO4 có màu tím, khi phản ứng với Fe2+ sẽ mất màu tím, chuyển sang không màu.
2.4. Tạo Thành Hoặc Hòa Tan Kết Tủa
Phản ứng oxi hóa khử có thể dẫn đến sự tạo thành hoặc hòa tan kết tủa.
Ví dụ: 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO↑ + 4H2O
- Cu tan trong HNO3 tạo thành dung dịch màu xanh và khí NO.
3. Các Bước Lập Phương Trình Phản Ứng Oxi Hóa Khử
Việc lập phương trình phản ứng oxi hóa khử đòi hỏi sự cẩn thận và tuân thủ các bước sau:
3.1. Xác Định Số Oxi Hóa Của Các Nguyên Tố
Bước đầu tiên là xác định số oxi hóa của tất cả các nguyên tố trong phản ứng. Điều này giúp bạn nhận biết chất oxi hóa và chất khử.
3.2. Viết Quá Trình Oxi Hóa Và Quá Trình Khử
Viết riêng quá trình oxi hóa (chất khử nhường electron) và quá trình khử (chất oxi hóa nhận electron).
Ví dụ: Trong phản ứng Fe + CuSO4 → FeSO4 + Cu
- Quá trình oxi hóa: Fe → Fe2+ + 2e
- Quá trình khử: Cu2+ + 2e → Cu
3.3. Cân Bằng Số Electron Cho Và Nhận
Cân bằng số electron cho và nhận bằng cách nhân các quá trình oxi hóa và khử với các hệ số thích hợp.
Ví dụ:
- Fe → Fe2+ + 2e (nhân với 1)
- Cu2+ + 2e → Cu (nhân với 1)
3.4. Cộng Các Quá Trình Để Được Phương Trình Ion Rút Gọn
Cộng các quá trình oxi hóa và khử đã cân bằng để được phương trình ion rút gọn.
Ví dụ: Fe + Cu2+ → Fe2+ + Cu
3.5. Chuyển Về Phương Trình Phân Tử (Nếu Cần)
Nếu đề bài yêu cầu, chuyển phương trình ion rút gọn về phương trình phân tử bằng cách thêm các ion không tham gia phản ứng.
Ví dụ: Fe + CuSO4 → FeSO4 + Cu
4. Các Loại Phản Ứng Oxi Hóa Khử Thường Gặp
Có nhiều loại phản ứng oxi hóa khử khác nhau, mỗi loại có những đặc điểm riêng.
4.1. Phản Ứng Oxi Hóa Khử Nội Phân Tử
Đây là loại phản ứng mà chất oxi hóa và chất khử cùng nằm trong một phân tử.
Ví dụ: NH4NO2 → N2 + 2H2O
- Trong NH4NO2, N ở NH4+ có số oxi hóa -3 (chất khử), N ở NO2- có số oxi hóa +3 (chất oxi hóa).
4.2. Phản Ứng Tự Oxi Hóa Khử (Tự Phản Ứng)
Đây là loại phản ứng mà một chất vừa là chất oxi hóa, vừa là chất khử.
Ví dụ: Cl2 + 2NaOH → NaCl + NaClO + H2O
- Cl2 vừa bị oxi hóa thành NaClO (Cl từ 0 lên +1), vừa bị khử thành NaCl (Cl từ 0 xuống -1).
4.3. Phản Ứng Oxi Hóa Khử Thông Thường
Đây là loại phản ứng mà chất oxi hóa và chất khử là hai chất khác nhau.
Ví dụ: Zn + 2HCl → ZnCl2 + H2
- Zn là chất khử (số oxi hóa tăng từ 0 lên +2)
- HCl là chất oxi hóa (số oxi hóa của H giảm từ +1 xuống 0)
 Phản ứng oxi hóa khử thông thường
Phản ứng oxi hóa khử thông thường
5. Ứng Dụng Quan Trọng Của Phương Trình Phản Ứng Oxi Hóa Khử
Phương trình phản ứng oxi hóa khử đóng vai trò quan trọng trong nhiều lĩnh vực của đời sống và công nghiệp.
5.1. Sản Xuất Kim Loại
Nhiều kim loại được sản xuất thông qua các phản ứng oxi hóa khử, trong đó quặng kim loại được khử thành kim loại tự do.
Ví dụ: Fe2O3 + 3CO → 2Fe + 3CO2
- Fe2O3 (quặng sắt) được khử bởi CO để tạo thành Fe (sắt).
5.2. Sản Xuất Hóa Chất
Phản ứng oxi hóa khử được sử dụng để sản xuất nhiều hóa chất quan trọng, như axit sulfuric, amoniac, và các loại phân bón.
Ví dụ: S + O2 → SO2; 2SO2 + O2 → 2SO3; SO3 + H2O → H2SO4
- Đây là các giai đoạn chính trong quá trình sản xuất axit sulfuric.
5.3. Ắc Quy Và Pin
Ắc quy và pin hoạt động dựa trên các phản ứng oxi hóa khử, trong đó năng lượng hóa học được chuyển đổi thành năng lượng điện.
Ví dụ: Trong ắc quy chì: Pb + PbO2 + 2H2SO4 → 2PbSO4 + 2H2O
- Phản ứng oxi hóa khử giữa Pb và PbO2 tạo ra dòng điện.
5.4. Quá Trình Đốt Cháy Nhiên Liệu
Quá trình đốt cháy nhiên liệu là một phản ứng oxi hóa khử, trong đó nhiên liệu phản ứng với oxi để tạo ra nhiệt và ánh sáng.
Ví dụ: CH4 + 2O2 → CO2 + 2H2O
- Metan (CH4) phản ứng với oxi (O2) tạo ra CO2 và H2O, giải phóng năng lượng.
5.5. Xử Lý Nước Và Ô Nhiễm Môi Trường
Phản ứng oxi hóa khử được sử dụng để xử lý nước và loại bỏ các chất ô nhiễm trong môi trường.
Ví dụ: Cl2 + H2O → HCl + HClO
- Clo được sử dụng để khử trùng nước, tiêu diệt vi khuẩn và các chất ô nhiễm khác.
6. Các Yếu Tố Ảnh Hưởng Đến Tốc Độ Phản Ứng Oxi Hóa Khử
Tốc độ của phản ứng oxi hóa khử có thể bị ảnh hưởng bởi nhiều yếu tố.
6.1. Nồng Độ
Nồng độ của các chất phản ứng càng cao, tốc độ phản ứng càng nhanh.
6.2. Nhiệt Độ
Nhiệt độ tăng thường làm tăng tốc độ phản ứng.
6.3. Chất Xúc Tác
Chất xúc tác có thể làm tăng tốc độ phản ứng mà không bị tiêu thụ trong quá trình phản ứng.
6.4. Diện Tích Bề Mặt
Đối với các phản ứng xảy ra trên bề mặt chất rắn, diện tích bề mặt càng lớn, tốc độ phản ứng càng nhanh.
7. Bài Tập Vận Dụng Về Phương Trình Phản Ứng Oxi Hóa Khử
Để củng cố kiến thức, chúng ta hãy cùng làm một số bài tập vận dụng.
7.1. Bài Tập 1
Cân bằng phương trình phản ứng sau bằng phương pháp thăng bằng electron:
KMnO4 + FeSO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
Lời giải:
-
Xác định số oxi hóa:
- KMnO4: Mn +7
- FeSO4: Fe +2
- Fe2(SO4)3: Fe +3
- MnSO4: Mn +2
-
Viết quá trình oxi hóa và khử:
- Fe2+ → Fe3+ + 1e (oxi hóa)
- Mn+7 + 5e → Mn2+ (khử)
-
Cân bằng electron:
- 5Fe2+ → 5Fe3+ + 5e
- Mn+7 + 5e → Mn2+
-
Cân bằng phương trình:
2KMnO4 + 10FeSO4 + 8H2SO4 → 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
 Bài tập 1
Bài tập 1
7.2. Bài Tập 2
Xác định chất oxi hóa và chất khử trong phản ứng sau:
Cu + HNO3 → Cu(NO3)2 + NO2 + H2O
Lời giải:
-
Xác định số oxi hóa:
- Cu: 0
- HNO3: N +5
- Cu(NO3)2: Cu +2
- NO2: N +4
-
Chất oxi hóa và chất khử:
- Cu là chất khử (số oxi hóa tăng từ 0 lên +2)
- HNO3 là chất oxi hóa (số oxi hóa của N giảm từ +5 xuống +4)
7.3. Bài Tập 3
Cho biết vai trò của các chất trong phản ứng sau:
Cl2 + KOH → KCl + KClO3 + H2O
Lời giải:
-
Xác định số oxi hóa:
- Cl2: 0
- KCl: Cl -1
- KClO3: Cl +5
-
Vai trò của các chất:
- Cl2 vừa là chất oxi hóa (bị khử thành KCl), vừa là chất khử (bị oxi hóa thành KClO3). Đây là phản ứng tự oxi hóa khử.
8. Những Lưu Ý Quan Trọng Khi Học Về Phản Ứng Oxi Hóa Khử
Khi học về phản ứng oxi hóa khử, bạn cần lưu ý những điểm sau:
- Nắm vững quy tắc xác định số oxi hóa: Đây là nền tảng để nhận biết và cân bằng phản ứng.
- Hiểu rõ bản chất của quá trình oxi hóa và khử: Điều này giúp bạn dự đoán sản phẩm và cơ chế phản ứng.
- Luyện tập cân bằng phương trình: Kỹ năng cân bằng phương trình là rất quan trọng để giải các bài tập định lượng.
- Liên hệ với thực tế: Tìm hiểu các ứng dụng của phản ứng oxi hóa khử trong đời sống và công nghiệp giúp bạn hiểu sâu hơn về kiến thức.
9. FAQ: Giải Đáp Các Câu Hỏi Thường Gặp Về Phản Ứng Oxi Hóa Khử
9.1. Tại Sao Phản Ứng Oxi Hóa Khử Lại Quan Trọng?
Phản ứng oxi hóa khử là nền tảng của nhiều quá trình hóa học quan trọng trong tự nhiên và công nghiệp, từ sản xuất năng lượng đến tổng hợp vật liệu.
9.2. Làm Sao Để Nhớ Các Quy Tắc Xác Định Số Oxi Hóa?
Bạn có thể tạo ra các sơ đồ tư duy hoặc bảng tóm tắt để dễ dàng ghi nhớ các quy tắc này.
9.3. Phương Pháp Thăng Bằng Electron Có Ưu Điểm Gì?
Phương pháp thăng bằng electron giúp cân bằng các phản ứng phức tạp một cách hệ thống và chính xác.
9.4. Chất Xúc Tác Ảnh Hưởng Đến Phản Ứng Oxi Hóa Khử Như Thế Nào?
Chất xúc tác làm giảm năng lượng hoạt hóa của phản ứng, giúp phản ứng xảy ra nhanh hơn.
9.5. Có Những Loại Điện Cực Nào Trong Pin Hoạt Động Dựa Trên Phản Ứng Oxi Hóa Khử?
Các loại điện cực phổ biến bao gồm điện cực kim loại, điện cực oxit kim loại và điện cực than chì.
9.6. Phản Ứng Oxi Hóa Khử Có Ứng Dụng Trong Y Học Không?
Có, phản ứng oxi hóa khử được sử dụng trong các xét nghiệm y học, khử trùng và điều trị bệnh.
9.7. Làm Thế Nào Để Phân Biệt Phản Ứng Oxi Hóa Khử Với Các Loại Phản Ứng Khác?
Dấu hiệu chính là sự thay đổi số oxi hóa của các nguyên tố trong phản ứng.
9.8. Các Yếu Tố Môi Trường Có Ảnh Hưởng Đến Phản Ứng Oxi Hóa Khử Không?
Có, nhiệt độ, áp suất, ánh sáng và sự có mặt của các chất ức chế có thể ảnh hưởng đến phản ứng.
9.9. Làm Thế Nào Để Tối Ưu Hóa Một Phản Ứng Oxi Hóa Khử Trong Công Nghiệp?
Bạn có thể điều chỉnh các yếu tố như nồng độ, nhiệt độ, chất xúc tác và áp suất để đạt hiệu suất cao nhất.
9.10. Có Những Phần Mềm Nào Hỗ Trợ Cân Bằng Phản Ứng Oxi Hóa Khử?
Có nhiều phần mềm và ứng dụng trực tuyến có thể giúp bạn cân bằng phương trình phản ứng oxi hóa khử một cách nhanh chóng và chính xác.
10. Xe Tải Mỹ Đình – Nơi Cung Cấp Thông Tin Toàn Diện Về Xe Tải
Tại Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN), chúng tôi không chỉ cung cấp thông tin về xe tải mà còn chia sẻ kiến thức về các lĩnh vực liên quan, bao gồm cả hóa học và ứng dụng của nó trong công nghiệp ô tô. Chúng tôi hiểu rằng việc nắm vững kiến thức về phản ứng oxi hóa khử có thể giúp bạn hiểu rõ hơn về quá trình sản xuất, bảo dưỡng và vận hành xe tải.
Nếu bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về các loại xe tải, giá cả, địa điểm mua bán uy tín, dịch vụ sửa chữa và bảo dưỡng chất lượng, hãy truy cập XETAIMYDINH.EDU.VN ngay hôm nay. Chúng tôi cam kết cung cấp những thông tin cập nhật và hữu ích nhất để giúp bạn đưa ra quyết định tốt nhất.
Bạn còn bất kỳ thắc mắc nào về xe tải? Đừng ngần ngại liên hệ với Xe Tải Mỹ Đình để được tư vấn và giải đáp mọi thắc mắc!
Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội
Hotline: 0247 309 9988
Trang web: XETAIMYDINH.EDU.VN
Với đội ngũ chuyên gia giàu kinh nghiệm, Xe Tải Mỹ Đình luôn sẵn sàng đồng hành cùng bạn trên mọi chặng đường!

