Phi kim đóng vai trò quan trọng trong cuộc sống và sản xuất. Bạn muốn biết Phi Kim Gồm Những Nguyên Tố Nào, tính chất và ứng dụng của chúng ra sao? Xe Tải Mỹ Đình sẽ cung cấp thông tin chi tiết và dễ hiểu nhất về các nguyên tố phi kim phổ biến hiện nay.
1. Phi Kim Là Gì? Định Nghĩa Chi Tiết
Phi kim là các nguyên tố hóa học nằm ở phía bên phải của bảng tuần hoàn, trừ hydro. Đặc điểm nổi bật của chúng là dễ nhận thêm electron trong các phản ứng hóa học để đạt cấu hình bền vững hơn. Vậy, phi kim gồm những nguyên tố nào? Hãy cùng Xe Tải Mỹ Đình tìm hiểu ngay sau đây.
Các nguyên tố phi kim phổ biến bao gồm:
- Hydro (H)
- Carbon (C)
- Nitơ (N)
- Oxy (O)
- Flo (F)
- Silic (Si)
- Photpho (P)
- Lưu huỳnh (S)
- Clo (Cl)
- Brom (Br)
- Iot (I)
- Các khí hiếm (Heli, Neon, Argon, Krypton, Xenon, Radon)
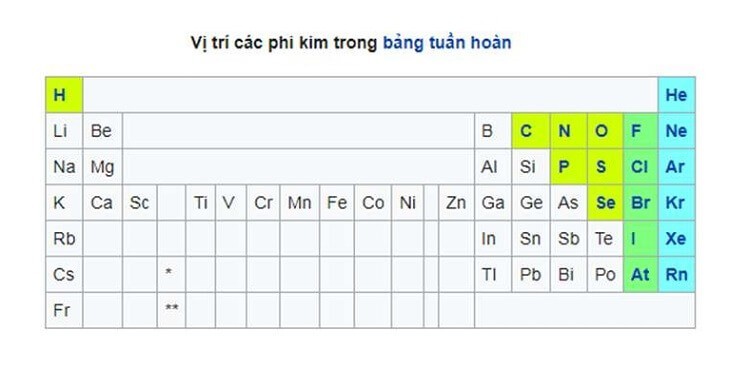 Vi Trí Phi Kim Trong Bảng Tuần Hoàn Với Chú Thích Rõ Ràng
Vi Trí Phi Kim Trong Bảng Tuần Hoàn Với Chú Thích Rõ Ràng
2. Phân Loại Phi Kim: Các Nhóm Nguyên Tố Cụ Thể
Việc phân loại phi kim có thể gây tranh cãi do sự chuyển tiếp giữa phi kim và kim loại (á kim) không phải lúc nào cũng rõ ràng. Tuy nhiên, về cơ bản, phi kim có thể được chia thành các nhóm sau:
- Khí hiếm (hay khí trơ): Gồm Heli (He), Neon (Ne), Argon (Ar), Krypton (Kr), Xenon (Xe) và Radon (Rn). Đây là các nguyên tố rất khó tham gia phản ứng hóa học vì lớp electron ngoài cùng của chúng đã bão hòa.
- Nhóm Halogen: Gồm Flo (F), Clo (Cl), Brom (Br), Iot (I) và Astatin (At). Các halogen rất hoạt động hóa học và dễ dàng tạo thành các hợp chất với kim loại và phi kim khác.
- Các phi kim còn lại: Gồm các nguyên tố như Carbon (C), Nitơ (N), Oxy (O), Photpho (P), Lưu huỳnh (S) và Selen (Se). Các phi kim này có tính chất hóa học đa dạng và tham gia vào nhiều hợp chất quan trọng.
- Á kim: Một số nguyên tố như Bo (B), Silic (Si), Germanium (Ge), Arsenic (As), Antimony (Sb) và Tellurium (Te) được công nhận là á kim. Chúng có tính chất trung gian giữa kim loại và phi kim, đôi khi dẫn điện như kim loại, đôi khi lại có tính chất hóa học giống phi kim.
3. Tính Chất Vật Lý Của Phi Kim: Đặc Điểm Nhận Biết
Phi kim có những tính chất vật lý đặc trưng giúp phân biệt chúng với kim loại. Tuy nhiên, cần lưu ý rằng tính chất của phi kim có thể thay đổi tùy thuộc vào từng nguyên tố cụ thể.
- Trạng thái tồn tại: Ở điều kiện thường, phi kim có thể tồn tại ở cả ba trạng thái: khí (ví dụ: oxy, nitơ, clo), lỏng (ví dụ: brom) và rắn (ví dụ: cacbon, lưu huỳnh, photpho).
- Màu sắc: Phi kim có màu sắc rất đa dạng. Ví dụ, oxy và nitơ không màu, clo có màu vàng lục, brom có màu nâu đỏ, iot có màu tím than, lưu huỳnh có màu vàng.
- Tính dẫn điện và dẫn nhiệt: Đa số phi kim dẫn điện và dẫn nhiệt kém. Than chì (một dạng thù hình của cacbon) là một ngoại lệ, có khả năng dẫn điện khá tốt.
- Độ cứng: Phi kim thường có độ cứng thấp và dễ vỡ. Tuy nhiên, kim cương (một dạng thù hình khác của cacbon) lại là vật chất cứng nhất được biết đến.
- Nhiệt độ nóng chảy và nhiệt độ sôi: Nhiệt độ nóng chảy và nhiệt độ sôi của phi kim thường thấp hơn so với kim loại.
Để dễ hình dung, bạn có thể tham khảo bảng so sánh tính chất vật lý của một số phi kim phổ biến dưới đây:
| Tính chất | Oxy (O2) | Lưu huỳnh (S) | Than chì (C) | Brom (Br2) |
|---|---|---|---|---|
| Trạng thái | Khí | Rắn | Rắn | Lỏng |
| Màu sắc | Không màu | Vàng | Xám đen | Nâu đỏ |
| Dẫn điện | Kém | Kém | Tốt | Kém |
| Dẫn nhiệt | Kém | Kém | Tốt | Kém |
| Độ cứng | Thấp | Thấp | Mềm | Thấp |
| Nhiệt độ nóng chảy | -218.8 °C | 115.2 °C | >3500 °C | -7.2 °C |
4. Tính Chất Hóa Học Của Phi Kim: Khả Năng Phản Ứng
Tính chất hóa học của phi kim rất đa dạng và phụ thuộc vào khả năng nhận electron của chúng. Các phi kim có độ âm điện cao (khả năng hút electron mạnh) sẽ hoạt động hóa học mạnh hơn.
Các phản ứng hóa học đặc trưng của phi kim:
4.1. Tác dụng với kim loại
Nhiều phi kim tác dụng với kim loại tạo thành muối hoặc oxit.
-
Tạo muối: Phi kim tác dụng với kim loại tạo thành muối. Ví dụ:
Fe + S → FeS (sắt(II) sunfua)
-
Tạo oxit: Kim loại để trong không khí có chứa oxy (một phi kim) thường tạo thành oxit. Ví dụ:
4Fe + 3O2 → 2Fe2O3 (sắt(III) oxit, gỉ sắt)
Theo nghiên cứu của Trường Đại học Khoa học Tự nhiên Hà Nội, Khoa Hóa học, năm 2024, phản ứng giữa phi kim và kim loại tạo ra các hợp chất có tính ứng dụng cao trong công nghiệp và đời sống.
4.2. Tác dụng với hydro
Phi kim phản ứng với hydro tạo thành các hợp chất khí.
-
Oxy tác dụng với hydro: Tạo thành hơi nước:
2H2 + O2 → 2H2O
-
Clo tác dụng với hydro: Tạo thành hydro clorua:
H2 + Cl2 → 2HCl
-
Các phi kim khác: Ngoài clo, nhiều phi kim khác như cacbon (C), lưu huỳnh (S), brom (Br2),… cũng có thể phản ứng với hydro tạo thành các hợp chất khí tương ứng.
4.3. Tác dụng với oxy
Nhiều phi kim tác dụng với oxy tạo thành oxit axit.
-
Lưu huỳnh tác dụng với oxy: Tạo thành lưu huỳnh đioxit (khí không màu, gây ô nhiễm không khí):
S + O2 → SO2
Lưu ý: Mức độ hoạt động của phi kim phụ thuộc vào khả năng nhận electron của nó. Flo là phi kim hoạt động mạnh nhất, có thể tham gia vào hầu hết các phản ứng đặc trưng của phi kim. Các nguyên tố như photpho, lưu huỳnh, silic, cacbon,… hoạt động yếu hơn do cần nhận nhiều electron hơn.
5. Ứng Dụng Của Phi Kim Trong Thực Tế: Đa Dạng và Thiết Yếu
Mỗi loại phi kim có những ứng dụng riêng biệt trong đời sống và sản xuất.
- Carbon: Than chì dùng làm ruột bút chì, điện cực. Kim cương (một dạng thù hình của carbon) được dùng làm trang sức quý, dao cắt kính, mũi khoan.
- Lưu huỳnh: Sản xuất axit sulfuric (H2SO4), diêm, thuốc súng, phân bón, thuốc trừ sâu, sản xuất cao su.
- Oxy: Duy trì sự sống của con người và động vật, dùng trong y tế (bình oxy), sản xuất thép, hàn cắt kim loại.
- Nitơ: Sản xuất phân đạm, chất làm lạnh, bảo quản thực phẩm.
- Clo: Khử trùng nước sinh hoạt, tẩy trắng sợi vải, sản xuất nhựa PVC, thuốc trừ sâu.
- Brom: Sản xuất vật liệu chống cháy, xử lý nước bể bơi, dược phẩm (chữa ung thư, Alzheimer).
Theo Tổng cục Thống kê Việt Nam, năm 2022, sản lượng các sản phẩm hóa chất từ phi kim (như phân bón, thuốc trừ sâu) đóng góp đáng kể vào ngành nông nghiệp, giúp tăng năng suất cây trồng và đảm bảo an ninh lương thực.
Bảng tóm tắt ứng dụng của một số phi kim phổ biến:
| Phi kim | Ứng dụng |
|---|---|
| Oxy | Duy trì sự sống, y tế, sản xuất thép, hàn cắt kim loại |
| Nitơ | Sản xuất phân đạm, chất làm lạnh, bảo quản thực phẩm |
| Clo | Khử trùng nước, tẩy trắng, sản xuất nhựa PVC, thuốc trừ sâu |
| Lưu huỳnh | Sản xuất axit sulfuric, diêm, thuốc súng, phân bón, thuốc trừ sâu, sản xuất cao su |
| Carbon | Ruột bút chì (than chì), trang sức, dao cắt kính, mũi khoan (kim cương) |
| Photpho | Sản xuất phân lân, diêm, chất bán dẫn |
| Brom | Sản xuất vật liệu chống cháy, xử lý nước bể bơi, dược phẩm |
| Silic | Sản xuất chất bán dẫn (trong vi mạch điện tử), vật liệu xây dựng (silicat) |
| Khí hiếm | Đèn chiếu sáng (neon, argon), môi trường trơ trong sản xuất và nghiên cứu (argon, heli) |
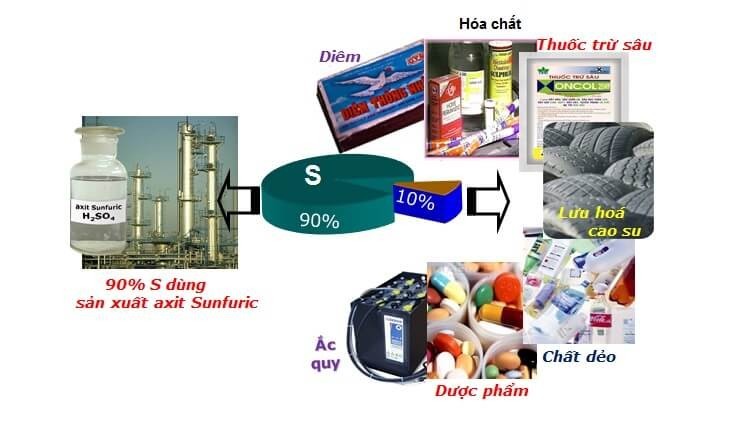 Ứng Dụng Của Phi Kim Lưu Huỳnh Trong Nông Nghiệp
Ứng Dụng Của Phi Kim Lưu Huỳnh Trong Nông Nghiệp
6. FAQ: Các Câu Hỏi Thường Gặp Về Phi Kim
6.1. Phi kim dẫn điện không?
Đa số phi kim không dẫn điện, trừ than chì (một dạng thù hình của cacbon).
6.2. Phi kim có những trạng thái nào?
Phi kim có thể tồn tại ở cả ba trạng thái: rắn, lỏng và khí.
6.3. Phi kim nào quan trọng nhất đối với sự sống?
Oxy là phi kim quan trọng nhất đối với sự sống vì nó cần thiết cho quá trình hô hấp của hầu hết các sinh vật.
6.4. Phi kim nào được sử dụng để khử trùng nước?
Clo được sử dụng rộng rãi để khử trùng nước sinh hoạt và nước bể bơi.
6.5. Kim cương là kim loại hay phi kim?
Kim cương là một dạng thù hình của cacbon, do đó nó là phi kim.
6.6. Tại sao phi kim dễ nhận electron?
Phi kim dễ nhận electron vì chúng có độ âm điện cao và có xu hướng đạt cấu hình electron bền vững hơn.
6.7. Á kim là gì?
Á kim là những nguyên tố có tính chất trung gian giữa kim loại và phi kim.
6.8. Ứng dụng của silic trong công nghiệp là gì?
Silic được sử dụng rộng rãi trong sản xuất chất bán dẫn (cho vi mạch điện tử) và vật liệu xây dựng (silicat).
6.9. Khí hiếm có tham gia phản ứng hóa học không?
Khí hiếm rất khó tham gia phản ứng hóa học vì lớp electron ngoài cùng của chúng đã bão hòa.
6.10. Làm thế nào để phân biệt kim loại và phi kim?
Có thể phân biệt kim loại và phi kim dựa vào các tính chất vật lý như độ dẫn điện, độ dẫn nhiệt, độ cứng, ánh kim và tính chất hóa học như khả năng tác dụng với axit, bazơ, oxy,…
7. Tìm Hiểu Thêm Về Xe Tải Tại Mỹ Đình Cùng XETAIMYDINH.EDU.VN
Bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về các loại xe tải ở khu vực Mỹ Đình, Hà Nội? Bạn muốn so sánh giá cả, thông số kỹ thuật và tìm địa chỉ mua bán xe tải uy tín? Hãy đến với Xe Tải Mỹ Đình!
Tại XETAIMYDINH.EDU.VN, chúng tôi cung cấp:
- Thông tin chi tiết và cập nhật về các loại xe tải có sẵn ở Mỹ Đình.
- So sánh giá cả và thông số kỹ thuật giữa các dòng xe.
- Tư vấn lựa chọn xe phù hợp với nhu cầu và ngân sách của bạn.
- Giải đáp các thắc mắc liên quan đến thủ tục mua bán, đăng ký và bảo dưỡng xe tải.
- Thông tin về các dịch vụ sửa chữa xe tải uy tín trong khu vực.
Đừng bỏ lỡ cơ hội nhận được sự tư vấn chuyên nghiệp và thông tin hữu ích nhất về xe tải tại Mỹ Đình!
Liên hệ ngay với Xe Tải Mỹ Đình qua:
- Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội
- Hotline: 0247 309 9988
- Trang web: XETAIMYDINH.EDU.VN
Chúng tôi luôn sẵn sàng hỗ trợ bạn!
