Bạn đang tìm hiểu về khả năng phản ứng của phenol? Bài viết này từ Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN) sẽ cung cấp thông tin chi tiết về các chất mà phenol có thể tác dụng, kèm theo phương trình phản ứng và ứng dụng thực tế, giúp bạn hiểu rõ hơn về hóa chất quan trọng này.
1. Phenol Là Gì? Tổng Quan Về Tính Chất Và Ứng Dụng
Phenol là một hợp chất hữu cơ thơm, trong đó một nhóm hydroxyl (-OH) liên kết trực tiếp với một nguyên tử carbon của vòng benzen. Công thức hóa học của phenol là C6H5OH. Nó là một chất rắn kết tinh, màu trắng hoặc không màu, có mùi đặc trưng, hơi ngọt và hắc. Vậy Phenol Tác Dụng được Với những chất nào? Để trả lời câu hỏi này, hãy cùng tìm hiểu sâu hơn về các tính chất và khả năng phản ứng của nó.
 Lý thuyết Phenol là gì
Lý thuyết Phenol là gì
Phenol là gì?
1.1. Tính Chất Vật Lý Của Phenol
- Trạng thái: Tinh thể rắn.
- Màu sắc: Trắng hoặc không màu.
- Mùi: Mùi đặc trưng, hơi ngọt và hắc, tương tự như mùi thuốc khử trùng.
- Điểm nóng chảy: 40-43°C.
- Điểm sôi: 180-182°C.
- Độ tan: Ít tan trong nước lạnh (khoảng 8g/100g nước), tan tốt trong dung môi hữu cơ như ethanol, ether, acetone.
- Tính hút ẩm: Dễ hút ẩm từ không khí, chảy rữa.
- Biến đổi màu: Để lâu trong không khí, phenol bị oxy hóa một phần và chuyển sang màu hồng do tạo thành các sản phẩm oxy hóa.
1.2. Tính Chất Hóa Học Của Phenol
Phenol thể hiện tính chất hóa học đặc trưng của cả nhóm hydroxyl (-OH) và vòng benzen. Dưới đây là các phản ứng quan trọng:
- Tính axit yếu: Phenol có tính axit yếu hơn so với alcohol thông thường do ảnh hưởng của vòng benzen. Nó có thể tác dụng với dung dịch kiềm mạnh.
- Phản ứng thế electrophin trên vòng benzen: Vòng benzen của phenol hoạt hóa hơn so với benzen, do đó dễ tham gia phản ứng thế electrophin, đặc biệt ở vị trí ortho và para so với nhóm -OH.
- Phản ứng với nước brom: Tạo kết tủa trắng 2,4,6-tribromophenol.
- Phản ứng với axit nitric: Tạo thành nitrophenol hoặc axit picric (2,4,6-trinitrophenol) tùy thuộc vào điều kiện phản ứng.
- Phản ứng este hóa: Tạo thành este khi tác dụng với anhydride hoặc chloride acid.
1.3. Ứng Dụng Quan Trọng Của Phenol Trong Đời Sống Và Công Nghiệp
Phenol là một hóa chất quan trọng với nhiều ứng dụng đa dạng, bao gồm:
- Sản xuất nhựa phenol-formaldehyd: Đây là ứng dụng lớn nhất của phenol, được sử dụng để sản xuất các loại nhựa như bakelite, dùng trong sản xuất đồ gia dụng, vật liệu cách điện, chất kết dính. Theo số liệu thống kê từ Tổng cục Thống kê năm 2023, ngành sản xuất nhựa và hóa chất nhựa đã đóng góp đáng kể vào GDP của Việt Nam, với phenol là một nguyên liệu đầu vào quan trọng.
- Sản xuất hóa chất và dược phẩm: Phenol là nguyên liệu để sản xuất nhiều loại hóa chất khác, bao gồm thuốc trừ sâu, thuốc diệt cỏ, chất khử trùng, thuốc nhuộm, chất bảo quản gỗ và một số loại thuốc.
- Sản xuất caprolactam: Caprolactam là nguyên liệu để sản xuất nylon-6, một loại polymer quan trọng.
- Chất khử trùng và sát trùng: Do tính chất kháng khuẩn, phenol được sử dụng trong một số sản phẩm khử trùng, sát trùng, nhưng với nồng độ rất thấp để tránh gây hại.
- Trong y học: Phenol được sử dụng trong một số quy trình y tế như tiêm phenol để điều trị đau thần kinh.
 Ứng dụng của C6H5OH trong thuốc diệt cỏ
Ứng dụng của C6H5OH trong thuốc diệt cỏ
Ứng dụng của Phenol trong thuốc diệt cỏ
Lưu ý quan trọng: Phenol là một chất độc hại, có thể gây bỏng da, tổn thương mắt và ảnh hưởng đến hệ thần kinh. Cần sử dụng và bảo quản phenol một cách cẩn thận, tuân thủ các quy tắc an toàn hóa chất.
2. Phenol Tác Dụng Được Với Chất Nào? Chi Tiết Các Phản Ứng Hóa Học
Vậy, phenol tác dụng được với chất nào? Dưới đây là danh sách chi tiết các chất và loại phản ứng mà phenol có thể tham gia:
2.1. Phenol Tác Dụng Với Kim Loại Kiềm
Phenol phản ứng với kim loại kiềm như natri (Na) hoặc kali (K) tạo thành phenolat và giải phóng khí hydro.
Phương trình phản ứng:
2C6H5OH + 2Na → 2C6H5ONa + H2
Cơ chế phản ứng:
Hydroxyl của phenol có tính axit yếu, có khả năng nhường proton (H+) cho kim loại kiềm, tạo thành ion phenolat (C6H5O-) và giải phóng khí hydro.
Ứng dụng:
Phản ứng này có thể dùng để điều chế phenolat, một chất trung gian quan trọng trong tổng hợp hữu cơ.
2.2. Phenol Tác Dụng Với Dung Dịch Kiềm
Phenol tác dụng với dung dịch kiềm như natri hydroxit (NaOH) hoặc kali hydroxit (KOH) tạo thành phenolat tan trong nước.
Phương trình phản ứng:
C6H5OH + NaOH → C6H5ONa + H2O
Cơ chế phản ứng:
Tương tự như phản ứng với kim loại kiềm, phenol nhường proton cho hydroxit (OH-) trong dung dịch kiềm, tạo thành ion phenolat và nước.
Ứng dụng:
Phản ứng này được sử dụng để tách phenol ra khỏi hỗn hợp các chất hữu cơ khác. Phenolat tan trong nước có thể được tách ra, sau đó axit hóa để thu lại phenol. Theo một nghiên cứu của Trường Đại học Bách khoa Hà Nội, quy trình này được ứng dụng rộng rãi trong công nghiệp hóa chất để tinh chế phenol.
2.3. Phenol Tác Dụng Với Nước Brom
Phenol phản ứng mạnh mẽ với nước brom (Br2) tạo thành kết tủa trắng 2,4,6-tribromophenol.
Phương trình phản ứng:
C6H5OH + 3Br2 → C6H2Br3OH + 3HBr
Cơ chế phản ứng:
Brom là một chất electrophile mạnh, tấn công vào vòng benzen của phenol ở các vị trí ortho và para so với nhóm -OH. Do nhóm -OH hoạt hóa vòng benzen, phản ứng xảy ra rất dễ dàng, tạo thành sản phẩm thế tribrom.
Ứng dụng:
Phản ứng này được sử dụng để nhận biết phenol. Sự xuất hiện của kết tủa trắng chứng tỏ sự có mặt của phenol trong mẫu.
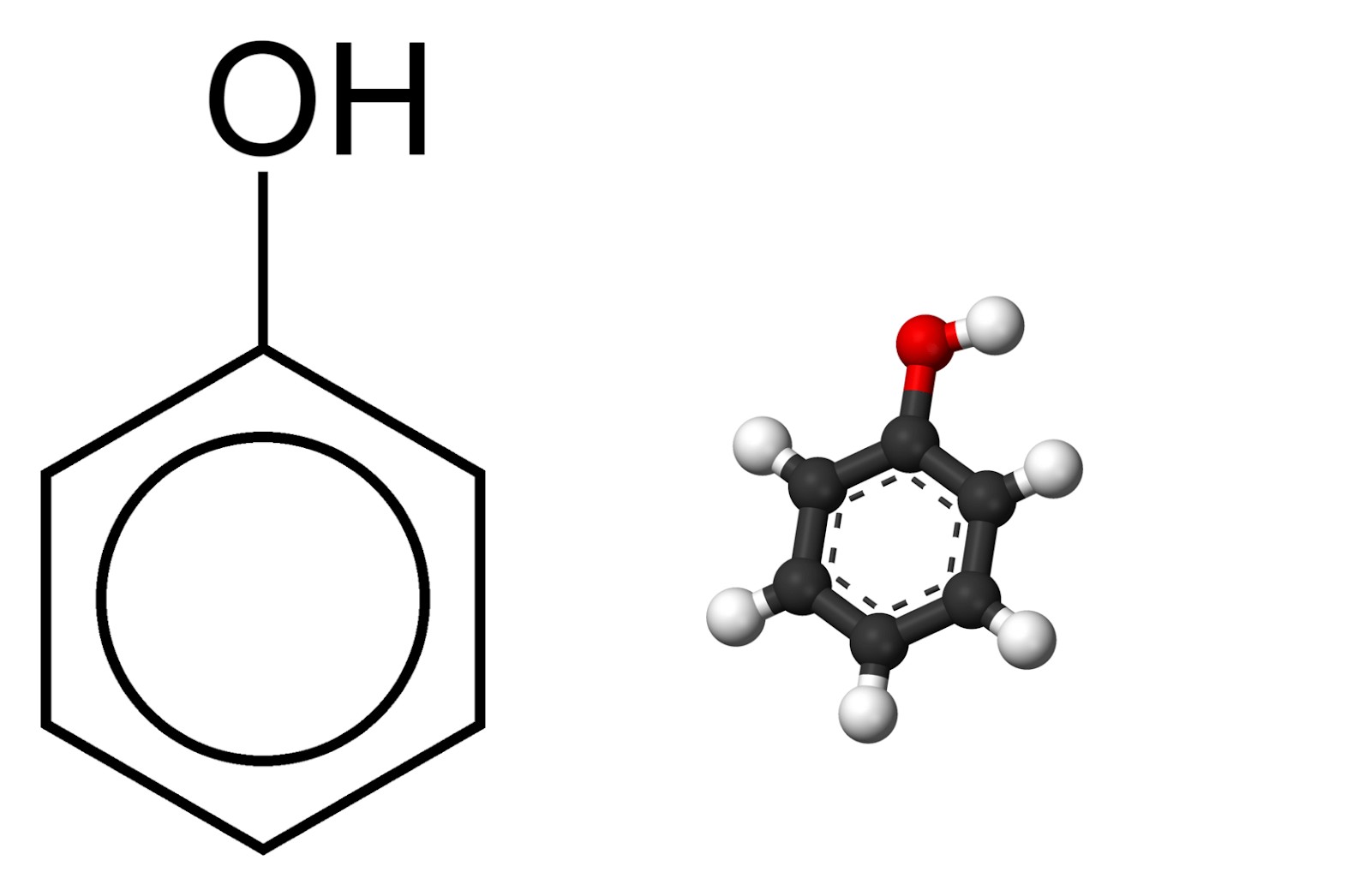 Công thức cấu tạo của Phenol
Công thức cấu tạo của Phenol
Công thức cấu tạo của Phenol
2.4. Phenol Tác Dụng Với Axit Nitric
Phenol phản ứng với axit nitric (HNO3), sản phẩm phụ thuộc vào điều kiện phản ứng:
-
Với axit nitric loãng: Tạo thành hỗn hợp ortho-nitrophenol và para-nitrophenol.
Phương trình phản ứng:
C6H5OH + HNO3 → o-C6H4(NO2)OH + p-C6H4(NO2)OH + H2O
-
Với axit nitric đặc: Tạo thành 2,4,6-trinitrophenol (axit picric), một chất nổ mạnh.
Phương trình phản ứng:
C6H5OH + 3HNO3 → C6H2(NO2)3OH + 3H2O
Cơ chế phản ứng:
Axit nitric là một chất electrophile, tấn công vào vòng benzen của phenol. Nhóm -OH hoạt hóa vòng benzen, làm cho phản ứng xảy ra dễ dàng hơn so với benzen.
Ứng dụng:
Axit picric được sử dụng trong sản xuất thuốc nổ và thuốc nhuộm. Tuy nhiên, do tính chất nổ mạnh và nguy hiểm, việc sử dụng axit picric ngày càng hạn chế.
2.5. Phenol Tác Dụng Với Formaldehyd
Phenol phản ứng với formaldehyd (HCHO) tạo thành nhựa phenol-formaldehyd, một loại polymer quan trọng.
Phương trình phản ứng:
n C6H5OH + n HCHO → (C6H4OH-CH2)n + n H2O
Cơ chế phản ứng:
Formaldehyd phản ứng với phenol ở các vị trí ortho và para so với nhóm -OH, tạo thành các cầu nối methylene (-CH2-) giữa các vòng benzen. Phản ứng này là phản ứng trùng ngưng, tạo thành polymer mạch lớn.
Ứng dụng:
Nhựa phenol-formaldehyd được sử dụng rộng rãi trong sản xuất đồ gia dụng, vật liệu cách điện, chất kết dính, và nhiều ứng dụng khác.
2.6. Phenol Tác Dụng Với Anhydride Hoặc Chloride Axit
Phenol phản ứng với anhydride hoặc chloride axit tạo thành este.
Ví dụ:
-
Với acetic anhydride:
C6H5OH + (CH3CO)2O → CH3COOC6H5 + CH3COOH
-
Với acetyl chloride:
C6H5OH + CH3COCl → CH3COOC6H5 + HCl
Cơ chế phản ứng:
Phenol tác dụng với nhóm carbonyl (C=O) của anhydride hoặc chloride axit, tạo thành este và axit carboxylic hoặc hydrochloric acid.
Ứng dụng:
Phản ứng này được sử dụng để điều chế các este của phenol, có ứng dụng trong sản xuất hương liệu, dược phẩm và các hóa chất khác.
2.7. Phenol Tác Dụng Với Clorua Sắt (III)
Phenol phản ứng với dung dịch clorua sắt (III) (FeCl3) tạo thành dung dịch có màu tím đặc trưng.
Phương trình phản ứng tổng quát:
6ArOH + FeCl3 → [Fe(OAr)6]3- + 3H+ + 3HCl
(Trong đó ArOH là phenol hoặc dẫn xuất của phenol)
Cơ chế phản ứng:
Ion Fe3+ tạo phức với các phân tử phenol, tạo thành phức chất có màu tím.
Ứng dụng:
Phản ứng này được sử dụng để nhận biết phenol và các dẫn xuất của phenol.
2.8. Phenol Bị Oxi Hóa
Phenol dễ bị oxi hóa bởi oxi trong không khí, đặc biệt khi có ánh sáng hoặc chất xúc tác, tạo thành các sản phẩm như quinon và các sản phẩm oxy hóa khác. Đây là lý do tại sao phenol để lâu trong không khí thường bị chuyển sang màu hồng.
Phản ứng tổng quát:
C6H5OH + O2 → Các sản phẩm oxi hóa (ví dụ: quinon)
Ứng dụng:
Phản ứng oxi hóa phenol được ứng dụng trong một số quá trình tổng hợp hữu cơ, nhưng cũng là nguyên nhân gây giảm chất lượng phenol khi bảo quản.
3. Bảng Tóm Tắt Các Phản Ứng Của Phenol
Để dễ dàng theo dõi và so sánh, dưới đây là bảng tóm tắt các phản ứng quan trọng của phenol:
| Chất Phản Ứng | Sản Phẩm | Điều Kiện Phản Ứng | Ứng Dụng |
|---|---|---|---|
| Kim loại kiềm (Na, K) | Phenolat + H2 | Điều kiện thường | Điều chế phenolat |
| Dung dịch kiềm (NaOH, KOH) | Phenolat + H2O | Điều kiện thường | Tách phenol khỏi hỗn hợp |
| Nước brom (Br2) | 2,4,6-tribromophenol (kết tủa trắng) + HBr | Điều kiện thường | Nhận biết phenol |
| Axit nitric (HNO3) | o-nitrophenol, p-nitrophenol (loãng) / 2,4,6-trinitrophenol (đặc) + H2O | Loãng: nhiệt độ phòng; đặc: đun nóng | Sản xuất thuốc nổ, thuốc nhuộm (axit picric) |
| Formaldehyd (HCHO) | Nhựa phenol-formaldehyd + H2O | Nhiệt độ, xúc tác | Sản xuất nhựa, vật liệu cách điện, chất kết dính |
| Anhydride/Chloride axit | Este + axit carboxylic/HCl | Nhiệt độ, xúc tác (nếu cần) | Điều chế este |
| Clorua sắt (III) (FeCl3) | Phức chất màu tím | Điều kiện thường | Nhận biết phenol |
| Oxi (O2) | Quinon, các sản phẩm oxi hóa | Ánh sáng, chất xúc tác | (Không mong muốn, gây biến màu phenol khi bảo quản) |
4. Ảnh Hưởng Của Cấu Trúc Đến Khả Năng Phản Ứng Của Phenol
Cấu trúc phân tử của phenol đóng vai trò quan trọng trong việc quyết định khả năng phản ứng của nó.
4.1. Ảnh Hưởng Của Nhóm Hydroxyl (-OH)
- Tính axit yếu: Nhóm -OH làm cho phenol có tính axit yếu, có khả năng phản ứng với kim loại kiềm và dung dịch kiềm.
- Hoạt hóa vòng benzen: Nhóm -OH là nhóm thế loại 1, có hiệu ứng +I và +C, làm tăng mật độ electron trên vòng benzen, đặc biệt ở vị trí ortho và para, do đó hoạt hóa vòng benzen và làm cho các phản ứng thế electrophin xảy ra dễ dàng hơn.
- Ảnh hưởng đến hướng thế: Nhóm -OH định hướng các nhóm thế electrophin vào vị trí ortho và para.
4.2. Ảnh Hưởng Của Vòng Benzen
- Tính thơm: Vòng benzen làm cho phenol có tính thơm, ổn định và tham gia vào các phản ứng thế electrophin.
- Liên kết π: Các electron π trong vòng benzen tương tác với nhóm -OH, làm tăng tính linh động của nguyên tử hydro trong nhóm -OH.
4.3. Ảnh Hưởng Của Các Nhóm Thế Khác (Nếu Có)
Nếu vòng benzen của phenol có các nhóm thế khác, chúng có thể ảnh hưởng đến khả năng phản ứng của phenol:
- Nhóm thế hút electron: Làm giảm mật độ electron trên vòng benzen, giảm khả năng phản ứng thế electrophin.
- Nhóm thế đẩy electron: Làm tăng mật độ electron trên vòng benzen, tăng khả năng phản ứng thế electrophin.
- Hiệu ứng không gian: Các nhóm thế cồng kềnh có thể gây cản trở không gian, làm chậm hoặc ngăn chặn phản ứng.
5. So Sánh Khả Năng Phản Ứng Của Phenol Với Alcohol Và Benzen
Để hiểu rõ hơn về tính chất đặc trưng của phenol, chúng ta hãy so sánh khả năng phản ứng của nó với alcohol và benzen:
| Tính Chất | Phenol | Alcohol | Benzen |
|---|---|---|---|
| Tính axit | Yếu hơn axit carboxylic nhưng mạnh hơn alcohol. Tác dụng với dung dịch kiềm. | Rất yếu. Không tác dụng với dung dịch kiềm. | Không có tính axit. |
| Phản ứng thế electrophin | Vòng benzen hoạt hóa mạnh, dễ tham gia phản ứng thế electrophin (halogen hóa, nitrat hóa) ở vị trí ortho và para. | Không có phản ứng này. | Khó tham gia phản ứng thế electrophin. Cần xúc tác và điều kiện khắc nghiệt. |
| Phản ứng với FeCl3 | Tạo phức màu tím. | Không có phản ứng. | Không có phản ứng. |
| Khả năng oxi hóa | Dễ bị oxi hóa bởi oxi trong không khí. | Khó bị oxi hóa hơn phenol. | Khó bị oxi hóa. |
Kết luận: Phenol có tính chất trung gian giữa alcohol và benzen, vừa thể hiện tính chất của nhóm hydroxyl, vừa thể hiện tính chất của vòng benzen, nhưng có những đặc điểm riêng do sự tương tác giữa hai thành phần này.
6. Các Yếu Tố Ảnh Hưởng Đến Tốc Độ Phản Ứng Của Phenol
Tốc độ phản ứng của phenol có thể bị ảnh hưởng bởi nhiều yếu tố:
- Nhiệt độ: Tăng nhiệt độ thường làm tăng tốc độ phản ứng.
- Chất xúc tác: Sử dụng chất xúc tác có thể làm tăng tốc độ phản ứng bằng cách giảm năng lượng hoạt hóa. Ví dụ, trong phản ứng nitrat hóa phenol, axit sulfuric có thể được sử dụng làm chất xúc tác.
- Dung môi: Dung môi có thể ảnh hưởng đến tốc độ phản ứng bằng cách ảnh hưởng đến độ tan của các chất phản ứng, sự ổn định của các trạng thái chuyển tiếp và khả năng tạo liên kết hydro.
- Nồng độ: Tăng nồng độ của các chất phản ứng thường làm tăng tốc độ phản ứng.
- Áp suất: Trong các phản ứng có sự tham gia của chất khí, tăng áp suất có thể làm tăng tốc độ phản ứng.
- Ảnh hưởng không gian: Các nhóm thế cồng kềnh gần vị trí phản ứng có thể gây cản trở không gian, làm giảm tốc độ phản ứng.
7. An Toàn Khi Sử Dụng Và Bảo Quản Phenol
Phenol là một chất độc hại, cần được sử dụng và bảo quản cẩn thận để đảm bảo an toàn:
- Tránh tiếp xúc trực tiếp: Phenol có thể gây bỏng da, tổn thương mắt và kích ứng đường hô hấp. Cần đeo găng tay, kính bảo hộ và áo bảo hộ khi làm việc với phenol.
- Sử dụng trong khu vực thông gió: Đảm bảo khu vực làm việc có đủ thông gió để tránh hít phải hơi phenol.
- Bảo quản đúng cách: Bảo quản phenol trong bình kín, ở nơi khô ráo, thoáng mát, tránh ánh sáng trực tiếp và xa các chất oxy hóa mạnh.
- Xử lý sự cố: Nếu phenol dính vào da hoặc mắt, rửa ngay lập tức bằng nhiều nước trong ít nhất 15 phút và đến cơ sở y tế gần nhất để được điều trị.
- Tuân thủ quy định: Tuân thủ các quy định về an toàn hóa chất và xử lý chất thải nguy hại.
 Rửa ngay với nước sạch khi C6H5OH dính vào da, mắt
Rửa ngay với nước sạch khi C6H5OH dính vào da, mắt
Rửa ngay với nước sạch khi Phenol dính vào da, mắt
8. FAQ: Các Câu Hỏi Thường Gặp Về Khả Năng Phản Ứng Của Phenol
-
Phenol có làm đổi màu quỳ tím không?
Không, dung dịch phenol không làm đổi màu quỳ tím vì tính axit của nó rất yếu. -
Phenol tác dụng với dung dịch muối ăn (NaCl) không?
Không, phenol không phản ứng với dung dịch muối ăn (NaCl). -
Tại sao phenol dễ tham gia phản ứng thế electrophin hơn benzen?
Do nhóm -OH hoạt hóa vòng benzen, làm tăng mật độ electron trên vòng và định hướng các nhóm thế vào vị trí ortho và para. -
Phản ứng nào được dùng để nhận biết phenol?
Phản ứng với nước brom tạo kết tủa trắng 2,4,6-tribromophenol và phản ứng với dung dịch clorua sắt (III) tạo dung dịch màu tím. -
Phenol có tác dụng với bazơ yếu như NaHCO3 không?
Không, phenol không đủ mạnh để phản ứng với bazơ yếu như NaHCO3. -
Sản phẩm chính của phản ứng giữa phenol và axit nitric loãng là gì?
Hỗn hợp ortho-nitrophenol và para-nitrophenol. -
Nhựa phenol-formaldehyd được tạo ra từ phản ứng nào?
Phản ứng giữa phenol và formaldehyd (HCHO). -
Phenol có tác dụng với kim loại đồng (Cu) không?
Không, phenol không phản ứng với kim loại đồng (Cu) trong điều kiện thông thường. -
Tại sao phenol để lâu trong không khí bị chuyển sang màu hồng?
Do phenol bị oxi hóa bởi oxi trong không khí, tạo thành các sản phẩm có màu. -
Phenol có thể phản ứng với chất nào để tạo thành thuốc nổ?
Phản ứng với axit nitric đặc tạo thành 2,4,6-trinitrophenol (axit picric), một chất nổ mạnh.
9. Kết Luận
Hy vọng bài viết này của Xe Tải Mỹ Đình đã cung cấp cho bạn cái nhìn toàn diện về các phản ứng của phenol. Phenol là một hợp chất hóa học đa năng với nhiều ứng dụng quan trọng, nhưng cũng cần được sử dụng và bảo quản cẩn thận để đảm bảo an toàn. Nếu bạn có bất kỳ thắc mắc nào về xe tải hoặc các vấn đề liên quan đến vận tải, đừng ngần ngại liên hệ với chúng tôi tại XETAIMYDINH.EDU.VN để được tư vấn và giải đáp tận tình.
Bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải ở Mỹ Đình? Bạn muốn so sánh giá cả và thông số kỹ thuật giữa các dòng xe, hay cần tư vấn lựa chọn xe phù hợp với nhu cầu và ngân sách? Hãy truy cập ngay XETAIMYDINH.EDU.VN hoặc liên hệ với chúng tôi qua hotline 0247 309 9988 để được hỗ trợ tốt nhất. Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội. Xe Tải Mỹ Đình luôn sẵn sàng đồng hành cùng bạn trên mọi nẻo đường!