Bạn đang tìm hiểu về phenol lỏng và thắc mắc về khả năng phản ứng của nó? Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN) sẽ cung cấp cho bạn những thông tin chi tiết và chính xác nhất về phenol, đặc biệt là khả năng phản ứng của phenol lỏng với các chất khác nhau. Hiểu rõ điều này giúp bạn sử dụng phenol một cách an toàn và hiệu quả. Cùng khám phá các đặc tính lý hóa, ứng dụng thực tế và những lưu ý quan trọng khi làm việc với phenol để đảm bảo an toàn cho bản thân và môi trường.
1. Phenol Là Gì? Tìm Hiểu Tổng Quan Về Phenol
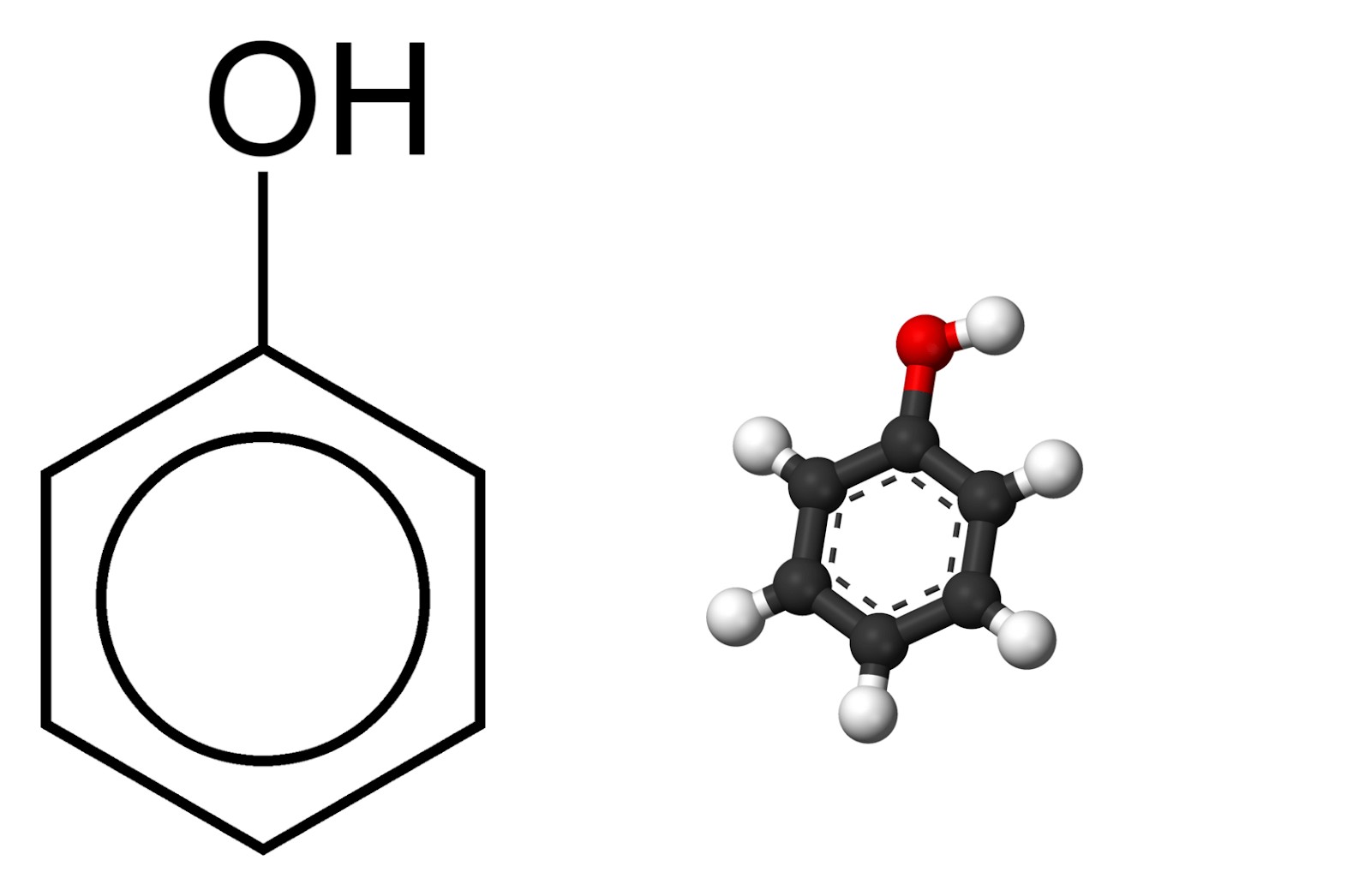
Phenol là một hợp chất hữu cơ thơm, trong đó nhóm hydroxyl (-OH) liên kết trực tiếp với một nguyên tử carbon của vòng benzen. Công thức hóa học của phenol là C6H5OH. Phenol tồn tại ở dạng tinh thể rắn màu trắng, có mùi đặc trưng và có tính axit yếu. Theo “Sách giáo trình Hóa hữu cơ” của Nhà xuất bản Giáo dục Việt Nam, phenol là một trong những hợp chất quan trọng trong hóa học hữu cơ, được sử dụng rộng rãi trong nhiều ngành công nghiệp.
 Công thức cấu tạo của Phenol
Công thức cấu tạo của Phenol
Công thức cấu tạo của Phenol
1.1. Cấu Trúc Phân Tử Phenol
Phân tử phenol bao gồm một vòng benzen (C6H5) liên kết với một nhóm hydroxyl (-OH). Nhóm -OH này quyết định các tính chất hóa học đặc trưng của phenol. Sự liên kết trực tiếp giữa nhóm -OH và vòng benzen làm tăng tính axit của phenol so với các alcohol thông thường.
1.2. Tính Chất Vật Lý Của Phenol
- Trạng thái: Tinh thể rắn màu trắng.
- Mùi: Mùi đặc trưng, hắc.
- Điểm nóng chảy: 40-43°C.
- Điểm sôi: 180-182°C.
- Độ tan: Tan ít trong nước lạnh, tan tốt trong dung môi hữu cơ như ethanol, ether. Theo “Sổ tay Hóa chất” của Nhà xuất bản Khoa học và Kỹ thuật, độ tan của phenol trong nước ở 20°C là khoảng 8.3g/100ml.
- Tính hút ẩm: Dễ bị oxy hóa và chuyển sang màu hồng khi tiếp xúc với không khí.
1.3. Tính Chất Hóa Học Đặc Trưng Của Phenol
Phenol có tính chất hóa học đa dạng, chủ yếu do ảnh hưởng của nhóm -OH và vòng benzen.
- Tính axit yếu: Phenol có tính axit yếu hơn axit cacboxylic nhưng mạnh hơn alcohol.
- Phản ứng thế electrophin: Vòng benzen của phenol dễ tham gia các phản ứng thế electrophin hơn so với benzen thông thường.
- Phản ứng với dung dịch kiềm: Phenol phản ứng với dung dịch kiềm tạo thành phenolat.
- Phản ứng với nước brom: Phenol phản ứng mạnh mẽ với nước brom tạo thành kết tủa trắng 2,4,6-tribromophenol.
2. Phenol Lỏng: Trạng Thái Và Đặc Điểm
Phenol lỏng là trạng thái của phenol khi ở nhiệt độ trên điểm nóng chảy của nó (40-43°C). Ở trạng thái này, phenol vẫn giữ nguyên các tính chất hóa học đặc trưng, nhưng có thêm một số đặc điểm riêng do trạng thái vật lý.
2.1. Điều Kiện Để Phenol Tồn Tại Ở Dạng Lỏng
Để phenol tồn tại ở dạng lỏng, nhiệt độ phải được duy trì trên điểm nóng chảy của nó. Điều này có thể đạt được bằng cách sử dụng hệ thống gia nhiệt hoặc bằng cách hòa tan phenol trong dung môi thích hợp.
2.2. Ưu Điểm Khi Sử Dụng Phenol Ở Dạng Lỏng
- Dễ dàng thao tác và đo lường: Phenol lỏng dễ dàng được bơm, rót và đo lường hơn so với phenol rắn.
- Phản ứng nhanh hơn: Các phản ứng hóa học thường xảy ra nhanh hơn trong pha lỏng so với pha rắn.
- Đồng nhất hơn: Phenol lỏng dễ dàng trộn lẫn với các chất khác, tạo ra hỗn hợp đồng nhất hơn.
2.3. Nhược Điểm Cần Lưu Ý Của Phenol Lỏng
- Nguy cơ bỏng: Phenol lỏng có thể gây bỏng nếu tiếp xúc với da.
- Dễ bay hơi: Phenol lỏng dễ bay hơi, tạo ra hơi độc hại.
- Khó bảo quản: Phenol lỏng cần được bảo quản trong điều kiện đặc biệt để tránh bị oxy hóa và hấp thụ độ ẩm.
3. Phenol Lỏng Không Có Khả Năng Phản Ứng Với Những Chất Nào?
Vậy, “Phenol Lỏng Không Có Khả Năng Phản ứng Với” những chất nào? Dưới đây là danh sách chi tiết:
Phenol lỏng không phản ứng với các chất sau:
- Muối trung tính: Ví dụ: NaCl, KCl.
- Axit yếu: Ví dụ: H2CO3, H2S.
- Kim loại kém hoạt động: Ví dụ: Cu, Ag, Au.
- Oxit trung tính: Ví dụ: CO, NO.
- Hydrocarbon no: Ví dụ: methane, ethane.
Bảng tóm tắt khả năng phản ứng của phenol lỏng với một số chất:
| Chất | Phản ứng không? | Giải thích |
|---|---|---|
| NaOH | Có | Phản ứng tạo thành phenolat |
| HCl | Không | Phenol là axit yếu, không phản ứng với axit clohidric |
| Nước brom (Br2) | Có | Phản ứng tạo kết tủa trắng 2,4,6-tribromophenol |
| NaCl | Không | Phenol không phản ứng với muối trung tính |
| NaHCO3 | Không | Phenol có tính axit yếu hơn axit cacbonic, không phản ứng với natri bicacbonat |
| Kim loại Na | Có | Phản ứng tạo thành phenolat và giải phóng khí hydro |
| Dung dịch FeCl3 | Có | Phản ứng tạo phức màu tím |
| Dung dịch H2SO4 loãng | Có (đun nóng) | Phản ứng sunfon hóa (sulfonation) vòng benzen ở nhiệt độ cao |
3.1. Giải Thích Chi Tiết Về Sự Không Phản Ứng
- Với muối trung tính (Ví dụ: NaCl): Phenol không có khả năng phản ứng với các muối trung tính như NaCl vì phản ứng giữa phenol và NaCl không tạo ra sản phẩm mới bền vững hơn. Phenol là một axit yếu, và NaCl là một muối của một axit mạnh (HCl) và một bazơ mạnh (NaOH). Do đó, không có đủ động lực hóa học để xảy ra phản ứng.
- Với axit yếu (Ví dụ: H2CO3): Phenol có tính axit, mặc dù yếu. Do đó, nó không phản ứng với các axit yếu khác như H2CO3. Để phản ứng xảy ra, cần có sự khác biệt đáng kể về tính axit giữa hai chất phản ứng.
- Với kim loại kém hoạt động (Ví dụ: Cu, Ag, Au): Phenol chỉ phản ứng với các kim loại kiềm hoặc kiềm thổ mạnh để tạo thành phenolat và giải phóng khí hydro. Các kim loại kém hoạt động như Cu, Ag, Au không đủ khả năng oxy hóa để phản ứng với phenol.
- Với oxit trung tính (Ví dụ: CO, NO): Oxit trung tính như CO và NO không có tính axit hoặc bazơ, và do đó không phản ứng với phenol.
- Với hydrocarbon no (Ví dụ: Methane, Ethane): Hydrocarbon no là các hợp chất rất trơ về mặt hóa học và không phản ứng với phenol trong điều kiện thông thường.
3.2. Điều Gì Quyết Định Khả Năng Phản Ứng Của Phenol?
Khả năng phản ứng của phenol phụ thuộc vào nhiều yếu tố, bao gồm:
- Tính chất của chất phản ứng: Chất phản ứng phải có khả năng tương tác với nhóm -OH hoặc vòng benzen của phenol.
- Điều kiện phản ứng: Nhiệt độ, áp suất, chất xúc tác có thể ảnh hưởng đến khả năng phản ứng của phenol.
- Cấu trúc phân tử của phenol: Các nhóm thế trên vòng benzen có thể ảnh hưởng đến khả năng phản ứng của phenol.
Ví dụ, phenol dễ dàng phản ứng với các chất có tính kiềm mạnh như NaOH vì nhóm -OH của phenol có tính axit yếu. Tuy nhiên, phenol không phản ứng với các axit yếu như H2CO3 vì cả hai chất đều có tính axit.
4. Các Phản Ứng Hóa Học Quan Trọng Của Phenol
Mặc dù phenol không phản ứng với một số chất, nó lại tham gia vào nhiều phản ứng hóa học quan trọng, có ứng dụng rộng rãi trong công nghiệp và đời sống.
4.1. Phản Ứng Với Dung Dịch Kiềm (NaOH)
Phenol phản ứng với dung dịch kiềm mạnh như NaOH tạo thành natri phenolat và nước:
C6H5OH + NaOH → C6H5ONa + H2O
Phản ứng này chứng minh tính axit yếu của phenol. Natri phenolat là một muối, tan tốt trong nước.
4.2. Phản Ứng Với Nước Brom (Br2)
Phenol phản ứng mạnh mẽ với nước brom tạo thành kết tủa trắng 2,4,6-tribromophenol:
C6H5OH + 3Br2 → C6H2Br3OH + 3HBr
Phản ứng này được sử dụng để nhận biết phenol.
4.3. Phản Ứng Với Axit Nitric (HNO3)
Phenol phản ứng với axit nitric tạo thành nitrophenol. Tùy thuộc vào điều kiện phản ứng, sản phẩm có thể là hỗn hợp các đồng phân ortho-, para-nitrophenol hoặc 2,4,6-trinitrophenol (axit picric):
C6H5OH + HNO3 → o-nitrophenol + p-nitrophenol + H2O
C6H5OH + 3HNO3 → C6H2(NO2)3OH + 3H2O (axit picric)
Axit picric là một chất nổ mạnh.
4.4. Phản Ứng Với Formaldehyde (HCHO)
Phenol phản ứng với formaldehyde tạo thành nhựa phenol-formaldehyde, một loại nhựa nhiệt rắn quan trọng:
nC6H5OH + nHCHO → (C6H4OH-CH2)n + nH2O
Nhựa phenol-formaldehyde được sử dụng để sản xuất vật liệu cách điện, chất kết dính và nhiều sản phẩm khác.
4.5. Phản Ứng Cộng Hợp (Ví dụ: Hydro hóa)
Phenol có thể tham gia phản ứng cộng hợp, ví dụ như phản ứng hydro hóa để tạo thành cyclohexanol:
C6H5OH + 3H2 → C6H11OH
Phản ứng này cần xúc tác kim loại như niken (Ni) hoặc platin (Pt).
5. Ứng Dụng Quan Trọng Của Phenol Trong Đời Sống Và Công Nghiệp
Phenol và các dẫn xuất của nó có nhiều ứng dụng quan trọng trong đời sống và công nghiệp:
- Sản xuất nhựa: Phenol là nguyên liệu chính để sản xuất nhựa phenol-formaldehyde, được sử dụng trong sản xuất vật liệu cách điện, chất kết dính, và các sản phẩm ép.
- Sản xuất thuốc: Phenol được sử dụng để tổng hợp nhiều loại thuốc, bao gồm aspirin, thuốc giảm đau, và thuốc kháng sinh.
- Chất khử trùng: Phenol có tính khử trùng, được sử dụng trong các sản phẩm vệ sinh và khử trùng.
- Sản xuất thuốc nhuộm: Phenol là nguyên liệu để sản xuất nhiều loại thuốc nhuộm và phẩm màu.
- Sản xuất thuốc trừ sâu và diệt cỏ: Một số dẫn xuất của phenol được sử dụng làm thuốc trừ sâu và diệt cỏ.
- Chất bảo quản: Phenol và các dẫn xuất của nó được sử dụng làm chất bảo quản trong mỹ phẩm và dược phẩm.
 Ứng dụng của C6H5OH trong thuốc diệt cỏ
Ứng dụng của C6H5OH trong thuốc diệt cỏ
Ứng dụng của C6H5OH trong thuốc diệt cỏ
6. Lưu Ý Quan Trọng Khi Sử Dụng Và Bảo Quản Phenol
Phenol là một chất độc hại, cần được sử dụng và bảo quản cẩn thận để đảm bảo an toàn.
6.1. Biện Pháp An Toàn Khi Tiếp Xúc Với Phenol
- Sử dụng thiết bị bảo hộ cá nhân: Đeo kính bảo hộ, găng tay, áo choàng khi làm việc với phenol.
- Tránh tiếp xúc trực tiếp: Không để phenol tiếp xúc với da, mắt, hoặc quần áo.
- Làm việc trong khu vực thông gió: Đảm bảo khu vực làm việc được thông gió tốt để tránh hít phải hơi phenol.
- Rửa sạch ngay lập tức: Nếu phenol tiếp xúc với da hoặc mắt, rửa sạch ngay lập tức bằng nhiều nước và đến cơ sở y tế gần nhất.
- Không ăn uống trong khu vực làm việc: Tránh ăn uống hoặc hút thuốc trong khu vực làm việc để ngăn ngừa nuốt phải phenol.
6.2. Cách Bảo Quản Phenol An Toàn
- Bảo quản trong容器 kín: Phenol cần được bảo quản trong容器 kín, làm bằng vật liệu không phản ứng với phenol.
- Để ở nơi khô ráo, thoáng mát: Tránh ánh nắng trực tiếp và nhiệt độ cao.
- Tránh xa các chất oxy hóa mạnh: Phenol có thể phản ứng mạnh với các chất oxy hóa mạnh, gây cháy nổ.
- Để xa tầm tay trẻ em: Đảm bảo phenol được bảo quản ở nơi trẻ em không thể tiếp cận.
- Tuân thủ quy định về an toàn hóa chất: Tham khảo và tuân thủ các quy định về an toàn hóa chất của địa phương và quốc gia.
6.3. Xử Lý Sự Cố Khi Tiếp Xúc Với Phenol
- Nếu phenol tiếp xúc với da: Rửa sạch vùng da bị tiếp xúc bằng nhiều nước và xà phòng. Nếu có dấu hiệu bỏng, đến cơ sở y tế ngay lập tức.
- Nếu phenol tiếp xúc với mắt: Rửa mắt bằng nhiều nước trong ít nhất 15 phút. Đến cơ sở y tế ngay lập tức.
- Nếu hít phải hơi phenol: Di chuyển đến nơi thoáng khí. Nếu khó thở, cần được cấp cứu y tế.
- Nếu nuốt phải phenol: Không gây nôn. Uống nhiều nước và đến cơ sở y tế ngay lập tức.
7. Độc Tính Của Phenol Và Ảnh Hưởng Đến Sức Khỏe
Phenol là một chất độc hại, có thể gây ra nhiều vấn đề sức khỏe nếu tiếp xúc với nồng độ cao hoặc trong thời gian dài.
7.1. Ảnh Hưởng Đến Môi Trường
Phenol là một chất ô nhiễm môi trường. Nó có thể gây ô nhiễm nguồn nước và đất, ảnh hưởng đến hệ sinh thái. Phenol có thể tích lũy trong cơ thể sinh vật và gây ra các vấn đề sức khỏe cho động vật và con người.
7.2. Ảnh Hưởng Đến Sức Khỏe Con Người
- Ngộ độc cấp tính: Tiếp xúc với phenol ở nồng độ cao có thể gây ra các triệu chứng như buồn nôn, nôn mửa, đau đầu, chóng mặt, khó thở, co giật, và hôn mê.
- Ngộ độc mãn tính: Tiếp xúc với phenol ở nồng độ thấp trong thời gian dài có thể gây ra các vấn đề về da, hệ thần kinh, gan, và thận.
- Gây bỏng: Phenol có thể gây bỏng da và mắt nếu tiếp xúc trực tiếp.
- Gây kích ứng: Hơi phenol có thể gây kích ứng đường hô hấp và mắt.
- Ảnh hưởng đến hệ thần kinh: Phenol có thể gây ra các vấn đề về trí nhớ, tập trung, và giấc ngủ.
- Ảnh hưởng đến hệ tim mạch: Phenol có thể gây ra các vấn đề về tim mạch như tăng huyết áp và rối loạn nhịp tim.
7.3. Biện Pháp Phòng Ngừa Ngộ Độc Phenol
- Sử dụng phenol đúng cách: Tuân thủ các hướng dẫn sử dụng và bảo quản phenol.
- Sử dụng thiết bị bảo hộ cá nhân: Đeo kính bảo hộ, găng tay, áo choàng khi làm việc với phenol.
- Làm việc trong khu vực thông gió: Đảm bảo khu vực làm việc được thông gió tốt.
- Kiểm tra sức khỏe định kỳ: Những người làm việc với phenol nên được kiểm tra sức khỏe định kỳ để phát hiện sớm các vấn đề sức khỏe liên quan đến phenol.
- Giáo dục và đào tạo: Cung cấp giáo dục và đào tạo cho người lao động về các nguy cơ và biện pháp phòng ngừa khi làm việc với phenol.
8. Điều Chế Phenol: Các Phương Pháp Phổ Biến
Phenol có thể được điều chế bằng nhiều phương pháp khác nhau, từ các nguyên liệu khác nhau.
8.1. Từ Benzen
Một trong những phương pháp phổ biến nhất để điều chế phenol là từ benzen.
- Phương pháp cumene: Benzen được alkyl hóa với propylen để tạo thành cumene. Cumene sau đó được oxy hóa để tạo thành cumene hydroperoxide, sau đó được phân hủy bằng axit để tạo thành phenol và acetone.
- Phương pháp chlorobenzene: Benzen được clo hóa để tạo thành chlorobenzene. Chlorobenzene sau đó được thủy phân bằng dung dịch NaOH ở nhiệt độ và áp suất cao để tạo thành phenol.
- Phương pháp sulfon hóa: Benzen được sulfon hóa để tạo thành benzenesulfonic acid. Benzenesulfonic acid sau đó được trung hòa bằng NaOH và nung chảy với NaOH để tạo thành phenol.
8.2. Từ Nhựa Than Đá
Phenol cũng có thể được tách ra từ nhựa than đá, một sản phẩm phụ của quá trình sản xuất than cốc.
- Tách phenol bằng NaOH: Nhựa than đá được xử lý bằng dung dịch NaOH để tạo thành natri phenolat. Natri phenolat sau đó được axit hóa để thu được phenol.
8.3. Các Phương Pháp Điều Chế Khác
Ngoài các phương pháp trên, phenol cũng có thể được điều chế bằng các phương pháp khác như:
- Oxy hóa toluene: Toluene được oxy hóa để tạo thành benzoic acid, sau đó được chuyển đổi thành phenol.
- Phân hủy lignin: Lignin, một thành phần của gỗ, có thể được phân hủy để tạo thành phenol và các sản phẩm khác.
9. FAQ – Câu Hỏi Thường Gặp Về Phenol
Dưới đây là một số câu hỏi thường gặp về phenol:
- Phenol có độc không?
- Có, phenol là một chất độc hại và có thể gây ra các vấn đề sức khỏe nếu tiếp xúc với nồng độ cao hoặc trong thời gian dài.
- Phenol có tan trong nước không?
- Phenol tan ít trong nước lạnh, nhưng tan tốt trong dung môi hữu cơ như ethanol, ether.
- Phenol có làm đổi màu quỳ tím không?
- Không, dung dịch phenol không làm đổi màu quỳ tím vì tính axit của nó rất yếu.
- Phenol có phản ứng với NaOH không?
- Có, phenol phản ứng với NaOH tạo thành natri phenolat và nước.
- Phenol có phản ứng với nước brom không?
- Có, phenol phản ứng mạnh mẽ với nước brom tạo thành kết tủa trắng 2,4,6-tribromophenol.
- Phenol được sử dụng để làm gì?
- Phenol được sử dụng để sản xuất nhựa, thuốc, chất khử trùng, thuốc nhuộm, thuốc trừ sâu, và chất bảo quản.
- Làm thế nào để bảo quản phenol an toàn?
- Phenol cần được bảo quản trong容器 kín, ở nơi khô ráo, thoáng mát, tránh ánh nắng trực tiếp và nhiệt độ cao.
- Nếu phenol tiếp xúc với da thì phải làm gì?
- Rửa sạch vùng da bị tiếp xúc bằng nhiều nước và xà phòng. Nếu có dấu hiệu bỏng, đến cơ sở y tế ngay lập tức.
- Phenol có gây ô nhiễm môi trường không?
- Có, phenol là một chất ô nhiễm môi trường và có thể gây ô nhiễm nguồn nước và đất.
- Phương pháp nào phổ biến để điều chế phenol từ benzen?
- Phương pháp cumene là một trong những phương pháp phổ biến nhất để điều chế phenol từ benzen.
10. Tại Sao Nên Tìm Hiểu Về Xe Tải Tại Xe Tải Mỹ Đình?
Bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải ở Mỹ Đình? Hãy đến với XETAIMYDINH.EDU.VN, nơi bạn sẽ tìm thấy:
- Thông tin đa dạng và cập nhật: Xe Tải Mỹ Đình cung cấp thông tin chi tiết về các loại xe tải, giá cả, thông số kỹ thuật, và các dịch vụ liên quan đến xe tải ở khu vực Mỹ Đình và các tỉnh lân cận.
- Tư vấn chuyên nghiệp: Đội ngũ chuyên gia của chúng tôi sẵn sàng tư vấn và giải đáp mọi thắc mắc của bạn về việc lựa chọn, mua bán, và bảo dưỡng xe tải.
- Địa chỉ uy tín: Xe Tải Mỹ Đình là địa chỉ tin cậy để bạn tìm kiếm các dịch vụ sửa chữa, bảo dưỡng xe tải chất lượng cao trong khu vực.
Lời kêu gọi hành động (CTA):
Bạn còn bất kỳ thắc mắc nào về xe tải ở Mỹ Đình? Hãy truy cập ngay XETAIMYDINH.EDU.VN hoặc liên hệ với chúng tôi qua hotline 0247 309 9988 để được tư vấn và giải đáp mọi thắc mắc. Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội. Xe Tải Mỹ Đình luôn sẵn sàng đồng hành cùng bạn trên mọi nẻo đường!
 Phenol chuyển hồng khi để lâu trong không khí
Phenol chuyển hồng khi để lâu trong không khí
Phenol chuyển hồng khi để lâu trong không khí