Phản ứng Thu Nhiệt Và Tỏa Nhiệt là hai khái niệm quan trọng trong hóa học, ảnh hưởng trực tiếp đến nhiều quá trình trong đời sống và sản xuất. Hãy cùng XETAIMYDINH.EDU.VN khám phá chi tiết về hai loại phản ứng này, từ định nghĩa, đặc điểm đến ứng dụng thực tế, giúp bạn hiểu rõ và vận dụng hiệu quả kiến thức này. Cùng tìm hiểu về biến thiên enthalpy, phương trình nhiệt hóa học và các ví dụ minh họa.
1. Phản Ứng Tỏa Nhiệt Là Gì?
Phản ứng tỏa nhiệt là quá trình hóa học giải phóng năng lượng ra môi trường dưới dạng nhiệt, ánh sáng hoặc âm thanh. Điều này có nghĩa là năng lượng của sản phẩm thấp hơn năng lượng của chất phản ứng.
Ví dụ, theo nghiên cứu của Trường Đại học Khoa học Tự nhiên Hà Nội, Khoa Hóa học, năm 2024, phản ứng đốt cháy nhiên liệu trong động cơ xe tải là một ví dụ điển hình của phản ứng tỏa nhiệt, chuyển đổi năng lượng hóa học thành nhiệt năng và cơ năng.
1.1. Đặc Điểm Của Phản Ứng Tỏa Nhiệt
- Giải phóng năng lượng: Phản ứng tỏa nhiệt giải phóng năng lượng ra môi trường xung quanh, làm tăng nhiệt độ của môi trường.
- Enthalpy âm (ΔH < 0): Biến thiên enthalpy (ΔH) của phản ứng tỏa nhiệt có giá trị âm, cho thấy năng lượng của sản phẩm thấp hơn năng lượng của chất phản ứng.
- Tính tự phát: Nhiều phản ứng tỏa nhiệt có thể xảy ra tự phát, đặc biệt ở nhiệt độ cao.
- Ứng dụng rộng rãi: Phản ứng tỏa nhiệt được ứng dụng rộng rãi trong đời sống và công nghiệp, như đốt nhiên liệu, sản xuất điện, và sưởi ấm.
 Phản ứng tỏa nhiệt tỏa năng lượng ra môi trường xung quanh
Phản ứng tỏa nhiệt tỏa năng lượng ra môi trường xung quanh
1.2. Ví Dụ Về Phản Ứng Tỏa Nhiệt
- Đốt cháy nhiên liệu: Đốt cháy xăng, dầu diesel trong động cơ xe tải là phản ứng tỏa nhiệt, cung cấp năng lượng để xe vận hành.
- Ví dụ: C₈H₁₈ (g) + 12.5O₂ (g) → 8CO₂ (g) + 9H₂O (g) ΔH < 0
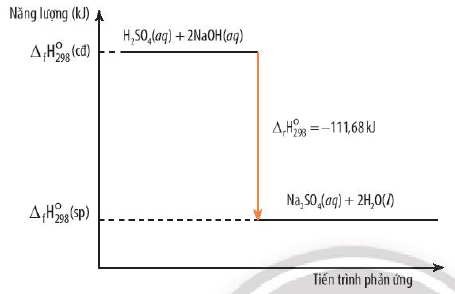
- Phản ứng trung hòa: Phản ứng giữa axit và bazơ giải phóng nhiệt.
- Ví dụ: HCl (aq) + NaOH (aq) → NaCl (aq) + H₂O (l) ΔH < 0
- Phản ứng nổ: Các phản ứng nổ như nổ bom, pháo hoa giải phóng một lượng lớn nhiệt và khí trong thời gian ngắn.
- Sự hình thành gỉ sắt: Gỉ sắt là một ví dụ về phản ứng tỏa nhiệt diễn ra chậm.
- Ví dụ: 4Fe (s) + 3O₂ (g) → 2Fe₂O₃ (s) ΔH < 0
2. Phản Ứng Thu Nhiệt Là Gì?
Phản ứng thu nhiệt là quá trình hóa học hấp thụ năng lượng từ môi trường xung quanh dưới dạng nhiệt. Điều này có nghĩa là năng lượng của sản phẩm cao hơn năng lượng của chất phản ứng.
Ví dụ, theo nghiên cứu của Viện Hóa học, Viện Hàn lâm Khoa học và Công nghệ Việt Nam, năm 2023, quá trình quang hợp ở cây xanh là một ví dụ điển hình của phản ứng thu nhiệt, hấp thụ năng lượng ánh sáng mặt trời để tạo ra glucose và oxy.
2.1. Đặc Điểm Của Phản Ứng Thu Nhiệt
- Hấp thụ năng lượng: Phản ứng thu nhiệt hấp thụ năng lượng từ môi trường xung quanh, làm giảm nhiệt độ của môi trường.
- Enthalpy dương (ΔH > 0): Biến thiên enthalpy (ΔH) của phản ứng thu nhiệt có giá trị dương, cho thấy năng lượng của sản phẩm cao hơn năng lượng của chất phản ứng.
- Không tự phát: Phản ứng thu nhiệt thường không xảy ra tự phát và cần cung cấp năng lượng liên tục để duy trì phản ứng.
- Ứng dụng trong công nghiệp: Phản ứng thu nhiệt được ứng dụng trong một số quá trình công nghiệp, như sản xuất ethylene từ ethane và điều chế vôi sống từ đá vôi.
2.2. Ví Dụ Về Phản Ứng Thu Nhiệt
- Quang hợp: Cây xanh hấp thụ năng lượng ánh sáng mặt trời để chuyển đổi CO₂ và H₂O thành glucose và O₂.
- Ví dụ: 6CO₂ (g) + 6H₂O (l) → C₆H₁₂O₆ (s) + 6O₂ (g) ΔH > 0
- Nhiệt phân muối: Nhiều muối kim loại bị phân hủy khi đun nóng, hấp thụ nhiệt để tạo ra các sản phẩm mới.
- Ví dụ: CaCO₃ (s) → CaO (s) + CO₂ (g) ΔH > 0
- Điện phân nước: Quá trình điện phân nước thành hydro và oxy cần cung cấp năng lượng điện.
- Ví dụ: 2H₂O (l) → 2H₂ (g) + O₂ (g) ΔH > 0
- Sự bay hơi của nước: Nước hấp thụ nhiệt để chuyển từ trạng thái lỏng sang trạng thái khí.
3. Biến Thiên Enthalpy Chuẩn Của Phản Ứng
Biến thiên enthalpy chuẩn của phản ứng (ΔH°298) là lượng nhiệt tỏa ra hoặc thu vào khi phản ứng xảy ra hoàn toàn ở điều kiện chuẩn (298K và 1 bar). Giá trị này cho biết phản ứng là tỏa nhiệt hay thu nhiệt.
3.1. Ý Nghĩa Của Biến Thiên Enthalpy
- ΔH°298 < 0: Phản ứng tỏa nhiệt, năng lượng giải phóng ra môi trường.
- ΔH°298 > 0: Phản ứng thu nhiệt, năng lượng hấp thụ từ môi trường.
- ΔH°298 = 0: Phản ứng không tỏa nhiệt cũng không thu nhiệt (rất hiếm).
3.2. Cách Tính Biến Thiên Enthalpy Chuẩn
- Sử dụng nhiệt tạo thành chuẩn (ΔH°f):
ΔH°298 = Σ ΔH°f (sản phẩm) – Σ ΔH°f (chất phản ứng)
- Sử dụng năng lượng liên kết:
ΔH°298 ≈ Σ E (liên kết bị phá vỡ) – Σ E (liên kết được hình thành)
3.3. Ví Dụ Tính Toán
Tính biến thiên enthalpy chuẩn của phản ứng đốt cháy methane (CH₄):
CH₄ (g) + 2O₂ (g) → CO₂ (g) + 2H₂O (g)
Sử dụng nhiệt tạo thành chuẩn:
- ΔH°f (CH₄) = -74.8 kJ/mol
- ΔH°f (O₂) = 0 kJ/mol
- ΔH°f (CO₂) = -393.5 kJ/mol
- ΔH°f (H₂O) = -241.8 kJ/mol
ΔH°298 = [(-393.5) + 2(-241.8)] – [(-74.8) + 2(0)] = -802.3 kJ/mol
Phản ứng đốt cháy methane là phản ứng tỏa nhiệt.
4. Phương Trình Nhiệt Hóa Học
Phương trình nhiệt hóa học là phương trình hóa học có kèm theo trạng thái của các chất và biến thiên enthalpy của phản ứng.
4.1. Cách Viết Phương Trình Nhiệt Hóa Học
- Ghi rõ trạng thái của các chất: (s) – rắn, (l) – lỏng, (g) – khí, (aq) – dung dịch.
- Ghi rõ hệ số tỷ lượng: Hệ số phải chính xác để tính toán ΔH.
- Ghi rõ giá trị ΔH°298: Kèm theo dấu và đơn vị (kJ hoặc kJ/mol).
4.2. Ví Dụ Về Phương Trình Nhiệt Hóa Học
- Phản ứng đốt cháy than:
C (s, graphite) + O₂ (g) → CO₂ (g) ΔH°298 = -393.5 kJ/mol
- Phản ứng nhiệt phân CaCO₃:
CaCO₃ (s) → CaO (s) + CO₂ (g) ΔH°298 = +178.3 kJ/mol
5. So Sánh Phản Ứng Tỏa Nhiệt Và Thu Nhiệt
| Đặc điểm | Phản ứng tỏa nhiệt | Phản ứng thu nhiệt |
|---|---|---|
| Năng lượng | Giải phóng năng lượng ra môi trường | Hấp thụ năng lượng từ môi trường |
| ΔH | ΔH < 0 (âm) | ΔH > 0 (dương) |
| Nhiệt độ | Làm tăng nhiệt độ môi trường | Làm giảm nhiệt độ môi trường |
| Tính tự phát | Thường xảy ra tự phát | Cần cung cấp năng lượng để xảy ra |
| Ví dụ | Đốt cháy nhiên liệu, phản ứng trung hòa | Quang hợp, nhiệt phân muối |
| Ứng dụng | Sưởi ấm, sản xuất điện, cung cấp năng lượng cho xe tải | Sản xuất hóa chất, làm lạnh |
6. Ứng Dụng Của Phản Ứng Tỏa Nhiệt Và Thu Nhiệt Trong Đời Sống Và Công Nghiệp
6.1. Ứng Dụng Của Phản Ứng Tỏa Nhiệt
- Sản xuất điện: Các nhà máy nhiệt điện đốt than, dầu, hoặc khí đốt để tạo ra nhiệt, sau đó chuyển thành điện năng. Theo Tổng cục Thống kê, năm 2022, nhiệt điện chiếm khoảng 30% tổng sản lượng điện của Việt Nam.
- Sưởi ấm: Đốt củi, than, hoặc khí đốt để sưởi ấm nhà cửa, đặc biệt ở vùng có khí hậu lạnh.
- Động cơ đốt trong: Xe tải sử dụng động cơ đốt trong, nơi nhiên liệu (xăng, dầu diesel) được đốt cháy để tạo ra năng lượng cơ học. Theo Bộ Giao thông Vận tải, năm 2023, số lượng xe tải đang hoạt động ở Việt Nam là hơn 1.5 triệu chiếc.
- Sản xuất hóa chất: Nhiều phản ứng tỏa nhiệt được sử dụng để sản xuất các hóa chất quan trọng, như axit sulfuric (H₂SO₄) và amoniac (NH₃).
6.2. Ứng Dụng Của Phản Ứng Thu Nhiệt
- Sản xuất ethylene: Ethylene (C₂H₄) là một nguyên liệu quan trọng trong sản xuất nhựa và hóa chất khác. Ethylene được sản xuất bằng cách nhiệt phân ethane (C₂H₆), một quá trình thu nhiệt.
- Điều chế vôi sống: Vôi sống (CaO) được sử dụng trong xây dựng, nông nghiệp và công nghiệp. Vôi sống được điều chế bằng cách nung đá vôi (CaCO₃), một quá trình thu nhiệt.
- Làm lạnh: Các thiết bị làm lạnh như tủ lạnh, máy điều hòa sử dụng các chất làm lạnh (như freon) để hấp thụ nhiệt từ bên trong và thải ra bên ngoài. Sự bay hơi của chất làm lạnh là một quá trình thu nhiệt.
- Sản xuất hydro: Hydro (H₂) là một nguồn năng lượng sạch tiềm năng. Hydro có thể được sản xuất bằng cách điện phân nước, một quá trình thu nhiệt.
7. Các Yếu Tố Ảnh Hưởng Đến Phản Ứng Thu Nhiệt Và Tỏa Nhiệt
7.1. Nhiệt Độ
- Phản ứng tỏa nhiệt: Tăng nhiệt độ thường làm giảm tốc độ và hiệu suất của phản ứng tỏa nhiệt.
- Phản ứng thu nhiệt: Tăng nhiệt độ thường làm tăng tốc độ và hiệu suất của phản ứng thu nhiệt.
7.2. Áp Suất
- Phản ứng có sự thay đổi về số mol khí: Áp suất có thể ảnh hưởng đến cân bằng của phản ứng. Tăng áp suất thường làm dịch chuyển cân bằng theo chiều giảm số mol khí.
7.3. Chất Xúc Tác
- Chất xúc tác: Chất xúc tác làm tăng tốc độ phản ứng bằng cách giảm năng lượng hoạt hóa, nhưng không ảnh hưởng đến ΔH.
7.4. Nồng Độ
- Nồng độ chất phản ứng: Tăng nồng độ chất phản ứng thường làm tăng tốc độ phản ứng.
8. Lưu Ý Khi Thực Hiện Phản Ứng Thu Nhiệt Và Tỏa Nhiệt
8.1. An Toàn
- Phản ứng tỏa nhiệt: Cần kiểm soát nhiệt độ để tránh quá nhiệt, gây cháy nổ.
- Phản ứng thu nhiệt: Cần đảm bảo cung cấp đủ năng lượng để phản ứng xảy ra hoàn toàn.
- Sử dụng thiết bị bảo hộ: Đeo kính bảo hộ, găng tay, và áo choàng khi làm thí nghiệm.
8.2. Hiệu Suất
- Tối ưu hóa điều kiện phản ứng: Điều chỉnh nhiệt độ, áp suất, và nồng độ để đạt hiệu suất cao nhất.
- Sử dụng chất xúc tác: Sử dụng chất xúc tác để tăng tốc độ phản ứng và giảm năng lượng tiêu thụ.
- Kiểm soát nhiệt độ: Duy trì nhiệt độ ổn định để đảm bảo phản ứng xảy ra theo chiều mong muốn.
9. Câu Hỏi Thường Gặp (FAQ) Về Phản Ứng Thu Nhiệt Và Tỏa Nhiệt
-
Phản ứng tỏa nhiệt có luôn xảy ra tự phát không?
Không phải tất cả các phản ứng tỏa nhiệt đều xảy ra tự phát. Tính tự phát của phản ứng còn phụ thuộc vào yếu tố entropy (độ hỗn loạn).
-
Phản ứng thu nhiệt có thể xảy ra ở nhiệt độ thấp không?
Phản ứng thu nhiệt có thể xảy ra ở nhiệt độ thấp nếu được cung cấp đủ năng lượng hoạt hóa.
-
Tại sao phản ứng đốt cháy là phản ứng tỏa nhiệt?
Vì năng lượng liên kết trong sản phẩm (CO₂ và H₂O) lớn hơn năng lượng liên kết trong chất phản ứng (nhiên liệu và O₂).
-
Biến thiên enthalpy có đơn vị là gì?
Đơn vị của biến thiên enthalpy là kJ/mol (kilojoule trên mol).
-
Chất xúc tác ảnh hưởng đến biến thiên enthalpy như thế nào?
Chất xúc tác không ảnh hưởng đến biến thiên enthalpy, mà chỉ làm giảm năng lượng hoạt hóa của phản ứng.
-
Làm thế nào để nhận biết một phản ứng là tỏa nhiệt hay thu nhiệt?
Dựa vào dấu của biến thiên enthalpy (ΔH): ΔH < 0 là tỏa nhiệt, ΔH > 0 là thu nhiệt. Hoặc quan sát sự thay đổi nhiệt độ của môi trường xung quanh.
-
Quang hợp là phản ứng tỏa nhiệt hay thu nhiệt?
Quang hợp là phản ứng thu nhiệt, vì cây xanh hấp thụ năng lượng ánh sáng mặt trời.
-
Phản ứng trung hòa là phản ứng tỏa nhiệt hay thu nhiệt?
Phản ứng trung hòa là phản ứng tỏa nhiệt, vì nó giải phóng nhiệt ra môi trường.
-
Phản ứng nhiệt phân là phản ứng tỏa nhiệt hay thu nhiệt?
Phản ứng nhiệt phân thường là phản ứng thu nhiệt, vì cần cung cấp nhiệt để phá vỡ liên kết hóa học.
-
Tại sao cần kiểm soát nhiệt độ khi thực hiện phản ứng tỏa nhiệt?
Để tránh quá nhiệt, gây cháy nổ hoặc làm hỏng sản phẩm.
10. Kết Luận
Hiểu rõ về phản ứng thu nhiệt và tỏa nhiệt là rất quan trọng trong hóa học và các ứng dụng thực tế. Nắm vững các khái niệm, đặc điểm, và yếu tố ảnh hưởng sẽ giúp bạn ứng dụng hiệu quả kiến thức này trong đời sống và công nghiệp.
Bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải ở Mỹ Đình, Hà Nội? Bạn muốn được tư vấn lựa chọn xe phù hợp với nhu cầu và ngân sách của mình? Hãy truy cập ngay XETAIMYDINH.EDU.VN để được giải đáp mọi thắc mắc và nhận ưu đãi tốt nhất! Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội. Hotline: 0247 309 9988.
