Phân tử có liên kết hydrogen là phân tử mà trong đó nguyên tử hydrogen liên kết với một nguyên tử có độ âm điện lớn như oxygen (O), nitrogen (N) hoặc fluorine (F). Hãy cùng Xe Tải Mỹ Đình tìm hiểu sâu hơn về loại liên kết đặc biệt này và tầm quan trọng của nó trong hóa học và đời sống. Bạn đang tìm kiếm thông tin đáng tin cậy về liên kết hydrogen? Hãy đọc tiếp để khám phá những điều thú vị và hữu ích, đồng thời trang bị cho mình kiến thức vững chắc về cấu trúc phân tử và tương tác giữa các chất.
1. Liên Kết Hydrogen Là Gì?
Liên kết hydrogen là một loại tương tác tĩnh điện yếu hình thành giữa một nguyên tử hydrogen (H) đã liên kết cộng hóa trị với một nguyên tử có độ âm điện cao (như oxygen, nitrogen, hoặc fluorine) và một nguyên tử có độ âm điện cao khác mang một cặp electron tự do. Theo nghiên cứu của Đại học Khoa học Tự nhiên Hà Nội, Khoa Hóa học, năm 2023, liên kết hydrogen đóng vai trò quan trọng trong việc xác định cấu trúc và tính chất của nhiều hợp chất hóa học, đặc biệt là trong các hệ thống sinh học.
1.1. Định Nghĩa Chi Tiết
Liên kết hydrogen không phải là một liên kết hóa học thực sự như liên kết cộng hóa trị hay liên kết ion, mà là một lực hút tĩnh điện giữa các phân tử hoặc giữa các phần khác nhau của cùng một phân tử. Nguyên tử hydrogen tham gia vào liên kết này phải được liên kết với một nguyên tử có độ âm điện cao, tạo ra một điện tích dương cục bộ (δ+) trên nguyên tử hydrogen. Điện tích dương này sẽ hút một nguyên tử khác có độ âm điện cao mang điện tích âm cục bộ (δ-) và có cặp electron tự do.
1.2. Điều Kiện Hình Thành Liên Kết Hydrogen
Để hình thành liên kết hydrogen, cần có hai yếu tố chính:
- Nguyên tử hydrogen liên kết với nguyên tử có độ âm điện cao: Nguyên tử hydrogen phải liên kết cộng hóa trị với một nguyên tử có độ âm điện lớn như oxygen (O), nitrogen (N) hoặc fluorine (F). Điều này tạo ra một sự phân cực trong liên kết, khiến cho nguyên tử hydrogen mang một phần điện tích dương (δ+).
- Nguyên tử có độ âm điện cao mang cặp electron tự do: Cần có một nguyên tử khác có độ âm điện cao (O, N, F) mang một cặp electron tự do để tương tác với nguyên tử hydrogen mang điện tích dương. Cặp electron tự do này sẽ tạo ra một điện tích âm cục bộ (δ-), thu hút nguyên tử hydrogen.
1.3. So Sánh Liên Kết Hydrogen Với Các Loại Liên Kết Khác
| Loại Liên Kết | Bản Chất | Độ Bền | Ví Dụ |
|---|---|---|---|
| Liên kết cộng hóa trị | Chia sẻ electron giữa các nguyên tử | Mạnh | H₂O, CH₄ |
| Liên kết ion | Chuyển electron từ nguyên tử này sang nguyên tử khác | Mạnh | NaCl, MgO |
| Liên kết hydrogen | Tương tác tĩnh điện giữa nguyên tử H và nguyên tử có độ âm điện cao | Yếu | H₂O (giữa các phân tử) |
| Tương tác Van der Waals | Tương tác lưỡng cực tạm thời giữa các phân tử | Rất yếu | He, Ne |
Như bảng trên cho thấy, liên kết hydrogen yếu hơn nhiều so với liên kết cộng hóa trị và liên kết ion, nhưng lại mạnh hơn so với tương tác Van der Waals. Tuy nhiên, liên kết hydrogen lại đóng vai trò vô cùng quan trọng trong nhiều hiện tượng tự nhiên và ứng dụng thực tiễn.
2. Các Yếu Tố Ảnh Hưởng Đến Độ Bền Của Liên Kết Hydrogen
Độ bền của liên kết hydrogen phụ thuộc vào nhiều yếu tố, bao gồm độ âm điện của các nguyên tử tham gia, khoảng cách giữa các nguyên tử và góc liên kết.
2.1. Độ Âm Điện Của Các Nguyên Tử Tham Gia
Độ âm điện của các nguyên tử tham gia liên kết hydrogen có ảnh hưởng lớn đến độ bền của liên kết. Khi độ âm điện của nguyên tử liên kết với hydrogen càng cao, liên kết càng phân cực và điện tích dương cục bộ trên nguyên tử hydrogen càng lớn. Điều này dẫn đến lực hút tĩnh điện mạnh hơn với nguyên tử có cặp electron tự do, làm tăng độ bền của liên kết hydrogen. Fluorine (F) là nguyên tố có độ âm điện cao nhất, do đó liên kết H-F tạo ra liên kết hydrogen mạnh nhất. Oxygen (O) và nitrogen (N) có độ âm điện thấp hơn fluorine, nên liên kết hydrogen của chúng yếu hơn.
2.2. Khoảng Cách Giữa Các Nguyên Tử
Khoảng cách giữa nguyên tử hydrogen và nguyên tử có cặp electron tự do cũng ảnh hưởng đến độ bền của liên kết. Liên kết hydrogen mạnh nhất khi khoảng cách giữa hai nguyên tử này là tối ưu. Nếu khoảng cách quá lớn, lực hút tĩnh điện sẽ giảm đáng kể, làm yếu liên kết. Ngược lại, nếu khoảng cách quá nhỏ, sự đẩy giữa các đám mây electron của hai nguyên tử sẽ làm giảm độ bền của liên kết.
2.3. Góc Liên Kết
Góc giữa ba nguyên tử tham gia liên kết hydrogen (ví dụ: O-H···O) cũng ảnh hưởng đến độ bền của liên kết. Liên kết hydrogen mạnh nhất khi góc này gần 180 độ, tức là ba nguyên tử nằm trên một đường thẳng. Khi góc này lệch khỏi 180 độ, độ bền của liên kết sẽ giảm do sự sắp xếp không tối ưu của các điện tích.
2.4. Môi Trường Xung Quanh
Môi trường xung quanh cũng có thể ảnh hưởng đến độ bền của liên kết hydrogen. Ví dụ, trong môi trường dung môi phân cực, các phân tử dung môi có thể cạnh tranh tạo liên kết hydrogen với các nguyên tử tham gia, làm giảm độ bền của liên kết hydrogen ban đầu.
3. Ví Dụ Về Các Phân Tử Có Liên Kết Hydrogen
Rất nhiều phân tử có khả năng tạo liên kết hydrogen, nhưng phổ biến nhất là nước (H₂O), ammonia (NH₃) và các alcohol (R-OH).
3.1. Nước (H₂O)
Nước là một ví dụ điển hình về phân tử có liên kết hydrogen. Mỗi phân tử nước có hai nguyên tử hydrogen liên kết với một nguyên tử oxygen. Nguyên tử oxygen có độ âm điện cao, tạo ra điện tích dương cục bộ trên các nguyên tử hydrogen. Các phân tử nước có thể tạo liên kết hydrogen với nhau thông qua các nguyên tử hydrogen mang điện tích dương và các cặp electron tự do trên nguyên tử oxygen của phân tử nước khác.
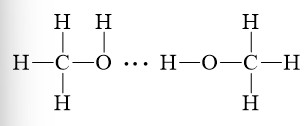 Liên kết hydrogen trong nước
Liên kết hydrogen trong nước
Liên kết hydrogen giữa các phân tử nước tạo ra nhiều tính chất đặc biệt cho nước, bao gồm:
- Nhiệt dung riêng cao: Nước có khả năng hấp thụ một lượng lớn nhiệt mà không tăng nhiệt độ đáng kể, do năng lượng nhiệt được sử dụng để phá vỡ các liên kết hydrogen.
- Sức căng bề mặt lớn: Các phân tử nước trên bề mặt tạo ra một lớp màng do lực hút mạnh giữa chúng, cho phép các vật thể nhỏ như côn trùng có thể đi trên mặt nước.
- Khả năng hòa tan tốt: Nước có thể hòa tan nhiều chất phân cực và ion do khả năng tạo liên kết hydrogen với các chất này.
- Độ nhớt cao: Liên kết hydrogen làm tăng lực ma sát giữa các lớp chất lỏng, làm cho nước có độ nhớt cao hơn so với các chất lỏng khác có kích thước phân tử tương đương.
3.2. Ammonia (NH₃)
Ammonia cũng là một phân tử có khả năng tạo liên kết hydrogen. Nguyên tử nitrogen có độ âm điện cao hơn hydrogen, tạo ra điện tích dương cục bộ trên các nguyên tử hydrogen. Các phân tử ammonia có thể tạo liên kết hydrogen với nhau thông qua các nguyên tử hydrogen mang điện tích dương và các cặp electron tự do trên nguyên tử nitrogen của phân tử ammonia khác.
3.3. Alcohol (R-OH)
Alcohol là các hợp chất hữu cơ chứa nhóm hydroxyl (-OH). Nguyên tử oxygen trong nhóm hydroxyl có độ âm điện cao, tạo ra điện tích dương cục bộ trên nguyên tử hydrogen. Các phân tử alcohol có thể tạo liên kết hydrogen với nhau thông qua các nguyên tử hydrogen mang điện tích dương và các cặp electron tự do trên nguyên tử oxygen của phân tử alcohol khác. Ngoài ra, alcohol cũng có thể tạo liên kết hydrogen với nước, làm tăng khả năng hòa tan của alcohol trong nước.
3.4. Acid Carboxylic (R-COOH)
Acid carboxylic chứa nhóm carboxyl (-COOH), trong đó có một nhóm hydroxyl (-OH) và một nhóm carbonyl (C=O). Nhóm hydroxyl này có khả năng tạo liên kết hydrogen tương tự như alcohol. Các acid carboxylic có thể tạo liên kết hydrogen giữa các phân tử của chúng, tạo thành các dimer (phân tử đôi) thông qua hai liên kết hydrogen giữa hai nhóm carboxyl.
 Hình ảnh minh họa liên kết Hydro trong Axit Cacboxylic
Hình ảnh minh họa liên kết Hydro trong Axit Cacboxylic
3.5. Protein và DNA
Liên kết hydrogen đóng vai trò vô cùng quan trọng trong cấu trúc và chức năng của các đại phân tử sinh học như protein và DNA. Trong protein, liên kết hydrogen giúp duy trì cấu trúc bậc hai và bậc ba của protein, đảm bảo protein có hình dạng và chức năng phù hợp. Trong DNA, liên kết hydrogen giữa các cặp base (adenine-thymine và guanine-cytosine) giữ hai mạch DNA xoắn kép lại với nhau, đảm bảo tính ổn định và khả năng sao chép thông tin di truyền.
4. Vai Trò Của Liên Kết Hydrogen
Liên kết hydrogen có vai trò quan trọng trong nhiều lĩnh vực khác nhau, từ hóa học, sinh học đến vật lý.
4.1. Trong Hóa Học
- Ảnh hưởng đến tính chất vật lý của chất: Liên kết hydrogen làm tăng nhiệt độ sôi, nhiệt độ nóng chảy và độ nhớt của các chất. Ví dụ, nước có nhiệt độ sôi cao hơn nhiều so với các chất có khối lượng phân tử tương đương như methane (CH₄) do liên kết hydrogen giữa các phân tử nước.
- Quyết định cấu trúc phân tử: Liên kết hydrogen giúp xác định cấu trúc không gian của các phân tử, đặc biệt là các phân tử sinh học như protein và DNA.
- Ảnh hưởng đến độ hòa tan: Liên kết hydrogen giúp các chất phân cực hòa tan tốt trong các dung môi phân cực như nước.
4.2. Trong Sinh Học
- Duy trì cấu trúc protein: Liên kết hydrogen giúp protein gấp cuộn thành các cấu trúc không gian đặc thù, đảm bảo chức năng sinh học của protein.
- Ổn định cấu trúc DNA: Liên kết hydrogen giữa các cặp base giữ hai mạch DNA xoắn kép lại với nhau, đảm bảo tính ổn định và khả năng sao chép thông tin di truyền.
- Vận chuyển nước và chất dinh dưỡng trong cây: Liên kết hydrogen giữa các phân tử nước tạo ra lực mao dẫn, giúp nước di chuyển từ rễ lên lá trong cây.
- Ảnh hưởng đến hoạt động của enzyme: Liên kết hydrogen tham gia vào quá trình liên kết enzyme với cơ chất, xúc tác các phản ứng sinh hóa.
4.3. Trong Đời Sống Hằng Ngày
- Nước đá nổi trên mặt nước: Liên kết hydrogen làm cho nước đá có cấu trúc tinh thể mở, làm giảm mật độ của nước đá so với nước lỏng, giúp nước đá nổi trên mặt nước. Điều này rất quan trọng đối với sự sống của các sinh vật dưới nước trong mùa đông.
- Sự bay hơi của mồ hôi: Liên kết hydrogen giữa các phân tử nước trong mồ hôi giúp hấp thụ nhiệt từ cơ thể khi mồ hôi bay hơi, giúp làm mát cơ thể.
- Sự tạo thành sương: Khi nhiệt độ giảm, các phân tử nước trong không khí tạo liên kết hydrogen với nhau, ngưng tụ thành các giọt sương trên bề mặt lạnh.
- Tính chất của vải: Liên kết hydrogen giữa các sợi cellulose trong vải giúp vải có độ bền và khả năng thấm hút nước.
5. Ứng Dụng Của Liên Kết Hydrogen
Liên kết hydrogen có nhiều ứng dụng quan trọng trong các lĩnh vực khác nhau.
5.1. Trong Công Nghiệp Dược Phẩm
- Thiết kế thuốc: Liên kết hydrogen được sử dụng để thiết kế các loại thuốc có khả năng liên kết đặc hiệu với các protein mục tiêu trong cơ thể. Bằng cách tạo ra các phân tử thuốc có khả năng tạo liên kết hydrogen với các vị trí đặc biệt trên protein, các nhà khoa học có thể phát triển các loại thuốc hiệu quả hơn và ít tác dụng phụ hơn.
- Ổn định thuốc: Liên kết hydrogen giúp ổn định cấu trúc của các phân tử thuốc, kéo dài thời gian bảo quản và tăng hiệu quả điều trị.
- Hòa tan thuốc: Liên kết hydrogen giúp tăng khả năng hòa tan của các loại thuốc khó tan trong nước, cải thiện khả năng hấp thụ của thuốc vào cơ thể.
5.2. Trong Công Nghiệp Thực Phẩm
- Tạo gel: Liên kết hydrogen đóng vai trò quan trọng trong việc tạo thành các loại gel thực phẩm như gelatin và agar. Các phân tử protein hoặc polysaccharide tạo liên kết hydrogen với nhau, tạo thành một mạng lưới ba chiều giữ nước bên trong, tạo ra cấu trúc gel.
- Ổn định nhũ tương: Liên kết hydrogen giúp ổn định các nhũ tương thực phẩm như mayonnaise và sữa. Các phân tử chất nhũ hóa tạo liên kết hydrogen với cả pha nước và pha dầu, ngăn chặn sự tách lớp của nhũ tương.
- Ảnh hưởng đến cấu trúc và độ mềm của thực phẩm: Liên kết hydrogen ảnh hưởng đến cấu trúc và độ mềm của nhiều loại thực phẩm như bánh mì và thịt.
5.3. Trong Công Nghiệp Vật Liệu
- Tạo polyme: Liên kết hydrogen được sử dụng để tạo ra các loại polyme có tính chất đặc biệt như khả năng tự phục hồi và khả năng chịu nhiệt cao.
- Tạo vật liệu nano: Liên kết hydrogen được sử dụng để lắp ráp các vật liệu nano thành các cấu trúc phức tạp với các chức năng đặc biệt.
- Cải thiện tính chất của giấy: Liên kết hydrogen giữa các sợi cellulose trong giấy giúp tăng độ bền và độ dai của giấy.
6. Các Loại Liên Kết Hydrogen Đặc Biệt
Ngoài các liên kết hydrogen thông thường, còn có một số loại liên kết hydrogen đặc biệt có vai trò quan trọng trong các hệ thống hóa học và sinh học.
6.1. Liên Kết Hydrogen Nội Phân Tử
Liên kết hydrogen nội phân tử là liên kết hydrogen hình thành giữa các nguyên tử trong cùng một phân tử. Loại liên kết này có thể làm thay đổi hình dạng và tính chất của phân tử. Ví dụ, trong phân tử ortho-nitrophenol, nhóm nitro (-NO₂) và nhóm hydroxyl (-OH) có thể tạo liên kết hydrogen với nhau, làm cho phân tử này có nhiệt độ sôi thấp hơn so với para-nitrophenol, trong đó không có liên kết hydrogen nội phân tử.
6.2. Liên Kết Hydrogen Bifurcated
Liên kết hydrogen bifurcated là liên kết hydrogen trong đó một nguyên tử hydrogen tạo liên kết với hai nguyên tử khác. Loại liên kết này thường gặp trong các hệ thống có nhiều nguyên tử có độ âm điện cao gần nhau.
6.3. Liên Kết Hydrogen Cộng Hưởng
Liên kết hydrogen cộng hưởng là liên kết hydrogen trong đó nguyên tử hydrogen được chia sẻ giữa hai nguyên tử có độ âm điện cao một cách gần như đối xứng. Loại liên kết này thường gặp trong các hệ thống có cấu trúc cộng hưởng, ví dụ như trong các ion enolate.
7. Các Phương Pháp Nghiên Cứu Liên Kết Hydrogen
Có nhiều phương pháp khác nhau được sử dụng để nghiên cứu liên kết hydrogen, bao gồm cả các phương pháp thực nghiệm và các phương pháp tính toán.
7.1. Phương Pháp Thực Nghiệm
- Nhiễu xạ tia X: Phương pháp này được sử dụng để xác định cấu trúc tinh thể của các chất, từ đó xác định vị trí và khoảng cách giữa các nguyên tử, giúp xác định sự tồn tại của liên kết hydrogen.
- Quang phổ hồng ngoại (IR): Phương pháp này dựa trên sự hấp thụ ánh sáng hồng ngoại của các phân tử. Liên kết hydrogen làm thay đổi tần số dao động của các liên kết hóa học, do đó có thể sử dụng quang phổ hồng ngoại để xác định sự tồn tại và độ bền của liên kết hydrogen.
- Quang phổ Raman: Phương pháp này tương tự như quang phổ hồng ngoại, nhưng dựa trên sự tán xạ ánh sáng Raman của các phân tử.
- Cộng hưởng từ hạt nhân (NMR): Phương pháp này dựa trên sự tương tác giữa hạt nhân nguyên tử và từ trường. Liên kết hydrogen làm thay đổi môi trường điện tử xung quanh hạt nhân, do đó có thể sử dụng cộng hưởng từ hạt nhân để nghiên cứu liên kết hydrogen.
7.2. Phương Pháp Tính Toán
- Cơ học lượng tử: Các phương pháp tính toán cơ học lượng tử, như lý thuyết phiếm hàm mật độ (DFT) và phương pháp Hartree-Fock, được sử dụng để tính toán năng lượng và cấu trúc của các phân tử và hệ thống có liên kết hydrogen. Các phương pháp này có thể cung cấp thông tin chi tiết về độ bền và tính chất của liên kết hydrogen.
- Mô phỏng động lực học phân tử (MD): Phương pháp này được sử dụng để mô phỏng chuyển động của các phân tử theo thời gian. Bằng cách sử dụng các thuật toán và mô hình toán học, các nhà khoa học có thể theo dõi sự hình thành và phá vỡ của các liên kết hydrogen trong các hệ thống phức tạp.
8. Liên Kết Hydrogen Trong Tương Lai
Nghiên cứu về liên kết hydrogen vẫn đang tiếp tục phát triển, với nhiều hướng nghiên cứu mới đầy hứa hẹn.
8.1. Vật Liệu Tự Lắp Ráp
Liên kết hydrogen đang được sử dụng để tạo ra các vật liệu tự lắp ráp, trong đó các phân tử tự sắp xếp thành các cấu trúc phức tạp thông qua các tương tác liên kết hydrogen. Các vật liệu này có tiềm năng ứng dụng trong nhiều lĩnh vực, bao gồm điện tử, quang học và y sinh học.
8.2. Chất Xúc Tác
Liên kết hydrogen đang được sử dụng để thiết kế các chất xúc tác mới có khả năng xúc tác các phản ứng hóa học một cách hiệu quả và chọn lọc. Các chất xúc tác này có thể giúp giảm thiểu lượng chất thải và năng lượng tiêu thụ trong các quá trình công nghiệp.
8.3. Lưu Trữ Năng Lượng
Liên kết hydrogen đang được nghiên cứu để phát triển các vật liệu lưu trữ năng lượng mới, chẳng hạn như các vật liệu hấp thụ và giải phóng hydrogen một cách hiệu quả. Các vật liệu này có thể giúp giải quyết các vấn đề liên quan đến biến đổi khí hậu và an ninh năng lượng.
9. Kết Luận
Liên kết hydrogen là một loại tương tác yếu nhưng vô cùng quan trọng trong hóa học, sinh học và vật lý. Nó ảnh hưởng đến tính chất vật lý của các chất, quyết định cấu trúc phân tử và đóng vai trò quan trọng trong nhiều quá trình sinh học. Nghiên cứu về liên kết hydrogen đang tiếp tục phát triển và hứa hẹn mang lại nhiều ứng dụng mới trong tương lai.
Nếu bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải ở khu vực Mỹ Đình, Hà Nội, hãy truy cập ngay XETAIMYDINH.EDU.VN. Chúng tôi cung cấp thông tin cập nhật về các loại xe tải, so sánh giá cả, tư vấn lựa chọn xe phù hợp và giải đáp mọi thắc mắc của bạn.
10. Câu Hỏi Thường Gặp (FAQ)
1. Liên kết hydrogen mạnh hơn hay yếu hơn liên kết cộng hóa trị?
Liên kết hydrogen yếu hơn nhiều so với liên kết cộng hóa trị. Liên kết cộng hóa trị là liên kết hóa học mạnh được hình thành thông qua sự chia sẻ electron giữa các nguyên tử, trong khi liên kết hydrogen là một tương tác tĩnh điện yếu giữa các phân tử.
2. Những nguyên tố nào có thể tạo liên kết hydrogen?
Các nguyên tố có độ âm điện cao như oxygen (O), nitrogen (N) và fluorine (F) có thể tạo liên kết hydrogen khi liên kết với nguyên tử hydrogen (H).
3. Tại sao nước có nhiệt độ sôi cao bất thường?
Nước có nhiệt độ sôi cao bất thường do liên kết hydrogen giữa các phân tử nước. Để chuyển nước từ trạng thái lỏng sang trạng thái khí, cần phải phá vỡ các liên kết hydrogen này, do đó cần nhiều năng lượng hơn so với các chất có khối lượng phân tử tương đương nhưng không có liên kết hydrogen.
4. Liên kết hydrogen có vai trò gì trong cấu trúc của protein?
Liên kết hydrogen đóng vai trò quan trọng trong việc duy trì cấu trúc bậc hai và bậc ba của protein. Chúng giúp protein gấp cuộn thành các cấu trúc không gian đặc thù, đảm bảo chức năng sinh học của protein.
5. Liên kết hydrogen có vai trò gì trong cấu trúc của DNA?
Liên kết hydrogen giữa các cặp base (adenine-thymine và guanine-cytosine) giữ hai mạch DNA xoắn kép lại với nhau, đảm bảo tính ổn định và khả năng sao chép thông tin di truyền.
6. Liên kết hydrogen có ảnh hưởng đến độ hòa tan của các chất không?
Có, liên kết hydrogen ảnh hưởng đến độ hòa tan của các chất. Các chất phân cực có khả năng tạo liên kết hydrogen với nước thường hòa tan tốt trong nước.
7. Làm thế nào để xác định sự tồn tại của liên kết hydrogen?
Có nhiều phương pháp khác nhau để xác định sự tồn tại của liên kết hydrogen, bao gồm nhiễu xạ tia X, quang phổ hồng ngoại (IR), quang phổ Raman và cộng hưởng từ hạt nhân (NMR).
8. Liên kết hydrogen có ứng dụng gì trong công nghiệp dược phẩm?
Liên kết hydrogen được sử dụng để thiết kế thuốc, ổn định thuốc và tăng khả năng hòa tan của thuốc.
9. Liên kết hydrogen có ứng dụng gì trong công nghiệp thực phẩm?
Liên kết hydrogen đóng vai trò quan trọng trong việc tạo gel, ổn định nhũ tương và ảnh hưởng đến cấu trúc và độ mềm của thực phẩm.
10. Liên kết hydrogen có vai trò gì trong vật liệu tự lắp ráp?
Liên kết hydrogen được sử dụng để tạo ra các vật liệu tự lắp ráp, trong đó các phân tử tự sắp xếp thành các cấu trúc phức tạp thông qua các tương tác liên kết hydrogen.
Bạn vẫn còn thắc mắc về xe tải và cần được tư vấn chi tiết hơn? Đừng ngần ngại liên hệ với Xe Tải Mỹ Đình ngay hôm nay! Chúng tôi luôn sẵn sàng lắng nghe và cung cấp giải pháp tốt nhất cho nhu cầu của bạn.
Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội.
Hotline: 0247 309 9988.
Trang web: XETAIMYDINH.EDU.VN.