Bạn đang tìm hiểu về phản ứng oxi hóa khử? Bài viết này từ Xe Tải Mỹ Đình sẽ giải thích chi tiết phản ứng Oxi Hóa Khử Là Gì, các ứng dụng quan trọng của nó trong đời sống và công nghiệp, cùng những ví dụ minh họa dễ hiểu. Hãy cùng khám phá để nắm vững kiến thức hóa học này!
1. Phản Ứng Oxi Hóa Khử Là Gì?
Phản ứng oxi hóa khử là quá trình hóa học, trong đó có sự thay đổi số oxi hóa của một số nguyên tố. Theo “Từ điển Bách khoa Hóa học”, phản ứng oxi hóa khử luôn đi kèm với sự chuyển giao electron giữa các chất phản ứng, đóng vai trò then chốt trong nhiều quá trình tự nhiên và công nghiệp. Tại Xe Tải Mỹ Đình, chúng tôi hiểu rõ tầm quan trọng của kiến thức này và sẽ cung cấp cho bạn cái nhìn toàn diện nhất.
- Chất khử (chất bị oxi hóa): Nhường electron, số oxi hóa tăng.
- Chất oxi hóa (chất bị khử): Nhận electron, số oxi hóa giảm.
Ví dụ:
Fe + CuSO4 → Cu + FeSO4
Trong đó:
- Fe là chất khử (Fe0 → Fe2+ + 2e)
- CuSO4 là chất oxi hóa (Cu2+ + 2e → Cu0)
 Phản ứng oxi hóa khử trong tự nhiên
Phản ứng oxi hóa khử trong tự nhiên
2. Ý Nghĩa Của Phản Ứng Oxi Hóa Khử Trong Đời Sống Và Sản Xuất
Phản ứng oxi hóa khử đóng vai trò quan trọng trong nhiều lĩnh vực:
-
Sản xuất công nghiệp:
- Luyện kim: Khai thác và tinh chế kim loại từ quặng.
- Sản xuất hóa chất: Tổng hợp các hợp chất quan trọng như axit, bazơ, phân bón.
- Năng lượng: Đốt nhiên liệu (than, dầu, khí đốt) để tạo ra nhiệt và điện.
-
Đời sống hàng ngày:
- Hô hấp: Quá trình oxi hóa glucose trong cơ thể để tạo năng lượng.
- Ăn mòn kim loại: Sắt bị gỉ khi tiếp xúc với oxi và nước.
- Pin và ắc quy: Hoạt động dựa trên các phản ứng oxi hóa khử để tạo ra dòng điện.
-
Bảo vệ môi trường:
- Xử lý nước thải: Loại bỏ các chất ô nhiễm bằng các phản ứng oxi hóa khử.
- Khử độc khí thải: Chuyển đổi các khí độc hại thành các chất ít độc hơn.
Ví dụ cụ thể:
- Sản xuất thép: Trong quá trình luyện thép, sắt oxit (Fe2O3) trong quặng sắt được khử bằng than cốc (C) để tạo thành sắt kim loại (Fe) và khí CO2.
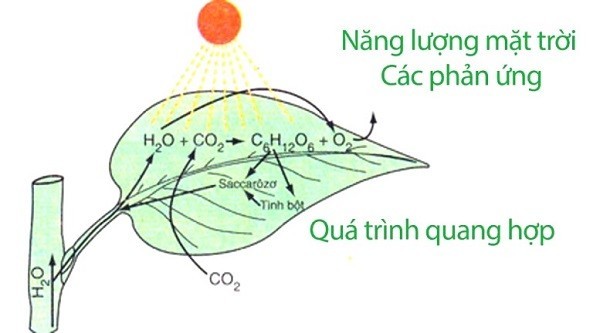
- Quá trình quang hợp: Cây xanh sử dụng năng lượng ánh sáng để khử CO2 thành glucose và oxi, cung cấp năng lượng cho sự sống trên Trái Đất.
- Pin điện hóa: Trong pin, kẽm (Zn) bị oxi hóa thành ion kẽm (Zn2+), giải phóng electron tạo ra dòng điện.
3. Dấu Hiệu Nhận Biết Phản Ứng Oxi Hóa Khử
Để nhận biết một phản ứng có phải là phản ứng oxi hóa khử hay không, ta cần dựa vào sự thay đổi số oxi hóa của các nguyên tố trước và sau phản ứng. Dưới đây là một số dấu hiệu điển hình:
- Thay đổi màu sắc: Một số chất oxi hóa và chất khử có màu sắc đặc trưng. Sự thay đổi màu sắc trong quá trình phản ứng có thể là dấu hiệu của phản ứng oxi hóa khử. Ví dụ, dung dịch KMnO4 có màu tím, khi tham gia phản ứng oxi hóa khử, màu tím có thể biến mất hoặc chuyển sang màu khác.
- Sự xuất hiện hoặc biến mất của chất khí: Một số phản ứng oxi hóa khử tạo ra hoặc tiêu thụ chất khí. Ví dụ, phản ứng giữa kim loại và axit thường tạo ra khí hidro (H2).
- Sự hình thành kết tủa: Trong một số trường hợp, phản ứng oxi hóa khử có thể tạo ra chất kết tủa.
- Thay đổi nhiệt độ: Phản ứng oxi hóa khử thường tỏa hoặc thu nhiệt, làm thay đổi nhiệt độ của hệ phản ứng.
Ví dụ:
-
Phản ứng giữa kẽm và axit clohidric:
Zn + 2HCl → ZnCl2 + H2↑
Trong phản ứng này, kẽm (Zn) bị oxi hóa (số oxi hóa tăng từ 0 lên +2), và hidro (H) trong HCl bị khử (số oxi hóa giảm từ +1 xuống 0). Khí hidro (H2) thoát ra là một dấu hiệu nhận biết của phản ứng oxi hóa khử.
-
Phản ứng đốt cháy:
CH4 + 2O2 → CO2 + 2H2O
Đây là một phản ứng oxi hóa khử tỏa nhiệt mạnh. Cacbon (C) trong CH4 bị oxi hóa (số oxi hóa tăng từ -4 lên +4), và oxi (O) trong O2 bị khử (số oxi hóa giảm từ 0 xuống -2).
4. Các Bước Lập Phương Trình Phản Ứng Oxi Hóa Khử
Để cân bằng một phương trình phản ứng oxi hóa khử, chúng ta sử dụng phương pháp thăng bằng electron, bao gồm các bước sau:
-
Xác định số oxi hóa: Xác định số oxi hóa của tất cả các nguyên tố trong phản ứng.
-
Xác định chất oxi hóa và chất khử: Tìm các nguyên tố có sự thay đổi số oxi hóa. Nguyên tố có số oxi hóa tăng là chất khử, nguyên tố có số oxi hóa giảm là chất oxi hóa.
-
Viết quá trình oxi hóa và quá trình khử:
- Quá trình oxi hóa: Chất khử → Chất oxi hóa + ne (n là số electron nhường)
- Quá trình khử: Chất oxi hóa + me → Chất khử (m là số electron nhận)
-
Cân bằng số electron: Tìm bội số chung nhỏ nhất (BCNN) của n và m. Nhân các quá trình oxi hóa và khử với các hệ số thích hợp sao cho tổng số electron nhường bằng tổng số electron nhận.
-
Đặt hệ số vào phương trình phản ứng: Đặt các hệ số vừa tìm được vào phương trình phản ứng.
-
Cân bằng các nguyên tố còn lại: Cân bằng các nguyên tố không thay đổi số oxi hóa theo thứ tự: kim loại, phi kim, hidro, oxi.
Ví dụ: Cân bằng phương trình phản ứng sau:
KMnO4 + HCl → KCl + MnCl2 + H2O + Cl2
-
Xác định số oxi hóa:
- KMnO4: K(+1), Mn(+7), O(-2)
- HCl: H(+1), Cl(-1)
- KCl: K(+1), Cl(-1)
- MnCl2: Mn(+2), Cl(-1)
- H2O: H(+1), O(-2)
- Cl2: Cl(0)
-
Xác định chất oxi hóa và chất khử:
- Mn(+7) trong KMnO4 giảm xuống Mn(+2) trong MnCl2 (chất oxi hóa)
- Cl(-1) trong HCl tăng lên Cl(0) trong Cl2 (chất khử)
-
Viết quá trình oxi hóa và quá trình khử:
- Quá trình khử: Mn+7 + 5e → Mn+2
- Quá trình oxi hóa: 2Cl-1 → Cl2 + 2e
-
Cân bằng số electron:
- BCNN(5, 2) = 10
- Nhân quá trình khử với 2: 2Mn+7 + 10e → 2Mn+2
- Nhân quá trình oxi hóa với 5: 10Cl-1 → 5Cl2 + 10e
-
Đặt hệ số vào phương trình phản ứng:
2KMnO4 + HCl → KCl + 2MnCl2 + H2O + 5Cl2
-
Cân bằng các nguyên tố còn lại:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 8H2O + 5Cl2
Vậy, phương trình phản ứng đã được cân bằng.
5. Các Loại Phản Ứng Oxi Hóa Khử
Phản ứng oxi hóa khử có thể được phân loại theo nhiều cách khác nhau, dựa trên đặc điểm của chất phản ứng và sản phẩm. Dưới đây là một số loại phản ứng oxi hóa khử phổ biến:
-
Phản ứng oxi hóa khử giữa các chất khác nhau: Đây là loại phản ứng phổ biến nhất, trong đó chất khử và chất oxi hóa thuộc về các phân tử khác nhau.
Ví dụ:
C + 4HNO3 (đặc) → CO2 + 4NO2 + 2H2O
Cu + 2H2SO4 (đặc) → CuSO4 + SO2 + 2H2O
-
Phản ứng oxi hóa khử nội phân tử: Trong loại phản ứng này, chất khử và chất oxi hóa cùng thuộc về một phân tử, nhưng ở các nguyên tử khác nhau.
Ví dụ:
NH4NO2 → N2 + 2H2O
Trong phân tử NH4NO2, nitơ trong NH4+ đóng vai trò là chất khử, và nitơ trong NO2– đóng vai trò là chất oxi hóa.
-
Phản ứng tự oxi hóa khử (tự phản ứng): Đây là loại phản ứng đặc biệt, trong đó một chất vừa là chất khử, vừa là chất oxi hóa.
Ví dụ:
Cl2 + 2NaOH → NaCl + NaClO + H2O
Trong phản ứng này, clo (Cl2) vừa bị oxi hóa thành NaClO, vừa bị khử thành NaCl.
4KClO3 → 3KClO4 + KCl
-
Phản ứng thế: Một nguyên tố thay thế một nguyên tố khác trong hợp chất.
Ví dụ:
Zn + CuSO4 -> ZnSO4 + Cu -
Phản ứng hóa hợp: Các chất kết hợp với nhau tạo thành một hợp chất mới.
Ví dụ:
S + O2 -> SO2
6. Ví Dụ Về Phản Ứng Oxi Hóa Khử Lớp 10
6.1. Phản Ứng Giữa Al và HNO3
Đề bài: Trong phương trình phản ứng oxi hóa khử giữa Al và HNO3, xác định số oxi hóa của các nguyên tử thay đổi và viết quá trình oxi hóa, quá trình khử.
Lời giải:
Phương trình phản ứng:
Al + 6HNO3 → Al(NO3)3 + 3NO2 + 3H2O
- Số oxi hóa của Al tăng từ 0 lên +3 (Al là chất khử).
- Số oxi hóa của N trong HNO3 giảm từ +5 xuống +4 (HNO3 là chất oxi hóa).
Quá trình oxi hóa:
Al → Al3+ + 3e
Quá trình khử:
N+5 + 1e → N+4
6.2. Phản Ứng Giữa KMnO4 và HCl
Đề bài: Trong phương trình phản ứng oxi hóa khử giữa KMnO4 và HCl, xác định số oxi hóa của các nguyên tử thay đổi và vai trò của các chất.
Phương trình phản ứng:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
- Số oxi hóa của Mn giảm từ +7 xuống +2 (KMnO4 là chất oxi hóa).
- Số oxi hóa của Cl tăng từ -1 lên 0 (HCl là chất khử).
Quá trình khử:
Mn+7 + 5e → Mn+2
Quá trình oxi hóa:
2Cl-1 → Cl2 + 2e
6.3. Phản Ứng Giữa Cu và H2SO4
Đề bài: Trong phương trình phản ứng oxi hóa khử giữa Cu và H2SO4 đặc, nóng, xác định số oxi hóa của các nguyên tử thay đổi và vai trò của các chất.
Phương trình phản ứng:
Cu + 2H2SO4 (đặc, nóng) → CuSO4 + SO2 + 2H2O
- Số oxi hóa của Cu tăng từ 0 lên +2 (Cu là chất khử).
- Số oxi hóa của S trong H2SO4 giảm từ +6 xuống +4 (H2SO4 là chất oxi hóa).
Quá trình oxi hóa:
Cu → Cu2+ + 2e
Quá trình khử:
S+6 + 2e → S+4
 Phản ứng oxi hóa khử giữa đồng và axit sunfuric
Phản ứng oxi hóa khử giữa đồng và axit sunfuric
7. Bài Tập Vận Dụng Về Phản Ứng Oxi Hóa Khử Lớp 10
Bài 1: Cho các phương trình phản ứng sau, xác định đâu là phản ứng oxi hóa khử:
A. CaCO3 → CaO + CO2
B. 2HgO → 2Hg + O2
C. NaOH + HCl → NaCl + H2O
D. AgCl → Ag + Cl2
Lời giải:
Đáp án đúng là B. Trong phản ứng này, số oxi hóa của Hg và O thay đổi:
- Hg+2 + 2e → Hg0
- 2O-2 → O2 + 4e
Bài 2: Cho phản ứng sau:
K2Cr2O7 + HCl → KCl + CrCl3 + H2O + Cl2
Tìm hệ số cân bằng của phương trình phản ứng trên.
Lời giải:
Áp dụng phương pháp thăng bằng electron, ta có phương trình cân bằng:
K2Cr2O7 + 14HCl → 2KCl + 2CrCl3 + 7H2O + 3Cl2
Bài 3: Cho 11,2 gam Fe tác dụng hoàn toàn với dung dịch CuSO4 dư. Tính khối lượng Cu thu được sau phản ứng.
Lời giải:
Phương trình phản ứng:
Fe + CuSO4 → FeSO4 + Cu
Số mol Fe: nFe = 11,2/56 = 0,2 mol
Theo phương trình, nCu = nFe = 0,2 mol
Vậy, khối lượng Cu thu được: mCu = 0,2 x 64 = 12,8 gam
8. Các Yếu Tố Ảnh Hưởng Đến Tốc Độ Phản Ứng Oxi Hóa Khử
Tốc độ của phản ứng oxi hóa khử phụ thuộc vào nhiều yếu tố, bao gồm:
- Nồng độ: Nồng độ của các chất phản ứng càng cao, tốc độ phản ứng càng lớn. Điều này là do khi nồng độ tăng, số lượng va chạm hiệu quả giữa các phân tử chất phản ứng tăng lên.
- Nhiệt độ: Nhiệt độ tăng làm tăng động năng của các phân tử, dẫn đến số lượng va chạm hiệu quả tăng lên, làm tăng tốc độ phản ứng. Theo quy tắc Van’t Hoff, khi nhiệt độ tăng lên 10°C, tốc độ phản ứng thường tăng lên 2-4 lần.
- Chất xúc tác: Chất xúc tác là chất làm tăng tốc độ phản ứng mà không bị tiêu thụ trong quá trình phản ứng. Chất xúc tác cung cấp một con đường phản ứng khác với năng lượng hoạt hóa thấp hơn, giúp phản ứng xảy ra nhanh hơn.
- Diện tích bề mặt: Đối với các phản ứng xảy ra trên bề mặt chất rắn, diện tích bề mặt tiếp xúc giữa các chất phản ứng càng lớn, tốc độ phản ứng càng cao. Ví dụ, sắt ở dạng bột sẽ phản ứng nhanh hơn so với sắt ở dạng khối.
- Áp suất (đối với phản ứng có chất khí): Áp suất tăng làm tăng nồng độ của các chất khí, do đó làm tăng tốc độ phản ứng.
- Bản chất của các chất phản ứng: Các chất phản ứng khác nhau có khả năng phản ứng khác nhau. Một số chất dễ dàng bị oxi hóa hoặc khử hơn các chất khác, do đó tốc độ phản ứng cũng khác nhau.
Ví dụ:
- Trong phản ứng đốt cháy nhiên liệu, việc tăng nồng độ oxi (tăng áp suất hoặc cung cấp oxi tinh khiết) sẽ làm tăng tốc độ cháy.
- Trong công nghiệp sản xuất axit sulfuric (H2SO4), người ta sử dụng chất xúc tác V2O5 để tăng tốc độ phản ứng oxi hóa SO2 thành SO3.
9. Ứng Dụng Của Phản Ứng Oxi Hóa Khử Trong Công Nghiệp Xe Tải
Phản ứng oxi hóa khử đóng vai trò quan trọng trong ngành công nghiệp xe tải, từ sản xuất đến bảo trì và vận hành:
-
Sản xuất vật liệu:
- Thép: Quá trình luyện thép từ quặng sắt là một phản ứng oxi hóa khử quan trọng. Thép là vật liệu chính để sản xuất khung gầm, thân xe và các bộ phận chịu lực của xe tải.
- Nhôm: Nhôm được sử dụng trong sản xuất các bộ phận nhẹ của xe tải, như mâm xe, nắp capo, giúp giảm trọng lượng xe và tiết kiệm nhiên liệu. Quá trình sản xuất nhôm từ quặng boxit cũng là một phản ứng oxi hóa khử.
-
Ắc quy:
- Ắc quy chì-axit: Đây là nguồn điện chính của xe tải, cung cấp năng lượng cho khởi động, chiếu sáng và các thiết bị điện khác. Ắc quy hoạt động dựa trên các phản ứng oxi hóa khử giữa chì (Pb), chì oxit (PbO2) và axit sulfuric (H2SO4).
-
Chống ăn mòn:
- Ăn mòn kim loại là một vấn đề nghiêm trọng trong ngành công nghiệp xe tải, đặc biệt là đối với các xe hoạt động trong điều kiện khắc nghiệt. Các phương pháp chống ăn mòn, như sơn tĩnh điện, mạ kẽm, sử dụng hợp kim chống gỉ, đều dựa trên các nguyên tắc của phản ứng oxi hóa khử.
-
Xử lý khí thải:
- Xe tải sử dụng động cơ đốt trong thải ra các khí độc hại như CO, NOx, HC. Các hệ thống xử lý khí thải, như bộ chuyển đổi xúc tác, sử dụng các phản ứng oxi hóa khử để chuyển đổi các khí độc hại thành các chất ít độc hơn như CO2, N2, H2O.
Ví dụ cụ thể:
- Hệ thống xử lý khí thải trên xe tải: Bộ chuyển đổi xúc tác (catalytic converter) sử dụng các kim loại quý như platin (Pt), paladi (Pd), rodi (Rh) làm chất xúc tác để oxi hóa CO và HC thành CO2 và H2O, đồng thời khử NOx thành N2.
- Mạ kẽm bảo vệ khung xe: Khung xe tải được mạ kẽm để bảo vệ khỏi ăn mòn. Kẽm (Zn) bị oxi hóa trước sắt (Fe), tạo thành lớp bảo vệ, ngăn không cho sắt tiếp xúc với môi trường ăn mòn.
10. FAQ – Câu Hỏi Thường Gặp Về Phản Ứng Oxi Hóa Khử
-
Câu hỏi: Phản ứng oxi hóa khử có cần điều kiện gì đặc biệt không?
Trả lời: Phản ứng oxi hóa khử có thể xảy ra ở nhiều điều kiện khác nhau, tùy thuộc vào bản chất của các chất phản ứng. Một số phản ứng cần nhiệt độ cao, chất xúc tác, hoặc môi trường axit/bazơ để xảy ra.
-
Câu hỏi: Tại sao phản ứng oxi hóa khử lại quan trọng trong sản xuất điện?
Trả lời: Vì phản ứng oxi hóa khử là cơ sở hoạt động của pin và ắc quy, các thiết bị lưu trữ và cung cấp điện năng.
-
Câu hỏi: Làm thế nào để xác định một chất là chất oxi hóa hay chất khử?
Trả lời: Dựa vào sự thay đổi số oxi hóa của chất đó trong phản ứng. Nếu số oxi hóa tăng, chất đó là chất khử; nếu số oxi hóa giảm, chất đó là chất oxi hóa.
-
Câu hỏi: Phản ứng oxi hóa khử có ứng dụng trong y học không?
Trả lời: Có. Nhiều chất khử trùng, thuốc sát trùng hoạt động dựa trên các phản ứng oxi hóa khử để tiêu diệt vi khuẩn, virus.
-
Câu hỏi: Tại sao ăn mòn kim loại lại là một phản ứng oxi hóa khử?
Trả lời: Vì trong quá trình ăn mòn, kim loại bị oxi hóa, tức là mất electron và chuyển thành ion kim loại.
-
Câu hỏi: Phản ứng cháy có phải là phản ứng oxi hóa khử không?
Trả lời: Đúng. Phản ứng cháy là một phản ứng oxi hóa khử mạnh, trong đó chất cháy phản ứng với oxi, tỏa nhiệt và ánh sáng.
-
Câu hỏi: Làm thế nào để cân bằng phương trình phản ứng oxi hóa khử phức tạp?
Trả lời: Sử dụng phương pháp thăng bằng electron hoặc phương pháp ion-electron để cân bằng.
-
Câu hỏi: Tại sao cần phải xử lý khí thải từ xe tải bằng phản ứng oxi hóa khử?
Trả lời: Để giảm thiểu ô nhiễm môi trường do các khí độc hại trong khí thải gây ra.
-
Câu hỏi: Chất xúc tác có vai trò gì trong phản ứng oxi hóa khử?
Trả lời: Chất xúc tác làm tăng tốc độ phản ứng bằng cách cung cấp một con đường phản ứng khác với năng lượng hoạt hóa thấp hơn.
-
Câu hỏi: Phản ứng oxi hóa khử có liên quan gì đến quá trình quang hợp ở cây xanh?
Trả lời: Quá trình quang hợp là một phản ứng oxi hóa khử phức tạp, trong đó cây xanh sử dụng năng lượng ánh sáng để khử CO2 thành glucose và oxi.
Hi vọng qua bài viết này, bạn đã hiểu rõ hơn về phản ứng oxi hóa khử và những ứng dụng quan trọng của nó. Nếu bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải ở Mỹ Đình, đừng ngần ngại truy cập XETAIMYDINH.EDU.VN để được tư vấn và giải đáp mọi thắc mắc!
Bạn đang gặp khó khăn trong việc lựa chọn xe tải phù hợp với nhu cầu kinh doanh của mình? Bạn muốn tìm hiểu về các dịch vụ sửa chữa và bảo dưỡng xe tải uy tín tại khu vực Mỹ Đình? Hãy liên hệ ngay với Xe Tải Mỹ Đình qua hotline 0247 309 9988 hoặc truy cập website XETAIMYDINH.EDU.VN để được tư vấn miễn phí và nhận những ưu đãi hấp dẫn! Địa chỉ của chúng tôi là Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội. Xe Tải Mỹ Đình luôn sẵn sàng đồng hành cùng bạn trên mọi nẻo đường!