Ở trạng thái cơ bản, Boron, Oxygen, Phosphorus và Chlorine đều chứa electron độc thân. Hãy cùng XETAIMYDINH.EDU.VN khám phá sâu hơn về cấu hình electron và sự phân bố electron độc thân trong các nguyên tố này, giúp bạn hiểu rõ hơn về tính chất hóa học và ứng dụng của chúng trong đời sống. Chúng ta sẽ cùng tìm hiểu về cấu hình electron, quy tắc Hund và cách xác định số electron độc thân.
Mục lục
- Electron Độc Thân Là Gì Và Tại Sao Chúng Quan Trọng?
- Cấu Hình Electron Và Cách Xác Định Electron Độc Thân
- Phân Tích Cấu Hình Electron Của Boron (B)
- Phân Tích Cấu Hình Electron Của Oxygen (O)
- Phân Tích Cấu Hình Electron Của Phosphorus (P)
- Phân Tích Cấu Hình Electron Của Chlorine (Cl)
- Ảnh Hưởng Của Electron Độc Thân Đến Tính Chất Hóa Học
- Electron Độc Thân Trong Các Ứng Dụng Thực Tế
- Các Yếu Tố Ảnh Hưởng Đến Sự Tồn Tại Của Electron Độc Thân
- Các Nghiên Cứu Mới Nhất Về Electron Độc Thân
- Câu Hỏi Thường Gặp Về Electron Độc Thân (FAQ)
- Tại Sao Nên Tìm Hiểu Về Electron Độc Thân Tại Xe Tải Mỹ Đình?
1. Electron Độc Thân Là Gì Và Tại Sao Chúng Quan Trọng?
Electron độc thân là các electron nằm đơn lẻ trong một orbital nguyên tử, không ghép đôi với electron khác. Sự tồn tại của electron độc thân quyết định nhiều tính chất hóa học quan trọng của nguyên tố.
Định Nghĩa Electron Độc Thân
Electron độc thân là electron duy nhất chiếm giữ một orbital trong cấu hình electron của nguyên tử. Theo nguyên lý Pauli, mỗi orbital chỉ chứa tối đa hai electron có spin đối nhau. Khi một orbital chỉ chứa một electron, electron đó được gọi là electron độc thân.
Tại Sao Electron Độc Thân Quan Trọng?
- Tính Chất Hóa Học: Electron độc thân làm cho nguyên tử trở nên hoạt động hóa học hơn. Các nguyên tử có electron độc thân thường dễ dàng tham gia vào các phản ứng hóa học để đạt được cấu hình electron bền vững hơn.
- Liên Kết Hóa Học: Electron độc thân tham gia vào việc hình thành các liên kết hóa học. Chúng có thể tạo thành liên kết cộng hóa trị bằng cách chia sẻ electron với các nguyên tử khác, hoặc tạo thành liên kết ion bằng cách nhường hoặc nhận electron.
- Tính Chất Vật Lý: Số lượng electron độc thân ảnh hưởng đến tính chất từ của vật chất. Các chất có electron độc thân thường có tính thuận từ (paramagnetic), bị hút vào từ trường.
- Ứng Dụng Thực Tế: Electron độc thân có vai trò quan trọng trong nhiều ứng dụng, từ xúc tác hóa học đến công nghệ vật liệu và y học.
Ví dụ, các gốc tự do trong cơ thể là các phân tử chứa electron độc thân, có thể gây ra các phản ứng oxy hóa, ảnh hưởng đến sức khỏe. Ngược lại, các chất chống oxy hóa hoạt động bằng cách trung hòa các gốc tự do này.
2. Cấu Hình Electron Và Cách Xác Định Electron Độc Thân
Để xác định số electron độc thân trong một nguyên tử, chúng ta cần hiểu rõ về cấu hình electron và quy tắc Hund.
Cấu Hình Electron Là Gì?
Cấu hình electron mô tả cách các electron được phân bố trong các orbital của một nguyên tử. Cấu hình electron tuân theo các nguyên tắc sau:
- Nguyên lý Aufbau: Electron lấp đầy các orbital từ mức năng lượng thấp đến cao.
- Quy tắc Hund: Trong một phân lớp (ví dụ: p, d, f), các electron sẽ chiếm các orbital riêng lẻ trước khi bắt đầu ghép đôi trong cùng một orbital.
- Nguyên lý Pauli: Mỗi orbital chỉ chứa tối đa hai electron có spin đối nhau (+1/2 và -1/2).
Cách Xác Định Electron Độc Thân
- Viết Cấu Hình Electron: Xác định cấu hình electron đầy đủ của nguyên tố.
- Xác Định Phân Lớp Cuối Cùng: Tập trung vào phân lớp cuối cùng chứa electron.
- Sử Dụng Quy Tắc Hund: Vẽ sơ đồ orbital cho phân lớp cuối cùng và điền electron vào từng orbital một cách riêng lẻ trước khi ghép đôi.
- Đếm Electron Độc Thân: Đếm số lượng orbital chứa electron đơn lẻ.
Ví dụ, cấu hình electron của Nitrogen (N) là 1s²2s²2p³. Phân lớp 2p có ba orbital. Theo quy tắc Hund, mỗi orbital sẽ chứa một electron, do đó Nitrogen có 3 electron độc thân.
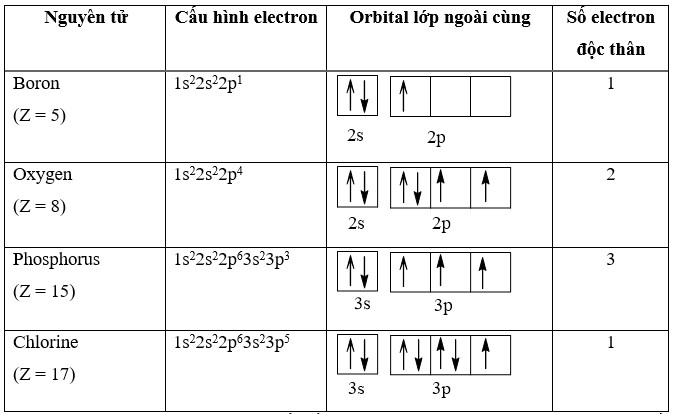
3. Phân Tích Cấu Hình Electron Của Boron (B)
Boron là một nguyên tố hóa học có ký hiệu B và số nguyên tử là 5. Cấu hình electron của Boron là 1s²2s²2p¹. Hãy cùng phân tích để xác định số electron độc thân của Boron.
Cấu Hình Electron Của Boron
Cấu hình electron của Boron (B, Z=5): 1s²2s²2p¹
Phân Tích Cấu Hình Electron
- Phân Lớp 1s: Chứa 2 electron (1s²)
- Phân Lớp 2s: Chứa 2 electron (2s²)
- Phân Lớp 2p: Chứa 1 electron (2p¹)
Phân lớp 2p có 3 orbital (2px, 2py, 2pz). Theo quy tắc Hund, electron sẽ chiếm một orbital duy nhất.
Số Electron Độc Thân Của Boron
Boron có 1 electron độc thân ở phân lớp 2p.
4. Phân Tích Cấu Hình Electron Của Oxygen (O)
Oxygen là một nguyên tố hóa học có ký hiệu O và số nguyên tử là 8. Cấu hình electron của Oxygen là 1s²2s²2p⁴. Hãy cùng phân tích để xác định số electron độc thân của Oxygen.
Cấu Hình Electron Của Oxygen
Cấu hình electron của Oxygen (O, Z=8): 1s²2s²2p⁴
Phân Tích Cấu Hình Electron
- Phân Lớp 1s: Chứa 2 electron (1s²)
- Phân Lớp 2s: Chứa 2 electron (2s²)
- Phân Lớp 2p: Chứa 4 electron (2p⁴)
Phân lớp 2p có 3 orbital (2px, 2py, 2pz). Theo quy tắc Hund, electron sẽ chiếm từng orbital một cách riêng lẻ trước khi ghép đôi.
Sơ Đồ Orbital Của Oxygen
- 2px: ↑↓
- 2py: ↑
- 2pz: ↑
Số Electron Độc Thân Của Oxygen
Oxygen có 2 electron độc thân ở phân lớp 2p.
5. Phân Tích Cấu Hình Electron Của Phosphorus (P)
Phosphorus là một nguyên tố hóa học có ký hiệu P và số nguyên tử là 15. Cấu hình electron của Phosphorus là 1s²2s²2p⁶3s²3p³. Hãy cùng phân tích để xác định số electron độc thân của Phosphorus.
Cấu Hình Electron Của Phosphorus
Cấu hình electron của Phosphorus (P, Z=15): 1s²2s²2p⁶3s²3p³
Phân Tích Cấu Hình Electron
- Phân Lớp 1s: Chứa 2 electron (1s²)
- Phân Lớp 2s: Chứa 2 electron (2s²)
- Phân Lớp 2p: Chứa 6 electron (2p⁶)
- Phân Lớp 3s: Chứa 2 electron (3s²)
- Phân Lớp 3p: Chứa 3 electron (3p³)
Phân lớp 3p có 3 orbital (3px, 3py, 3pz). Theo quy tắc Hund, electron sẽ chiếm từng orbital một cách riêng lẻ.
Sơ Đồ Orbital Của Phosphorus
- 3px: ↑
- 3py: ↑
- 3pz: ↑
Số Electron Độc Thân Của Phosphorus
Phosphorus có 3 electron độc thân ở phân lớp 3p.
6. Phân Tích Cấu Hình Electron Của Chlorine (Cl)
Chlorine là một nguyên tố hóa học có ký hiệu Cl và số nguyên tử là 17. Cấu hình electron của Chlorine là 1s²2s²2p⁶3s²3p⁵. Hãy cùng phân tích để xác định số electron độc thân của Chlorine.
Cấu Hình Electron Của Chlorine
Cấu hình electron của Chlorine (Cl, Z=17): 1s²2s²2p⁶3s²3p⁵
Phân Tích Cấu Hình Electron
- Phân Lớp 1s: Chứa 2 electron (1s²)
- Phân Lớp 2s: Chứa 2 electron (2s²)
- Phân Lớp 2p: Chứa 6 electron (2p⁶)
- Phân Lớp 3s: Chứa 2 electron (3s²)
- Phân Lớp 3p: Chứa 5 electron (3p⁵)
Phân lớp 3p có 3 orbital (3px, 3py, 3pz). Theo quy tắc Hund, electron sẽ chiếm từng orbital một cách riêng lẻ trước khi ghép đôi.
Sơ Đồ Orbital Của Chlorine
- 3px: ↑↓
- 3py: ↑↓
- 3pz: ↑
Số Electron Độc Thân Của Chlorine
Chlorine có 1 electron độc thân ở phân lớp 3p.
 ở trạng thái cơ bản, nguyên tử của những nguyên tố nào dưới đây có electron độc thân?
ở trạng thái cơ bản, nguyên tử của những nguyên tố nào dưới đây có electron độc thân?
7. Ảnh Hưởng Của Electron Độc Thân Đến Tính Chất Hóa Học
Electron độc thân đóng vai trò quan trọng trong việc xác định tính chất hóa học của các nguyên tố và hợp chất. Sự hiện diện của electron độc thân làm tăng khả năng tham gia phản ứng hóa học của một chất.
Tính Chất Hóa Học Của Các Nguyên Tố Có Electron Độc Thân
- Tính Oxi Hóa – Khử: Các nguyên tố có electron độc thân thường có khả năng oxi hóa hoặc khử mạnh mẽ. Ví dụ, oxygen với hai electron độc thân là một chất oxi hóa mạnh, tham gia vào quá trình đốt cháy và ăn mòn.
- Khả Năng Tạo Liên Kết: Electron độc thân tạo điều kiện cho việc hình thành liên kết hóa học. Các nguyên tử có electron độc thân có thể dễ dàng tạo liên kết cộng hóa trị bằng cách chia sẻ electron hoặc tạo liên kết ion bằng cách nhường hoặc nhận electron.
- Tính Chất Acid – Base: Một số hợp chất chứa electron độc thân có thể thể hiện tính chất acid hoặc base, tùy thuộc vào khả năng nhận hoặc nhường electron.
Ví Dụ Cụ Thể
- Oxygen (O): Với hai electron độc thân, oxygen là một chất oxi hóa mạnh, cần thiết cho sự sống và tham gia vào nhiều quá trình hóa học quan trọng.
- Chlorine (Cl): Với một electron độc thân, chlorine là một chất khử trùng mạnh, được sử dụng rộng rãi trong việc làm sạch nước và các ứng dụng công nghiệp khác.
- Các Gốc Tự Do: Các gốc tự do chứa electron độc thân có thể gây ra các phản ứng dây chuyền, ảnh hưởng đến sức khỏe và gây ra các bệnh tật.
8. Electron Độc Thân Trong Các Ứng Dụng Thực Tế
Electron độc thân không chỉ là một khái niệm lý thuyết mà còn có nhiều ứng dụng quan trọng trong thực tế.
Ứng Dụng Trong Công Nghiệp Hóa Chất
- Xúc Tác Hóa Học: Các chất xúc tác chứa electron độc thân có thể tăng tốc độ phản ứng hóa học. Ví dụ, các phức kim loại chuyển tiếp chứa electron độc thân được sử dụng trong nhiều quy trình công nghiệp để sản xuất hóa chất và vật liệu.
- Polyme Hóa: Electron độc thân tham gia vào quá trình polyme hóa, tạo ra các vật liệu polyme với các tính chất đặc biệt.
Ứng Dụng Trong Y Học
- Chất Chống Oxy Hóa: Các chất chống oxy hóa có khả năng trung hòa các gốc tự do bằng cách cung cấp electron để ghép đôi với electron độc thân, giúp bảo vệ tế bào khỏi tổn thương.
- Chẩn Đoán Hình Ảnh: Các hợp chất chứa electron độc thân được sử dụng trong các kỹ thuật chẩn đoán hình ảnh như cộng hưởng từ electron spin (ESR) để phát hiện các gốc tự do và các tổn thương trong cơ thể.
Ứng Dụng Trong Công Nghệ Vật Liệu
- Vật Liệu Từ Tính: Các vật liệu chứa electron độc thân có tính chất từ đặc biệt, được sử dụng trong các thiết bị lưu trữ dữ liệu và các ứng dụng điện tử khác.
- Vật Liệu Bán Dẫn: Electron độc thân có thể ảnh hưởng đến tính chất điện của vật liệu bán dẫn, được sử dụng trong sản xuất các linh kiện điện tử.
9. Các Yếu Tố Ảnh Hưởng Đến Sự Tồn Tại Của Electron Độc Thân
Sự tồn tại của electron độc thân trong một nguyên tử hoặc phân tử có thể bị ảnh hưởng bởi nhiều yếu tố khác nhau.
Ảnh Hưởng Của Nhiệt Độ
Nhiệt độ có thể ảnh hưởng đến sự ổn định của các electron độc thân. Ở nhiệt độ cao, các phân tử có thể nhận thêm năng lượng, làm tăng khả năng tạo ra các gốc tự do với electron độc thân.
Ảnh Hưởng Của Ánh Sáng
Ánh sáng, đặc biệt là ánh sáng có năng lượng cao như tia UV, có thể kích thích các phân tử và tạo ra các electron độc thân. Quá trình này được gọi là quang phân (photolysis).
Ảnh Hưởng Của Các Chất Xúc Tác
Một số chất xúc tác có thể thúc đẩy quá trình tạo ra hoặc loại bỏ electron độc thân. Ví dụ, các kim loại chuyển tiếp thường được sử dụng làm chất xúc tác trong các phản ứng liên quan đến electron độc thân.
Ảnh Hưởng Của Môi Trường Hóa Học
Môi trường hóa học xung quanh cũng có thể ảnh hưởng đến sự tồn tại của electron độc thân. Các chất oxi hóa có thể loại bỏ electron độc thân, trong khi các chất khử có thể tạo ra chúng.
10. Các Nghiên Cứu Mới Nhất Về Electron Độc Thân
Các nghiên cứu về electron độc thân vẫn đang tiếp tục phát triển, mở ra nhiều ứng dụng tiềm năng trong các lĩnh vực khác nhau.
Nghiên Cứu Về Gốc Tự Do Trong Y Học
Các nhà khoa học đang nghiên cứu về vai trò của gốc tự do trong các bệnh như ung thư, bệnh tim mạch và bệnh Alzheimer. Các nghiên cứu này có thể dẫn đến việc phát triển các phương pháp điều trị mới dựa trên việc kiểm soát gốc tự do.
Nghiên Cứu Về Vật Liệu Từ Tính
Các nhà vật lý đang tìm kiếm các vật liệu từ tính mới có electron độc thân để sử dụng trong các thiết bị lưu trữ dữ liệu và các ứng dụng điện tử tiên tiến.
Nghiên Cứu Về Xúc Tác Hóa Học
Các nhà hóa học đang phát triển các chất xúc tác mới chứa electron độc thân để tăng hiệu quả của các phản ứng hóa học và giảm thiểu tác động đến môi trường.
11. Câu Hỏi Thường Gặp Về Electron Độc Thân (FAQ)
1. Electron độc thân có phải là ion không?
Không, electron độc thân không phải là ion. Ion là nguyên tử hoặc phân tử mang điện tích do mất hoặc nhận electron, trong khi electron độc thân chỉ là electron đơn lẻ trong một orbital.
2. Tất cả các nguyên tố đều có electron độc thân ở trạng thái cơ bản?
Không, không phải tất cả các nguyên tố đều có electron độc thân ở trạng thái cơ bản. Chỉ những nguyên tố có cấu hình electron sao cho có orbital chứa electron đơn lẻ mới có electron độc thân.
3. Electron độc thân có hại cho sức khỏe không?
Electron độc thân trong các gốc tự do có thể gây hại cho sức khỏe nếu không được kiểm soát. Tuy nhiên, electron độc thân cũng có vai trò quan trọng trong nhiều quá trình sinh học và công nghiệp.
4. Làm thế nào để đo số lượng electron độc thân trong một chất?
Số lượng electron độc thân trong một chất có thể được đo bằng các kỹ thuật như cộng hưởng từ electron spin (ESR) hoặc phương pháp từ kế.
5. Tại sao electron độc thân lại quan trọng trong xúc tác hóa học?
Electron độc thân có thể tạo ra các trung tâm hoạt động trên bề mặt chất xúc tác, giúp tăng tốc độ phản ứng hóa học và cải thiện hiệu suất.
12. Tại Sao Nên Tìm Hiểu Về Electron Độc Thân Tại Xe Tải Mỹ Đình?
Tại XETAIMYDINH.EDU.VN, chúng tôi cung cấp thông tin chi tiết và dễ hiểu về electron độc thân, giúp bạn nắm vững kiến thức cơ bản và ứng dụng thực tế của chúng. Đội ngũ chuyên gia của chúng tôi luôn sẵn sàng giải đáp mọi thắc mắc và cung cấp các thông tin mới nhất về lĩnh vực này.
Lợi Ích Khi Tìm Hiểu Tại Xe Tải Mỹ Đình
- Thông Tin Đáng Tin Cậy: Chúng tôi cung cấp thông tin chính xác và được kiểm chứng từ các nguồn uy tín.
- Giải Thích Dễ Hiểu: Chúng tôi sử dụng ngôn ngữ đơn giản và dễ hiểu để giúp bạn nắm bắt kiến thức một cách nhanh chóng.
- Hỗ Trợ Tận Tình: Đội ngũ chuyên gia của chúng tôi luôn sẵn sàng giải đáp mọi thắc mắc của bạn.
- Cập Nhật Liên Tục: Chúng tôi luôn cập nhật các thông tin và nghiên cứu mới nhất về electron độc thân.
Nếu bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải ở Mỹ Đình, hãy truy cập XETAIMYDINH.EDU.VN ngay hôm nay. Chúng tôi cam kết cung cấp cho bạn những thông tin tốt nhất và hỗ trợ tận tình để bạn có thể đưa ra quyết định đúng đắn nhất.
Liên hệ với chúng tôi:
- Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội
- Hotline: 0247 309 9988
- Trang web: XETAIMYDINH.EDU.VN
Hãy để XETAIMYDINH.EDU.VN giúp bạn khám phá thế giới xe tải một cách dễ dàng và hiệu quả nhất.

