NO3 đóng vai trò quan trọng trong nhiều lĩnh vực, từ nông nghiệp đến xử lý nước. Vậy No3 Số Oxi Hóa là bao nhiêu và ảnh hưởng của nó ra sao? Hãy cùng Xe Tải Mỹ Đình tìm hiểu chi tiết về NO3, số oxi hóa của nó và những ứng dụng thực tế trong đời sống. Với đội ngũ chuyên gia giàu kinh nghiệm, XETAIMYDINH.EDU.VN sẽ cung cấp cho bạn những thông tin chính xác và dễ hiểu nhất về chủ đề này, giúp bạn nắm vững kiến thức và ứng dụng hiệu quả. Khám phá ngay về các hợp chất nitrat, ion nitrat và phản ứng oxi hóa khử.
1. NO3 Là Gì? Tổng Quan Về Ion Nitrat
Trước khi đi sâu vào tìm hiểu NO3 số oxi hóa, chúng ta cần hiểu rõ NO3 là gì. NO3, hay còn gọi là ion nitrat, là một anion đa nguyên tử có công thức hóa học NO3-. Nó bao gồm một nguyên tử nitơ (N) trung tâm liên kết với ba nguyên tử oxy (O) giống hệt nhau theo cách sắp xếp tam giác phẳng. Ion nitrat là bazơ liên hợp của axit nitric (HNO3).
NO3 tồn tại rộng rãi trong tự nhiên và đóng vai trò quan trọng trong chu trình nitơ. Nó là một nguồn nitơ quan trọng cho thực vật và được sử dụng rộng rãi trong nông nghiệp làm phân bón.
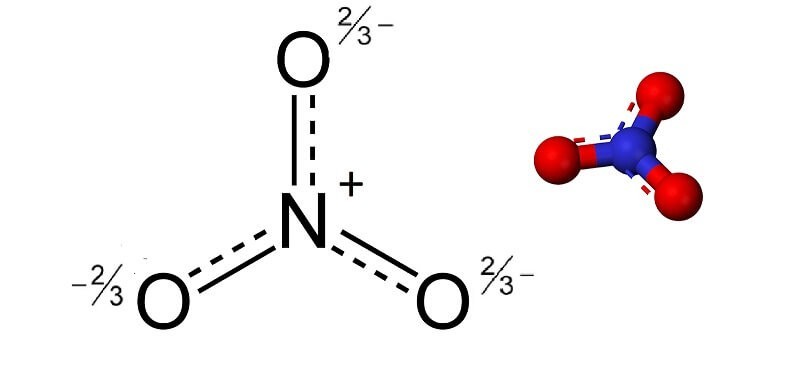 Ion nitrat (NO3-) với cấu trúc tam giác phẳng
Ion nitrat (NO3-) với cấu trúc tam giác phẳng
Ion nitrat (NO3-) với cấu trúc tam giác phẳng, thể hiện một nguyên tử nitơ liên kết với ba nguyên tử oxy
2. Xác Định NO3 Số Oxi Hóa Của Nitơ (N) Trong Ion Nitrat
Vậy, NO3 số oxi hóa của nitơ là bao nhiêu? Để xác định số oxi hóa của nitơ trong ion nitrat (NO3-), chúng ta áp dụng các quy tắc sau:
- Số oxi hóa của oxy (O) thường là -2.
- Tổng số oxi hóa của tất cả các nguyên tử trong một ion bằng điện tích của ion đó.
Trong ion NO3-, chúng ta có:
- Số oxi hóa của oxy (O) = -2
- Có 3 nguyên tử oxy, nên tổng số oxi hóa của oxy là 3 * (-2) = -6
- Tổng số oxi hóa của ion NO3- là -1
Gọi số oxi hóa của nitơ (N) là x, ta có phương trình:
x + (-6) = -1
Giải phương trình, ta được:
x = +5
Vậy, số oxi hóa của nitơ (N) trong ion nitrat (NO3-) là +5. Đây là một thông tin quan trọng khi xét các phản ứng hóa học liên quan đến ion nitrat.
3. Nguồn Gốc Phát Sinh NO3 Trong Môi Trường
NO3 số oxi hóa đã được xác định, nhưng NO3 từ đâu mà có? Ion nitrat (NO3-) có thể phát sinh từ nhiều nguồn khác nhau trong môi trường:
- Quá trình tự nhiên:
- Nitrat hóa: Vi khuẩn trong đất chuyển đổi amoniac (NH3) thành nitrit (NO2-) và sau đó thành nitrat (NO3-). Đây là một phần quan trọng của chu trình nitơ.
- Phân hủy chất hữu cơ: Xác động thực vật phân hủy giải phóng nitơ hữu cơ, sau đó được chuyển đổi thành nitrat.
- Sấm sét: Năng lượng từ sấm sét có thể chuyển đổi nitơ trong không khí thành oxit nitơ, sau đó phản ứng với nước để tạo thành nitrat.
- Hoạt động của con người:
- Sử dụng phân bón: Phân bón chứa nitơ (như ure, amoni nitrat) được sử dụng rộng rãi trong nông nghiệp. Một phần nitơ này có thể bị rửa trôi vào nguồn nước.
- Nước thải sinh hoạt và công nghiệp: Nước thải chứa nitơ từ chất thải sinh hoạt, công nghiệp thực phẩm, và các ngành công nghiệp khác.
- Chăn nuôi: Chất thải từ chăn nuôi chứa nhiều nitơ, có thể ngấm vào đất và nguồn nước.
Hiểu rõ nguồn gốc phát sinh NO3 giúp chúng ta kiểm soát và giảm thiểu ô nhiễm nitrat trong môi trường.
4. Tính Chất Hóa Học Đặc Trưng Của NO3
Ion nitrat (NO3-) có nhiều tính chất hóa học quan trọng, ảnh hưởng đến cách nó tương tác với các chất khác. Dưới đây là một số tính chất nổi bật:
- Tính oxi hóa: NO3- là một chất oxi hóa mạnh, đặc biệt trong môi trường axit. Nó có thể oxi hóa nhiều kim loại và hợp chất khác.
- Phản ứng với axit: Trong môi trường axit, NO3- có thể phản ứng với kim loại để tạo ra oxit nitơ (NOx) hoặc amoniac (NH3), tùy thuộc vào điều kiện phản ứng.
- Phản ứng nhiệt phân: Khi đun nóng, muối nitrat có thể bị phân hủy thành nitrit và oxy, hoặc thành oxit kim loại, nitơ dioxit và oxy.
- Tính tan: Hầu hết các muối nitrat đều tan tốt trong nước. Điều này giải thích tại sao nitrat dễ dàng bị rửa trôi từ đất vào nguồn nước.
- Phản ứng với dung dịch kiềm: NO3- có thể oxi hóa các kim loại lưỡng tính trong môi trường kiềm.
Ví dụ về phản ứng nhiệt phân:
2KNO3 (rắn) → 2KNO2 (rắn) + O2 (khí)
Ví dụ về phản ứng với axit:
3Cu (rắn) + 8H+ (dung dịch) + 2NO3- (dung dịch) → 3Cu2+ (dung dịch) + 2NO (khí) + 4H2O (lỏng)
5. Phương Pháp Nhận Biết Ion Nitrat (NO3-)
Làm thế nào để nhận biết ion nitrat (NO3-) trong phòng thí nghiệm? Có một số phương pháp phổ biến được sử dụng:
- Phản ứng với vụn đồng và axit sunfuric loãng:
- Cho vụn đồng vào dung dịch chứa nitrat, thêm axit sunfuric loãng và đun nóng.
- Nếu có ion nitrat, dung dịch sẽ chuyển sang màu xanh lam và có khí không màu bay ra, hóa nâu trong không khí.
- Phản ứng:
- 3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
- 2NO + O2 → 2NO2 (khí màu nâu đỏ)
- Phản ứng với diphenylamine:
- Thêm vài giọt dung dịch diphenylamine vào dung dịch chứa nitrat trong môi trường axit mạnh.
- Nếu có ion nitrat, dung dịch sẽ chuyển sang màu xanh đậm.
- Sử dụng thuốc thử Nessler:
- Thuốc thử Nessler (K2[HgI4]) phản ứng với amoniac (NH3). Để phát hiện nitrat, trước tiên cần khử nitrat thành amoniac bằng kim loại Zn trong môi trường kiềm.
- Sau đó, thêm thuốc thử Nessler. Nếu có amoniac, dung dịch sẽ chuyển sang màu vàng hoặc nâu.
Phương pháp sử dụng vụn đồng và axit sunfuric loãng là phổ biến và dễ thực hiện trong phòng thí nghiệm.
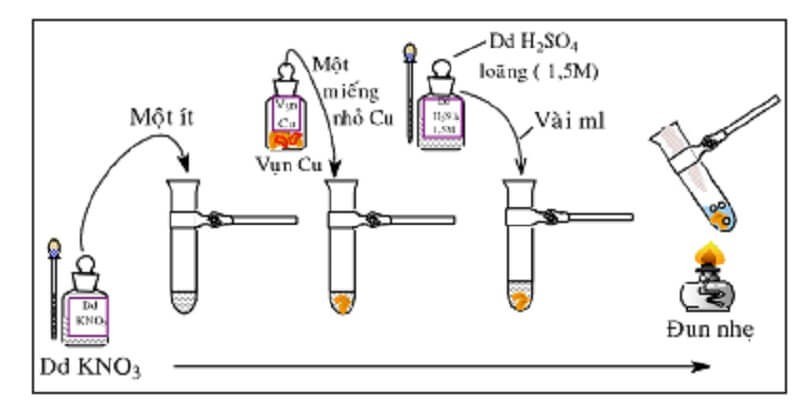 Phản ứng nhận biết ion NO3- bằng vụn đồng và axit sunfuric
Phản ứng nhận biết ion NO3- bằng vụn đồng và axit sunfuric
Phản ứng giữa vụn đồng, ion nitrat và axit sunfuric tạo ra dung dịch màu xanh và khí màu nâu đỏ, giúp nhận biết sự hiện diện của NO3-
6. Tác Hại Của NO3 Đối Với Sức Khỏe Con Người, Sinh Vật Và Môi Trường
Mặc dù nitrat (NO3-) là một chất dinh dưỡng cần thiết cho cây trồng, nhưng nồng độ cao có thể gây ra nhiều tác hại:
6.1. Tác hại đối với sức khỏe con người
- Hội chứng Methemoglobinemia (bệnh xanh xao ở trẻ sơ sinh): Trẻ sơ sinh dưới 6 tháng tuổi dễ mắc bệnh này khi uống nước có nồng độ nitrat cao. Nitrat chuyển thành nitrit trong ruột, nitrit hấp thụ vào máu và oxi hóa hemoglobin thành methemoglobin, làm giảm khả năng vận chuyển oxy của máu.
- Nguy cơ ung thư: Một số nghiên cứu cho thấy nitrat có thể chuyển đổi thành nitrosamine trong cơ thể, là chất gây ung thư.
- Ảnh hưởng đến hệ tiêu hóa: Nồng độ nitrat cao có thể gây rối loạn tiêu hóa, khó tiêu.
Theo khuyến cáo của Tổ chức Y tế Thế giới (WHO), nồng độ nitrat trong nước uống không nên vượt quá 50 mg/l.
6.2. Tác hại đối với sinh vật
- Ảnh hưởng đến thủy sản: Nồng độ nitrat cao trong ao nuôi thủy sản có thể gây giảm sinh sản, chậm lớn, và tăng nguy cơ mắc bệnh ở tôm, cá.
- Gây độc cho động vật: Động vật ăn phải thức ăn hoặc nước uống chứa nhiều nitrat có thể bị ngộ độc.
6.3. Tác hại đối với môi trường
- Ô nhiễm nguồn nước: Nitrat từ phân bón và chất thải có thể ngấm vào nguồn nước, gây ô nhiễm.
- Eutrophication (phú dưỡng): Nitrat là chất dinh dưỡng thúc đẩy sự phát triển quá mức của tảo và thực vật thủy sinh, gây thiếu oxy trong nước, ảnh hưởng đến hệ sinh thái.
- Ảnh hưởng đến đa dạng sinh học: Ô nhiễm nitrat có thể làm thay đổi thành phần loài trong hệ sinh thái.
 Ô nhiễm nitrat gây phú dưỡng nguồn nước
Ô nhiễm nitrat gây phú dưỡng nguồn nước
Sự phát triển quá mức của tảo do ô nhiễm nitrat gây ra hiện tượng phú dưỡng, ảnh hưởng tiêu cực đến hệ sinh thái nước
7. Ứng Dụng Của NO3 Trong Đời Sống Và Sản Xuất
Mặc dù có những tác hại nhất định, nitrat (NO3-) vẫn có nhiều ứng dụng quan trọng trong đời sống và sản xuất:
- Phân bón: Nitrat là nguồn cung cấp nitơ chính cho cây trồng. Các loại phân bón như amoni nitrat (NH4NO3), kali nitrat (KNO3) cung cấp nitơ dễ hấp thụ cho cây, giúp tăng năng suất.
- Sản xuất thuốc nổ: Nitrat được sử dụng trong sản xuất thuốc nổ, pháo hoa. Ví dụ, kali nitrat là thành phần quan trọng trong thuốc súng đen.
- Chất bảo quản thực phẩm: Natri nitrat (NaNO3) và kali nitrat (KNO3) được sử dụng làm chất bảo quản trong thịt chế biến, giúp ngăn ngừa sự phát triển của vi khuẩn Clostridium botulinum (gây ngộ độc botulism).
- Y học: Bismuth subnitrat được sử dụng trong một số loại thuốc để điều trị các vấn đề tiêu hóa.
- Xử lý nước thải: Trong một số hệ thống xử lý nước thải, nitrat được sử dụng để loại bỏ sulfide và các chất ô nhiễm khác.
- Sản xuất axit nitric: Nitrat là nguyên liệu để sản xuất axit nitric (HNO3), một hóa chất quan trọng trong công nghiệp.
8. Các Biện Pháp Giảm Thiểu Tác Hại Của NO3 Trong Nông Nghiệp Và Môi Trường
Để giảm thiểu tác hại của nitrat (NO3-) trong nông nghiệp và môi trường, cần áp dụng các biện pháp sau:
- Sử dụng phân bón hợp lý:
- Bón đúng liều lượng: Tính toán lượng phân bón cần thiết dựa trên nhu cầu của cây trồng và đặc điểm của đất. Tránh bón quá nhiều phân.
- Bón đúng thời điểm: Bón phân vào thời điểm cây trồng cần nhiều dinh dưỡng nhất.
- Sử dụng phân bón chậm tan: Phân bón chậm tan giúp giảm lượng nitrat bị rửa trôi.
- Kết hợp phân bón hữu cơ và vô cơ: Phân bón hữu cơ giúp cải thiện cấu trúc đất, tăng khả năng giữ nước và dinh dưỡng.
- Quản lý chất thải chăn nuôi:
- Xây dựng hệ thống xử lý chất thải: Xử lý chất thải chăn nuôi trước khi thải ra môi trường.
- Sử dụng chất thải làm phân bón: Ủ phân chuồng để sử dụng làm phân bón cho cây trồng.
- Cải thiện kỹ thuật tưới tiêu:
- Sử dụng hệ thống tưới nhỏ giọt: Tưới nhỏ giọt giúp cung cấp nước và dinh dưỡng trực tiếp đến rễ cây, giảm lượng nước và phân bón bị lãng phí.
- Tránh tưới quá nhiều nước: Tưới quá nhiều nước có thể làm rửa trôi nitrat vào nguồn nước.
- Trồng cây che phủ:
- Trồng cây che phủ giữa các vụ mùa giúp hấp thụ nitrat dư thừa trong đất.
- Xây dựng vùng đệm:
- Xây dựng vùng đệm thực vật ven sông, hồ để hấp thụ nitrat từ nước mặt.
- Kiểm soát ô nhiễm công nghiệp:
- Yêu cầu các nhà máy xử lý nước thải trước khi thải ra môi trường.
- Nâng cao nhận thức cộng đồng:
- Tuyên truyền, giáo dục người dân về tác hại của nitrat và các biện pháp giảm thiểu ô nhiễm.
Theo nghiên cứu của Trường Đại học Nông nghiệp Hà Nội, việc áp dụng các biện pháp quản lý dinh dưỡng hợp lý có thể giảm tới 30% lượng nitrat thất thoát vào môi trường.
9. So Sánh Số Oxi Hóa Của Nitơ Trong Các Hợp Chất Khác Nhau
Để hiểu rõ hơn về vai trò của NO3 số oxi hóa, hãy so sánh số oxi hóa của nitơ trong một số hợp chất khác nhau:
| Hợp chất | Số oxi hóa của N |
|---|---|
| NH3 (amoniac) | -3 |
| N2H4 (hydrazine) | -2 |
| NH2OH (hydroxylamine) | -1 |
| N2 (nitơ) | 0 |
| N2O (nitơ oxit) | +1 |
| NO (nitơ monoxide) | +2 |
| N2O3 (nitơ trioxit) | +3 |
| NO2 (nitơ dioxide) | +4 |
| N2O5 (nitơ pentoxit) | +5 |
| HNO3 (axit nitric) | +5 |
| NO3- (ion nitrat) | +5 |
Bảng trên cho thấy nitơ có thể có nhiều số oxi hóa khác nhau, từ -3 đến +5, tùy thuộc vào hợp chất. Số oxi hóa của nitơ trong ion nitrat (NO3-) là +5, là số oxi hóa cao nhất của nitơ.
10. Các Câu Hỏi Thường Gặp Về NO3 Số Oxi Hóa (FAQ)
Để giúp bạn hiểu rõ hơn về NO3 số oxi hóa, Xe Tải Mỹ Đình xin tổng hợp một số câu hỏi thường gặp:
10.1. Số oxi hóa của N trong NO3 là bao nhiêu?
Số oxi hóa của nitơ (N) trong ion nitrat (NO3-) là +5.
10.2. Tại sao số oxi hóa của O là -2 trong NO3?
Oxy thường có số oxi hóa -2 trong hầu hết các hợp chất, trừ một số trường hợp đặc biệt như OF2 hoặc peroxide.
10.3. NO3 có tính oxi hóa hay tính khử?
NO3- có tính oxi hóa, đặc biệt trong môi trường axit.
10.4. NO3 có độc không?
NO3- không độc trực tiếp, nhưng có thể chuyển đổi thành nitrit (NO2-) trong cơ thể, gây hại cho sức khỏe, đặc biệt là trẻ sơ sinh.
10.5. Làm thế nào để giảm nồng độ NO3 trong nước uống?
Có thể sử dụng các phương pháp như trao đổi ion, thẩm thấu ngược, hoặc khử nitrat sinh học để giảm nồng độ NO3- trong nước uống.
10.6. NO3 có vai trò gì trong nông nghiệp?
NO3- là nguồn cung cấp nitơ chính cho cây trồng, giúp tăng trưởng và phát triển.
10.7. Nguồn gốc chính của NO3 trong môi trường là gì?
Nguồn gốc chính của NO3- trong môi trường là từ phân bón, chất thải chăn nuôi, và nước thải sinh hoạt và công nghiệp.
10.8. Làm thế nào để nhận biết ion NO3- trong phòng thí nghiệm?
Có thể sử dụng phản ứng với vụn đồng và axit sunfuric loãng để nhận biết ion NO3-.
10.9. NO3 ảnh hưởng đến môi trường như thế nào?
NO3- có thể gây ô nhiễm nguồn nước và gây ra hiện tượng phú dưỡng.
10.10. Các biện pháp giảm thiểu tác hại của NO3 là gì?
Các biện pháp bao gồm sử dụng phân bón hợp lý, quản lý chất thải chăn nuôi, cải thiện kỹ thuật tưới tiêu, và trồng cây che phủ.
Thông qua những câu hỏi và trả lời này, hy vọng bạn đã có cái nhìn tổng quan và chi tiết hơn về NO3 số oxi hóa và các vấn đề liên quan.
Bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải ở Mỹ Đình? Bạn muốn được tư vấn lựa chọn xe phù hợp với nhu cầu và ngân sách? Hãy truy cập ngay XETAIMYDINH.EDU.VN hoặc liên hệ hotline 0247 309 9988 để được đội ngũ chuyên gia của Xe Tải Mỹ Đình hỗ trợ tận tình! Chúng tôi cam kết cung cấp những thông tin chính xác, cập nhật và hữu ích nhất, giúp bạn đưa ra quyết định sáng suốt. Địa chỉ của chúng tôi: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội. Xe Tải Mỹ Đình – đồng hành cùng bạn trên mọi nẻo đường!