Bạn đang gặp khó khăn khi làm bài tập hóa học liên quan đến NO3 và muốn tìm hiểu rõ về hóa trị của nó? Bạn thắc mắc về nguồn gốc phát sinh của NO3 trong tự nhiên và ứng dụng thực tế của nó? Hãy cùng Xe Tải Mỹ Đình khám phá tất tần tật về NO3, từ hóa trị đến ứng dụng và những điều cần lưu ý. Chúng tôi sẽ cung cấp cho bạn những thông tin chi tiết, dễ hiểu và được cập nhật mới nhất về NO3.
1. Định Nghĩa NO3 Là Gì?
Trước khi đi sâu vào tìm hiểu No3 Hóa Trị Mấy, chúng ta cần hiểu rõ về bản chất của NO3. NO3, hay còn gọi là ion nitrat, là một chất hóa học bao gồm một nguyên tử nitơ (N) liên kết với ba nguyên tử oxy (O) theo cấu trúc hình tam giác phẳng. Nó là bazơ liên hợp của axit nitric (HNO3) và còn được biết đến với các tên gọi khác như nitrate hoặc nitrat. Khối lượng phân tử của NO3 là khoảng 62 amu.
Trong môi trường nước, dưới tác động của vi khuẩn, amoniac (NH3) bị phân hủy tạo thành nitrit (NO2-). NO3 là sản phẩm cuối cùng của quá trình oxy hóa này. Theo nghiên cứu của Bộ Tài nguyên và Môi trường năm 2020, nồng độ NO3 trong nước ngầm có thể tăng cao do ô nhiễm từ phân bón và chất thải sinh hoạt.
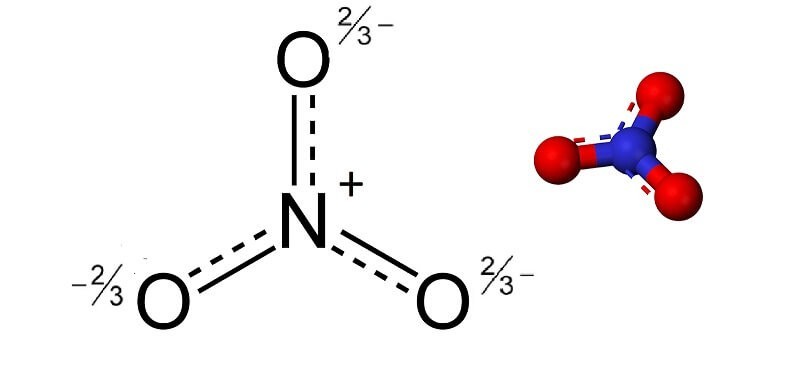 Cấu trúc ion nitrat NO3
Cấu trúc ion nitrat NO3
2. Vậy NO3 Hóa Trị Mấy?
Vậy, câu hỏi quan trọng nhất là NO3 hóa trị mấy? Ion nitrat (NO3-) được cấu tạo từ một nguyên tử nitơ (N) và ba nguyên tử oxy (O). Trong đó, nitơ có độ âm điện thấp hơn oxy, vì vậy nitơ mang điện tích dương và oxy mang điện tích âm.
Để xác định hóa trị của NO3, ta cần xem xét cấu trúc và điện tích của nó. Tổng điện tích của ion nitrat là -1. Oxy thường có hóa trị -2. Vì có ba nguyên tử oxy, tổng số điện tích âm từ oxy là -6. Để ion nitrat có điện tích -1, nitơ phải có hóa trị +5. Như vậy, hóa trị của nhóm NO3 là -1.
Tóm lại, NO3 có hóa trị -1.
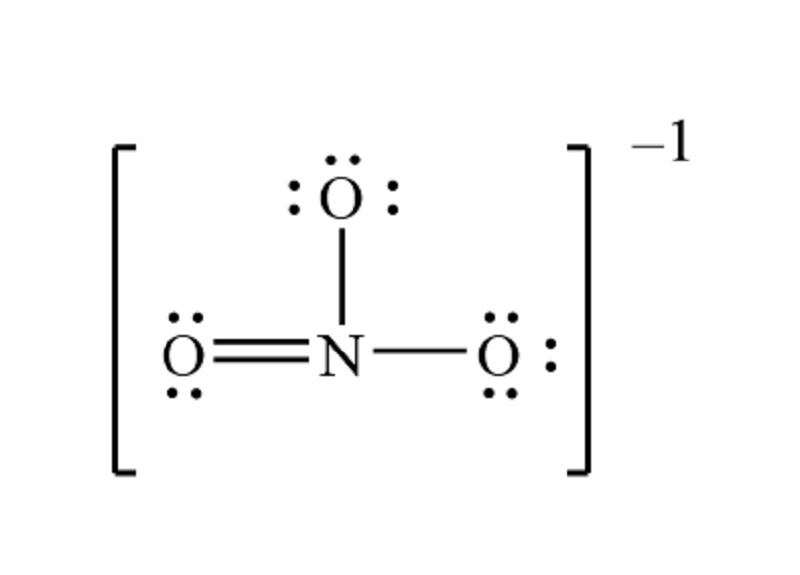 Ion nitrat NO3- có hóa trị -1
Ion nitrat NO3- có hóa trị -1
3. Nguồn Gốc Phát Sinh NO3 Từ Đâu?
Sau khi đã làm rõ NO3 hóa trị mấy, chúng ta cùng tìm hiểu về các nguồn gốc phát sinh của NO3 trong tự nhiên và môi trường sống.
- Nitơ tự nhiên trong đất: NO3 có thể được hình thành từ nitơ tự nhiên có trong đất. Nitơ là một khí chiếm tỷ lệ lớn trong khí quyển, do đó quá trình phát sinh nitrate diễn ra thường xuyên.
- Thực phẩm và đồ uống: Một lượng nhỏ NO3 có mặt trong thực phẩm và đồ uống hàng ngày của con người. Tuy nhiên, chúng thường không gây hại nếu được tiêu thụ với lượng vừa phải.
- Cây trồng: Cây trồng hấp thụ NO3 từ đất. Do đó, lá và quả của cây có thể chứa một lượng nhỏ chất này. Theo một nghiên cứu của Viện Nghiên cứu Rau quả, lượng NO3 trong rau xanh có thể thay đổi tùy thuộc vào loại cây, điều kiện trồng và lượng phân bón sử dụng.
- Phân hủy hữu cơ: NO3 cũng có thể hình thành trong quá trình phân hủy xác động thực vật hoặc từ quá trình vi sinh vật chuyển hóa phân bón.
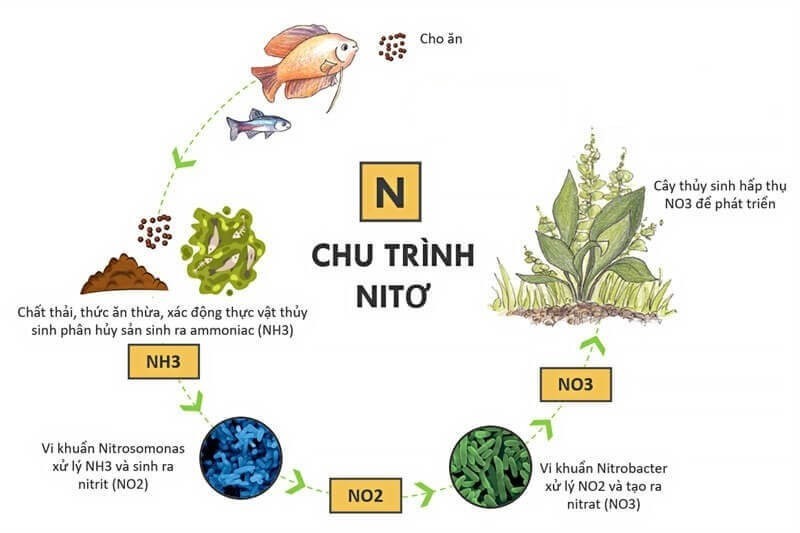 Chu trình sản sinh NO3 trong đất và môi trường
Chu trình sản sinh NO3 trong đất và môi trường
4. Tìm Hiểu Về Tính Chất Hóa Học Đặc Trưng Của NO3
NO3 không chỉ quan trọng về mặt hóa trị mà còn sở hữu những tính chất hóa học đặc trưng, đóng vai trò quan trọng trong nhiều phản ứng. Dưới đây là một số tính chất hóa học nổi bật của NO3:
-
Tính tan: Hầu hết các muối chứa ion nitrat (NO3-) đều tan tốt trong nước. Điều này là do lực hút giữa ion nitrat và các phân tử nước mạnh hơn lực hút giữa các ion trong mạng tinh thể của muối.
-
Tính oxi hóa: Ion nitrat là một chất oxi hóa, đặc biệt trong môi trường axit. Nó có thể oxi hóa nhiều kim loại và phi kim.
-
Phản ứng với axit: Trong môi trường axit mạnh, ion nitrat có thể phản ứng với kim loại để tạo ra khí NO (nitơ monoxit) hoặc NO2 (nitơ đioxit), tùy thuộc vào nồng độ axit và kim loại phản ứng.
-
Phản ứng nhiệt phân: Khi đun nóng, các muối nitrat có thể bị phân hủy, tạo ra các sản phẩm khác nhau tùy thuộc vào kim loại trong muối.
- Muối nitrat của các kim loại kiềm (như NaNO3, KNO3) phân hủy thành muối nitrit và oxy.
- Muối nitrat của các kim loại hoạt động trung bình (như Mg(NO3)2, Zn(NO3)2) phân hủy thành oxit kim loại, nitơ đioxit và oxy.
- Muối nitrat của các kim loại kém hoạt động (như AgNO3, Au(NO3)3) phân hủy thành kim loại, nitơ đioxit và oxy.
Ví dụ về phản ứng nhiệt phân:
- 2KNO3 → 2KNO2 + O2 (nhiệt phân kali nitrat)
- 2Cu(NO3)2 → 2CuO + 4NO2 + O2 (nhiệt phân đồng(II) nitrat)
- AgNO3 → Ag + NO2 + 1/2O2 (nhiệt phân bạc nitrat)
- Tan trong dung dịch kiềm: NO3- có thể oxi hóa các kim loại lưỡng tính hoặc tan trong dung dịch kiềm. Phương trình phản ứng: 8Al + 3NO3- + 5OH- + 2H2O → 8AlO2- + 3NH3. Trong đó, NH3 tạo thành là chất khí bay hơi.
- Tham gia phản ứng nhiệt phân:
- Nhiệt phân muối nitrat hoạt động trước Mg dưới điều kiện nhiệt độ cao: Nitrat → Nitrit + O2. Ví dụ: 2KNO3 → 2KNO2 + O2
- Đối với trường hợp muối nitrat hoạt động sau Cu (Đồng) kết thúc phản ứng tạo thành kim loại: Nitrat -> Kim loại + NO2 + O2. Ví dụ: AgNO3 → 2Ag + 2NO2 + O2
- Đối với trường hợp muối nitrat của kim loại trong khoảng từ Mg đến Cu, kết quả thu được là oxit kim loại và NO2, O2. Phương trình phản ứng: Nitrat → Oxit kim loại + NO2 + O2. Ví dụ: 2Cu(NO3)2 → 2CuO + 4NO2 + O2
- Phản ứng với axit:
- 3Fe2+ + NO3- + 4H+ → 3Fe3+ + NO↑ + 2H2O
- 3Cu + 2NO3- + 8H+ → 3Cu2+ + 2NO↑ + 4H2O
5. Các Phương Pháp Nhận Biết Ion Nitrat (NO3-)
Việc nhận biết ion nitrat (NO3-) là một kỹ năng quan trọng trong hóa học phân tích. Dưới đây là một số phương pháp phổ biến để nhận biết ion nitrat:
-
Phản ứng với đồng và axit sunfuric: Đây là phương pháp thường được sử dụng trong phòng thí nghiệm. Cho vụn đồng vào dung dịch chứa ion nitrat, sau đó thêm axit sunfuric loãng và đun nóng. Nếu có ion nitrat, dung dịch sẽ chuyển sang màu xanh và có khí màu nâu đỏ thoát ra.
- Phương trình phản ứng:
- 3Cu + 8H+ + 2NO3- → 3Cu2+ (dung dịch màu xanh) + 2NO↑ + 4H2O
- 2NO + O2 (không khí) → 2NO2 (màu nâu đỏ)
- Phương trình phản ứng:
-
Sử dụng thuốc thử diphenylamine: Thuốc thử diphenylamine tạo thành phức chất màu xanh lam với ion nitrat trong môi trường axit sulfuric đậm đặc.
-
Phản ứng với sắt(II) sunfat: Trong môi trường axit sulfuric đậm đặc, ion nitrat oxi hóa sắt(II) thành sắt(III), đồng thời tạo ra khí NO. Khí NO này sau đó phản ứng với sắt(II) sunfat dư để tạo thành phức chất màu nâu đen.
-
Sử dụng giấy quỳ tím: Ion nitrat không làm đổi màu giấy quỳ tím. Tuy nhiên, nếu có mặt axit nitric (HNO3) trong dung dịch, giấy quỳ tím sẽ chuyển sang màu đỏ.
-
Phương pháp sắc ký ion: Đây là phương pháp hiện đại, cho phép xác định và định lượng ion nitrat một cách chính xác.
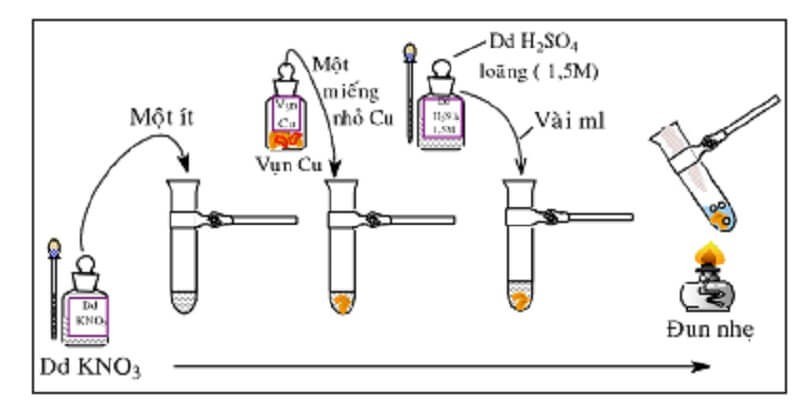 Phản ứng nhận biết NO3 bằng vụn đồng và axit sunfuric
Phản ứng nhận biết NO3 bằng vụn đồng và axit sunfuric
6. Tác Hại Của NO3 Đến Đời Sống Và Môi Trường
Sau khi đã nắm vững NO3 hóa trị mấy và các đặc tính liên quan, việc hiểu rõ tác hại của NO3 là vô cùng quan trọng. Điều này giúp chúng ta có ý thức hơn trong việc sử dụng và quản lý các hợp chất chứa NO3, giảm thiểu nguy cơ gây hại cho sức khỏe con người, sinh vật và môi trường sống.
6.1. Tác Hại Của NO3 Đối Với Sức Khỏe Con Người
- Đối với trẻ em: Thực phẩm hoặc nước uống có hàm lượng nitrate vượt quá 10 mg/l có thể gây ra tình trạng da xanh ở trẻ em, do nitrate chuyển hóa thành nitrite, làm giảm khả năng vận chuyển oxy của máu.
- Đối với người lớn: Cơ thể hấp thụ quá nhiều NO3 có thể làm suy giảm chức năng vận chuyển oxy, dẫn đến thiếu oxy lên não, gây nguy hiểm đến tính mạng.
- Gây ung thư: Một số nghiên cứu cho thấy rằng, khi vào cơ thể, NO3 có thể chuyển hóa thành các hợp chất nitrosamine, có khả năng gây ung thư.
6.2. Tác Hại Của NO3 Đối Với Sinh Vật
- Trong nuôi trồng thủy sản: Nồng độ NO3 cao có thể làm giảm khả năng sinh sản và phát triển của các loài thủy sản, gây ảnh hưởng trực tiếp đến cây trồng và vật nuôi. Ví dụ, tôm có thể bị cụt râu, cá bỏ ăn, bơi chậm chạp, nhợt nhạt và chết.
- Ảnh hưởng đến hệ sinh thái: Sự gia tăng nồng độ NO3 trong môi trường nước có thể gây ra hiện tượng phú dưỡng, làm bùng phát tảo độc, gây thiếu oxy trong nước, ảnh hưởng đến các loài sinh vật khác.
 Tác động tiêu cực của NO3 dư thừa đến môi trường sống của sinh vật
Tác động tiêu cực của NO3 dư thừa đến môi trường sống của sinh vật
6.3. Tác Hại Của NO3 Đối Với Môi Trường
- Ô nhiễm nguồn nước: Nồng độ NO3 quá cao trong không khí khiến cây cối không hấp thụ hết, ngấm vào đất và gây ô nhiễm nguồn nước ngầm.
- Ô nhiễm không khí: Các hoạt động sản xuất nông nghiệp và công nghiệp thải ra các khí chứa nitơ, góp phần vào ô nhiễm không khí và gây ra các vấn đề về sức khỏe hô hấp.
- Hiệu ứng nhà kính: Một số khí chứa nitơ, như nitơ oxit (N2O), là một trong những khí gây hiệu ứng nhà kính, góp phần vào biến đổi khí hậu. Theo báo cáo của Tổng cục Thống kê năm 2023, lượng phát thải khí nhà kính từ hoạt động nông nghiệp ở Việt Nam chiếm tỷ lệ đáng kể.
7. Ứng Dụng Thực Tế Của NO3 Trong Đời Sống Và Sản Xuất
Mặc dù có những tác hại nhất định, NO3 cũng đóng vai trò quan trọng trong nhiều lĩnh vực của đời sống và sản xuất. Dưới đây là một số ứng dụng phổ biến của NO3:
- Trong nông nghiệp: NO3 là thành phần chính của phân đạm, cung cấp nitơ cần thiết cho sự phát triển của cây trồng.
- Trong công nghiệp: NO3 được sử dụng trong sản xuất thuốc nổ, phân bón, thuốc nhuộm và các hóa chất khác.
- Trong y học: Một số hợp chất chứa NO3 được sử dụng trong điều trị bệnh tim mạch và các bệnh khác.
- Trong xử lý nước: NO3 có thể được sử dụng để loại bỏ các chất ô nhiễm trong nước.
8. Làm Thế Nào Để Giảm Thiểu Tác Hại Của NO3?
Để giảm thiểu tác hại của NO3, chúng ta cần thực hiện đồng bộ nhiều giải pháp, từ quản lý nguồn phát thải đến sử dụng hiệu quả và bền vững các hợp chất chứa NO3. Dưới đây là một số biện pháp cụ thể:
- Quản lý chặt chẽ việc sử dụng phân bón: Sử dụng phân bón đúng liều lượng, đúng thời điểm và đúng cách để tránh dư thừa NO3 trong đất. Ưu tiên sử dụng các loại phân bón hữu cơ và phân bón chậm tan.
- Xử lý nước thải: Xây dựng và vận hành hiệu quả các hệ thống xử lý nước thải để loại bỏ NO3 trước khi thải ra môi trường.
- Kiểm soát ô nhiễm không khí: Áp dụng các biện pháp kiểm soát ô nhiễm không khí từ các hoạt động sản xuất nông nghiệp và công nghiệp.
- Sử dụng nước tiết kiệm: Tiết kiệm nước trong sinh hoạt và sản xuất để giảm lượng nước thải chứa NO3.
- Nâng cao nhận thức cộng đồng: Tuyên truyền, giáo dục để nâng cao nhận thức của cộng đồng về tác hại của NO3 và các biện pháp giảm thiểu.
- Kiểm tra định kỳ nguồn nước: Thường xuyên kiểm tra chất lượng nguồn nước sinh hoạt để đảm bảo nồng độ NO3 không vượt quá ngưỡng cho phép. Theo quy định của Bộ Y tế, nồng độ NO3 tối đa cho phép trong nước sinh hoạt là 50 mg/l.
- Sử dụng các biện pháp sinh học: Áp dụng các biện pháp sinh học như trồng cây xanh, sử dụng vi sinh vật để hấp thụ NO3 trong đất và nước.
9. Các Câu Hỏi Thường Gặp Về NO3 (FAQ)
Để giúp bạn hiểu rõ hơn về NO3, Xe Tải Mỹ Đình xin tổng hợp một số câu hỏi thường gặp và giải đáp chi tiết:
-
NO3 có độc hại không?
- NO3 không trực tiếp gây độc, nhưng khi vào cơ thể có thể chuyển hóa thành nitrite, gây ảnh hưởng đến khả năng vận chuyển oxy của máu và có thể gây ung thư.
-
NO3 có trong những loại thực phẩm nào?
- NO3 có mặt trong nhiều loại rau xanh, củ quả, thịt chế biến và nước uống.
-
Làm thế nào để giảm lượng NO3 trong rau xanh?
- Bạn có thể giảm lượng NO3 trong rau xanh bằng cách rửa kỹ, gọt vỏ (nếu có thể), luộc hoặc xào trước khi ăn.
-
Nồng độ NO3 bao nhiêu là an toàn trong nước uống?
- Theo quy định của Bộ Y tế, nồng độ NO3 tối đa cho phép trong nước uống là 50 mg/l.
-
NO3 ảnh hưởng đến môi trường như thế nào?
- NO3 có thể gây ô nhiễm nguồn nước, ô nhiễm không khí và góp phần vào hiệu ứng nhà kính.
-
Có thể loại bỏ NO3 khỏi nước bằng cách nào?
- Có nhiều phương pháp để loại bỏ NO3 khỏi nước, bao gồm sử dụng hệ thống lọc, trao đổi ion, thẩm thấu ngược và các biện pháp sinh học.
-
Phân bón chứa NO3 có gây hại cho đất không?
- Nếu sử dụng quá nhiều, phân bón chứa NO3 có thể gây ô nhiễm đất và ảnh hưởng đến hệ sinh thái đất.
-
Vai trò của NO3 trong nông nghiệp là gì?
- NO3 là thành phần chính của phân đạm, cung cấp nitơ cần thiết cho sự phát triển của cây trồng.
-
Làm thế nào để kiểm tra nồng độ NO3 trong nước?
- Bạn có thể sử dụng bộ kiểm tra nhanh tại nhà hoặc gửi mẫu nước đến các trung tâm kiểm nghiệm để được phân tích chính xác.
-
NO3 có ảnh hưởng đến chất lượng không khí không?
- Có, NO3 có thể chuyển hóa thành các khí gây ô nhiễm không khí và góp phần vào hiệu ứng nhà kính.
10. Xe Tải Mỹ Đình – Địa Chỉ Tin Cậy Cho Mọi Thông Tin Về Xe Tải
Bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về các loại xe tải? Bạn muốn được tư vấn lựa chọn xe phù hợp với nhu cầu và ngân sách của mình? Hãy đến với Xe Tải Mỹ Đình!
Tại XETAIMYDINH.EDU.VN, chúng tôi cung cấp:
- Thông tin chi tiết và cập nhật về các loại xe tải có sẵn ở Mỹ Đình, Hà Nội.
- So sánh giá cả và thông số kỹ thuật giữa các dòng xe.
- Tư vấn lựa chọn xe phù hợp với nhu cầu và ngân sách của bạn.
- Giải đáp các thắc mắc liên quan đến thủ tục mua bán, đăng ký và bảo dưỡng xe tải.
- Thông tin về các dịch vụ sửa chữa xe tải uy tín trong khu vực.
Xe Tải Mỹ Đình cam kết mang đến cho bạn những thông tin chính xác, khách quan và hữu ích nhất, giúp bạn đưa ra quyết định sáng suốt khi lựa chọn xe tải.
Liên hệ ngay với chúng tôi để được tư vấn miễn phí:
- Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội
- Hotline: 0247 309 9988
- Trang web: XETAIMYDINH.EDU.VN
Xe Tải Mỹ Đình – Người bạn đồng hành tin cậy trên mọi nẻo đường!
Hy vọng rằng, với những thông tin chi tiết và đầy đủ trên, bạn đã có câu trả lời cho câu hỏi NO3 hóa trị mấy cũng như hiểu rõ hơn về các khía cạnh liên quan đến chất hóa học này. Nếu bạn còn bất kỳ thắc mắc nào, đừng ngần ngại liên hệ với Xe Tải Mỹ Đình để được giải đáp tận tình! Chúng tôi luôn sẵn lòng hỗ trợ bạn.