Nhóm Chất Nào Sau đây Có Liên Kết Cho Nhận là câu hỏi thường gặp trong hóa học. Câu trả lời chính xác là D. NH4NO3, vì NH4NO3 và HNO3 đều chứa liên kết cho nhận. Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN) sẽ giúp bạn hiểu rõ hơn về loại liên kết đặc biệt này và các ứng dụng của nó.
1. Liên Kết Cho Nhận Là Gì?
Liên kết cho nhận, còn được gọi là liên kết phối trí, là một loại liên kết cộng hóa trị đặc biệt, trong đó một nguyên tử (gọi là nguyên tử cho) cung cấp cả hai electron để tạo thành liên kết, trong khi nguyên tử kia (gọi là nguyên tử nhận) chỉ nhận cặp electron đó.
1.1. Định Nghĩa Chi Tiết
Liên kết cho nhận xảy ra khi một nguyên tử có cặp electron tự do (ví dụ: N, O, S, P) liên kết với một nguyên tử khác đang thiếu electron (ví dụ: H+, BF3, AlCl3). Nguyên tử cho sẽ “cho” cặp electron của mình để tạo thành liên kết với nguyên tử nhận.
1.2. Điều Kiện Hình Thành Liên Kết Cho Nhận
- Nguyên tử cho: Cần có cặp electron tự do.
- Nguyên tử nhận: Cần có orbital trống để nhận cặp electron.
- Độ âm điện: Độ âm điện của nguyên tử cho thường nhỏ hơn hoặc bằng nguyên tử nhận.
1.3. So Sánh Liên Kết Cho Nhận Với Liên Kết Cộng Hóa Trị Thông Thường
| Đặc Điểm | Liên Kết Cho Nhận | Liên Kết Cộng Hóa Trị Thông Thường |
|---|---|---|
| Nguồn gốc electron | Một nguyên tử cung cấp cả hai electron. | Mỗi nguyên tử đóng góp một electron. |
| Bản chất liên kết | Vẫn là liên kết cộng hóa trị, nhưng có sự khác biệt về nguồn gốc electron. | Hình thành do sự dùng chung electron giữa hai nguyên tử. |
| Ví dụ | NH4+, BF3NH3. | H2, O2, CH4. |
1.4. Tại Sao Liên Kết Cho Nhận Quan Trọng?
Liên kết cho nhận đóng vai trò quan trọng trong nhiều lĩnh vực:
- Hóa học: Giải thích cấu trúc và tính chất của nhiều hợp chất phức tạp.
- Sinh học: Tham gia vào cấu trúc và chức năng của enzyme, protein, DNA.
- Vật liệu: Ứng dụng trong việc tạo ra các vật liệu mới với tính chất đặc biệt.
2. Phân Tích Chi Tiết NH4NO3 và HNO3
Để hiểu rõ hơn về liên kết cho nhận, chúng ta hãy phân tích cấu trúc của NH4NO3 và HNO3.
2.1. NH4NO3 (Ammonium Nitrate)
NH4NO3 là một hợp chất ion bao gồm ion ammonium (NH4+) và ion nitrate (NO3-).
2.1.1. Cấu Trúc Ion Ammonium (NH4+)
Ion ammonium được hình thành khi ammonia (NH3) nhận một proton (H+). Nguyên tử nitrogen trong ammonia có một cặp electron tự do, cặp electron này được “cho” để liên kết với proton, tạo thành liên kết cho nhận.
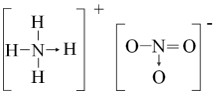 Cấu trúc ion ammonium (NH4+) với liên kết cho nhận giữa N và H+
Cấu trúc ion ammonium (NH4+) với liên kết cho nhận giữa N và H+
2.1.2. Cấu Trúc Ion Nitrate (NO3-)
Ion nitrate có cấu trúc phức tạp hơn, với một nguyên tử nitrogen liên kết với ba nguyên tử oxygen. Một trong số các liên kết N-O là liên kết đôi, và một liên kết khác là liên kết đơn mang điện tích âm.
2.2. HNO3 (Nitric Acid)
HNO3 là một acid mạnh có cấu trúc phân tử gồm một nguyên tử nitrogen liên kết với ba nguyên tử oxygen, và một nguyên tử hydrogen liên kết với một trong các nguyên tử oxygen.
2.2.1. Liên Kết Cho Nhận Trong HNO3
Trong phân tử HNO3, có một liên kết cho nhận giữa nguyên tử nitrogen và một trong các nguyên tử oxygen. Nguyên tử nitrogen “cho” cặp electron của mình để tạo thành liên kết với oxygen.
3. Các Nhóm Chất Khác Và Liên Kết Cho Nhận
Ngoài NH4NO3 và HNO3, liên kết cho nhận còn xuất hiện trong nhiều hợp chất khác.
3.1. Hợp Chất Phức (Complex Compounds)
Hợp chất phức là các hợp chất được tạo thành từ một ion kim loại trung tâm liên kết với các phối tử (ligand). Phối tử là các phân tử hoặc ion có khả năng “cho” cặp electron của mình để liên kết với ion kim loại trung tâm thông qua liên kết cho nhận.
3.1.1. Ví Dụ Về Hợp Chất Phức
- [Cu(NH3)4]2+: Ion đồng (Cu2+) liên kết với bốn phân tử ammonia (NH3).
- [Fe(CN)6]4-: Ion sắt (Fe2+) liên kết với sáu ion cyanide (CN-).
3.2. Acid Lewis Và Base Lewis
Theo định nghĩa của Lewis, acid là chất nhận cặp electron, và base là chất cho cặp electron. Phản ứng giữa acid Lewis và base Lewis tạo thành liên kết cho nhận.
3.2.1. Ví Dụ Về Acid Lewis Và Base Lewis
- BF3 (Acid Lewis) và NH3 (Base Lewis): BF3 nhận cặp electron từ NH3 để tạo thành hợp chất BF3NH3.
- AlCl3 (Acid Lewis) và H2O (Base Lewis): AlCl3 nhận cặp electron từ H2O để tạo thành hợp chất AlCl3(H2O)x.
3.3. Các Hợp Chất Khác Chứa Liên Kết Cho Nhận
- Ozone (O3): Một trong các liên kết O-O trong ozone có thể được mô tả như liên kết cho nhận.
- Carbon Monoxide (CO): Liên kết giữa carbon và oxygen trong CO có tính chất của liên kết cho nhận.
4. Ứng Dụng Của Các Hợp Chất Chứa Liên Kết Cho Nhận
Các hợp chất chứa liên kết cho nhận có nhiều ứng dụng quan trọng trong các lĩnh vực khác nhau.
4.1. Trong Nông Nghiệp
- NH4NO3 (Ammonium Nitrate): Được sử dụng làm phân bón cung cấp nitrogen cho cây trồng. Nitrogen là một nguyên tố dinh dưỡng thiết yếu cho sự phát triển của cây.
4.2. Trong Công Nghiệp
- Hợp chất phức: Được sử dụng làm chất xúc tác trong nhiều quá trình hóa học công nghiệp. Ví dụ, các phức của kim loại chuyển tiếp được sử dụng trong quá trình sản xuất polymer, dược phẩm, và các hóa chất khác.
- Acid Lewis và Base Lewis: Được sử dụng trong các phản ứng hữu cơ, ví dụ như phản ứng Friedel-Crafts alkyl hóa và acyl hóa.
4.3. Trong Y Học
- Hợp chất phức: Một số hợp chất phức được sử dụng làm thuốc điều trị bệnh. Ví dụ, cisplatin ([Pt(NH3)2Cl2]) là một loại thuốc hóa trị liệu được sử dụng để điều trị ung thư.
4.4. Trong Nghiên Cứu Khoa Học
- Các hợp chất chứa liên kết cho nhận: Được sử dụng để nghiên cứu cấu trúc và tính chất của các phân tử và vật liệu. Các nhà khoa học sử dụng các phương pháp như phổ nghiệm và tinh thể học để xác định cấu trúc của các hợp chất này.
5. Ảnh Hưởng Của Liên Kết Cho Nhận Đến Tính Chất Của Hợp Chất
Liên kết cho nhận có ảnh hưởng đáng kể đến tính chất vật lý và hóa học của hợp chất.
5.1. Độ Bền Của Liên Kết
Liên kết cho nhận thường bền hơn so với liên kết cộng hóa trị thông thường do sự phân cực mạnh của liên kết.
5.2. Tính Tan Trong Nước
Các hợp chất chứa liên kết cho nhận thường có độ tan cao trong nước do khả năng tạo liên kết hydrogen với các phân tử nước.
5.3. Tính Acid-Base
Sự có mặt của liên kết cho nhận có thể làm thay đổi tính acid hoặc base của một hợp chất. Ví dụ, sự hình thành ion ammonium (NH4+) làm cho dung dịch có tính acid.
5.4. Tính Chất Quang Học
Một số hợp chất phức có tính chất quang học đặc biệt, ví dụ như khả năng hấp thụ và phát xạ ánh sáng ở các bước sóng khác nhau. Điều này được ứng dụng trong các thiết bị quang học và điện tử.
6. Các Yếu Tố Ảnh Hưởng Đến Khả Năng Hình Thành Liên Kết Cho Nhận
Khả năng hình thành liên kết cho nhận phụ thuộc vào nhiều yếu tố, bao gồm:
6.1. Độ Âm Điện
Sự khác biệt về độ âm điện giữa nguyên tử cho và nguyên tử nhận ảnh hưởng đến khả năng hình thành liên kết cho nhận. Nếu độ âm điện của nguyên tử nhận lớn hơn nhiều so với nguyên tử cho, liên kết sẽ phân cực mạnh và dễ hình thành.
6.2. Kích Thước Của Nguyên Tử
Kích thước của nguyên tử cũng ảnh hưởng đến khả năng hình thành liên kết cho nhận. Các nguyên tử nhỏ thường tạo liên kết bền hơn do khoảng cách giữa các hạt nhân nhỏ hơn.
6.3. Cấu Hình Electron
Cấu hình electron của nguyên tử quyết định khả năng cho hoặc nhận electron. Các nguyên tử có cấu hình electron bền vững thường ít có khả năng tham gia vào liên kết cho nhận.
6.4. Hiệu Ứng Không Gian
Hiệu ứng không gian, hay còn gọi là hiệu ứng steric, có thể ảnh hưởng đến khả năng hình thành liên kết cho nhận. Các nhóm thế cồng kềnh có thể gây cản trở không gian và làm giảm khả năng hình thành liên kết.
7. Các Phương Pháp Xác Định Liên Kết Cho Nhận
Có nhiều phương pháp để xác định sự có mặt của liên kết cho nhận trong một hợp chất.
7.1. Phổ Nghiệm (Spectroscopy)
- Phổ hồng ngoại (IR): Phổ IR có thể được sử dụng để xác định sự có mặt của các nhóm chức đặc trưng trong hợp chất, từ đó suy ra sự có mặt của liên kết cho nhận.
- Phổ cộng hưởng từ hạt nhân (NMR): Phổ NMR cung cấp thông tin chi tiết về cấu trúc phân tử và môi trường xung quanh các nguyên tử, giúp xác định sự có mặt của liên kết cho nhận.
7.2. Tinh Thể Học Tia X (X-ray Crystallography)
Tinh thể học tia X là một phương pháp mạnh mẽ để xác định cấu trúc ba chiều của phân tử. Phương pháp này có thể được sử dụng để xác định chính xác vị trí của các nguyên tử và liên kết trong phân tử, bao gồm cả liên kết cho nhận.
7.3. Tính Toán Lượng Tử (Quantum Chemical Calculations)
Các phương pháp tính toán lượng tử, chẳng hạn như lý thuyết hàm mật độ (DFT), có thể được sử dụng để mô phỏng cấu trúc và tính chất của phân tử. Các tính toán này có thể cung cấp thông tin về năng lượng liên kết, độ dài liên kết, và phân bố điện tích, giúp xác định sự có mặt của liên kết cho nhận.
8. FAQ – Câu Hỏi Thường Gặp Về Liên Kết Cho Nhận
8.1. Liên kết cho nhận có phải là liên kết ion không?
Không, liên kết cho nhận là một loại liên kết cộng hóa trị đặc biệt, không phải liên kết ion.
8.2. Làm thế nào để nhận biết một hợp chất có liên kết cho nhận?
Sử dụng các phương pháp như phổ nghiệm (IR, NMR), tinh thể học tia X, và tính toán lượng tử.
8.3. Liên kết cho nhận có mạnh hơn liên kết cộng hóa trị thông thường không?
Thường thì có, do sự phân cực mạnh của liên kết.
8.4. Tại sao NH4NO3 lại có liên kết cho nhận?
Do ion ammonium (NH4+) được hình thành từ liên kết cho nhận giữa NH3 và H+.
8.5. Ứng dụng của các hợp chất chứa liên kết cho nhận là gì?
Trong nông nghiệp (phân bón), công nghiệp (chất xúc tác), y học (thuốc điều trị), và nghiên cứu khoa học.
8.6. Các yếu tố nào ảnh hưởng đến khả năng hình thành liên kết cho nhận?
Độ âm điện, kích thước nguyên tử, cấu hình electron, và hiệu ứng không gian.
8.7. Acid Lewis và Base Lewis là gì?
Acid Lewis là chất nhận cặp electron, base Lewis là chất cho cặp electron.
8.8. Tại sao liên kết cho nhận quan trọng trong sinh học?
Tham gia vào cấu trúc và chức năng của enzyme, protein, DNA.
8.9. Phổ nghiệm có thể giúp xác định liên kết cho nhận như thế nào?
Phổ IR và NMR cung cấp thông tin về các nhóm chức và cấu trúc phân tử, giúp suy ra sự có mặt của liên kết cho nhận.
8.10. Tính toán lượng tử có thể giúp xác định liên kết cho nhận như thế nào?
Mô phỏng cấu trúc và tính chất của phân tử, cung cấp thông tin về năng lượng liên kết và phân bố điện tích.
9. Tổng Kết
Liên kết cho nhận là một loại liên kết hóa học quan trọng, đóng vai trò trong nhiều lĩnh vực khác nhau. Việc hiểu rõ về liên kết cho nhận giúp chúng ta giải thích được cấu trúc và tính chất của nhiều hợp chất, từ đó ứng dụng chúng một cách hiệu quả.
Bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về các loại xe tải, giá cả, địa điểm mua bán uy tín và dịch vụ sửa chữa chất lượng tại Mỹ Đình? Bạn lo ngại về chi phí vận hành, bảo trì và các vấn đề pháp lý liên quan đến xe tải? Đừng lo lắng, XETAIMYDINH.EDU.VN sẽ giúp bạn giải quyết mọi vấn đề.
Hãy truy cập ngay XETAIMYDINH.EDU.VN hoặc liên hệ qua hotline 0247 309 9988 để được tư vấn và giải đáp mọi thắc mắc về xe tải ở Mỹ Đình. Địa chỉ của chúng tôi là Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội. Xe Tải Mỹ Đình luôn sẵn sàng phục vụ bạn!