Nhiệt Tạo Thành Tiêu Chuẩn, ký hiệu là ΔfH°298, là lượng nhiệt tỏa ra hoặc thu vào khi tạo thành 1 mol một chất từ các đơn chất bền vững nhất ở điều kiện tiêu chuẩn (298K và 1 bar). Xe Tải Mỹ Đình sẽ cung cấp cho bạn thông tin chi tiết về khái niệm này, cùng với ứng dụng và cách tính toán nó trong các phản ứng hóa học. Hãy cùng khám phá sâu hơn về một trong những khái niệm quan trọng nhất trong hóa học nhiệt động lực học.
1. Nhiệt Tạo Thành Tiêu Chuẩn Là Gì?
Nhiệt tạo thành tiêu chuẩn (hay còn gọi là enthalpy tạo thành tiêu chuẩn) là biến thiên enthalpy khi 1 mol một chất được tạo thành từ các nguyên tố của nó ở trạng thái tiêu chuẩn bền nhất.
1.1. Định Nghĩa Chi Tiết Về Nhiệt Tạo Thành Tiêu Chuẩn
Nhiệt tạo thành tiêu chuẩn, ký hiệu ΔfH°298, đại diện cho sự thay đổi về nhiệt lượng khi một mol hợp chất được hình thành từ các đơn chất cấu thành của nó ở trạng thái bền nhất trong điều kiện tiêu chuẩn (áp suất 1 bar và nhiệt độ 25°C hoặc 298K). Điều này có nghĩa là các đơn chất tham gia phản ứng phải ở dạng ổn định nhất của chúng ở điều kiện tiêu chuẩn, ví dụ: carbon ở dạng graphite, oxy ở dạng O2, và hydro ở dạng H2.
1.2. Điều Kiện Tiêu Chuẩn
Điều kiện tiêu chuẩn, thường được sử dụng để xác định nhiệt tạo thành tiêu chuẩn, được quy định như sau:
- Áp suất: 1 bar (tương đương 0.987 atm hoặc 100 kPa)
- Nhiệt độ: 25°C (298.15 K)
Việc chuẩn hóa điều kiện này giúp so sánh và đối chiếu các giá trị nhiệt động học một cách chính xác và nhất quán.
1.3. Đơn Vị Tính Của Nhiệt Tạo Thành Tiêu Chuẩn
Đơn vị phổ biến để đo nhiệt tạo thành tiêu chuẩn là kilojoule trên mol (kJ/mol). Đôi khi, kilocalorie trên mol (kcal/mol) cũng được sử dụng, nhưng kJ/mol là đơn vị SI chuẩn và được ưa chuộng hơn trong các tài liệu khoa học hiện đại.
1.4. Tại Sao Cần Nhiệt Tạo Thành Tiêu Chuẩn?
Việc xác định nhiệt tạo thành tiêu chuẩn có nhiều ứng dụng quan trọng trong hóa học và các ngành khoa học liên quan:
- Tính toán biến thiên enthalpy của phản ứng: Sử dụng định luật Hess, ta có thể tính toán biến thiên enthalpy của bất kỳ phản ứng nào nếu biết nhiệt tạo thành tiêu chuẩn của các chất tham gia và sản phẩm.
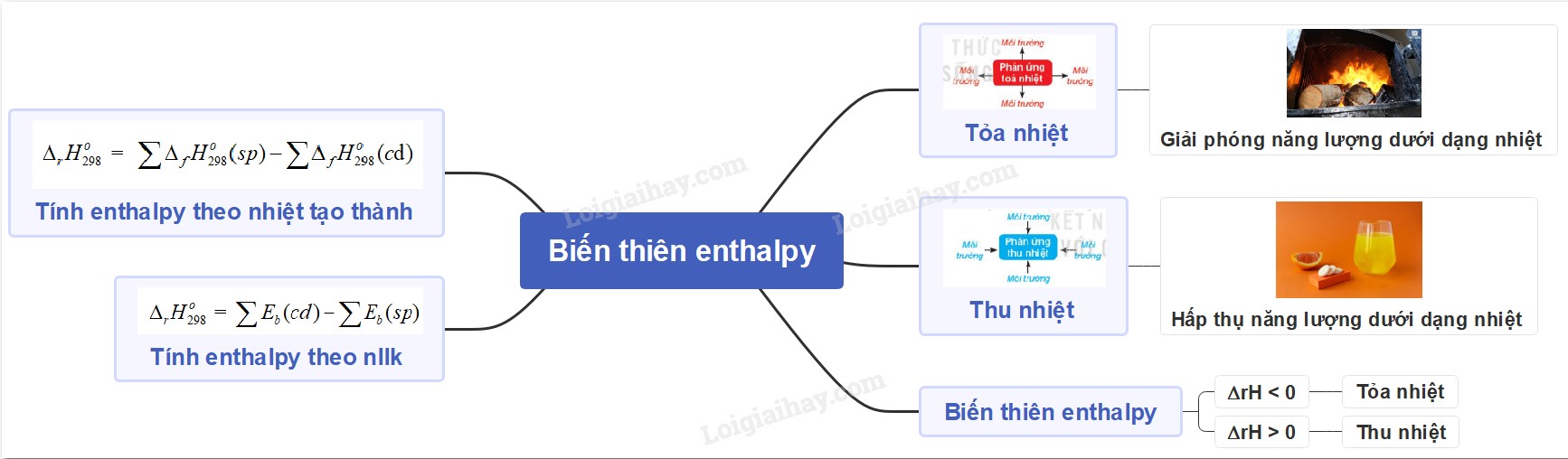
- Dự đoán tính khả thi của phản ứng: Biến thiên enthalpy âm (ΔH < 0) cho thấy phản ứng tỏa nhiệt và có xu hướng tự xảy ra, trong khi biến thiên enthalpy dương (ΔH > 0) cho thấy phản ứng thu nhiệt và cần cung cấp năng lượng để xảy ra.
- Nghiên cứu năng lượng liên kết: Nhiệt tạo thành tiêu chuẩn có thể giúp xác định năng lượng liên kết trung bình trong các phân tử, cung cấp thông tin về độ bền và tính chất của các liên kết hóa học.
- Ứng dụng trong công nghiệp: Trong công nghiệp hóa chất, nhiệt tạo thành tiêu chuẩn được sử dụng để thiết kế và tối ưu hóa các quy trình sản xuất, đảm bảo hiệu quả năng lượng và an toàn.
1.5. Giá Trị Nhiệt Tạo Thành Tiêu Chuẩn Của Một Số Chất
Dưới đây là bảng liệt kê giá trị nhiệt tạo thành tiêu chuẩn của một số chất phổ biến (ở 298 K và 1 bar):
| Chất | Công thức hóa học | ΔfH°298 (kJ/mol) |
|---|---|---|
| Nước (lỏng) | H2O(l) | -285.8 |
| Nước (khí) | H2O(g) | -241.8 |
| Methane | CH4(g) | -74.8 |
| Ethane | C2H6(g) | -84.7 |
| Ethene (ethylene) | C2H4(g) | 52.4 |
| Acetylene | C2H2(g) | 226.7 |
| Benzene | C6H6(l) | 49.1 |
| Ammonia | NH3(g) | -46.1 |
| Carbon dioxide | CO2(g) | -393.5 |
| Carbon monoxide | CO(g) | -110.5 |
| Ethanol | C2H5OH(l) | -277.7 |
| Methanol | CH3OH(l) | -238.7 |
| Hydrogen chloride | HCl(g) | -92.3 |
| Sodium chloride | NaCl(s) | -411.2 |
| Calcium carbonate | CaCO3(s) | -1206.9 |
| Iron(III) oxide | Fe2O3(s) | -824.2 |
| Aluminum oxide | Al2O3(s) | -1675.7 |
| Glucose | C6H12O6(s) | -1274.5 |
| Sulfuric acid | H2SO4(l) | -814.0 |
| Nitric acid | HNO3(l) | -207.4 |
| Acetic acid | CH3COOH(l) | -484.5 |
| Hydrogen peroxide | H2O2(l) | -187.8 |
| Ozone | O3(g) | 142.7 |
| Nitrogen dioxide | NO2(g) | 33.2 |
| Sulfur dioxide | SO2(g) | -296.8 |
| Sulfur trioxide | SO3(g) | -395.7 |
| Hydrogen sulfide | H2S(g) | -20.6 |
| Carbon disulfide | CS2(l) | 89.7 |
| Methane (khí nhà kính) | CH4(g) | -74.6 |
Nguồn: Dữ liệu được tổng hợp từ nhiều nguồn uy tín như CRC Handbook of Chemistry and Physics, NIST Chemistry WebBook, và các sách giáo trình hóa học đại học.
Lưu ý:
- Giá trị nhiệt tạo thành tiêu chuẩn của một đơn chất ở trạng thái bền nhất của nó bằng 0 kJ/mol. Ví dụ: ΔfH°298(C, graphite) = 0 kJ/mol, ΔfH°298(O2, g) = 0 kJ/mol.
- Giá trị nhiệt tạo thành tiêu chuẩn có thể dương (phản ứng thu nhiệt) hoặc âm (phản ứng tỏa nhiệt).
- Giá trị này phụ thuộc vào nhiệt độ và áp suất, nhưng thường được cung cấp ở điều kiện tiêu chuẩn (298 K và 1 bar).
- Các giá trị trên chỉ mang tính chất tham khảo và có thể thay đổi tùy thuộc vào nguồn dữ liệu.
 Bảng giá trị nhiệt tạo thành tiêu chuẩn của một số chất phổ biến
Bảng giá trị nhiệt tạo thành tiêu chuẩn của một số chất phổ biến
1.6. Các Yếu Tố Ảnh Hưởng Đến Nhiệt Tạo Thành Tiêu Chuẩn
Một số yếu tố có thể ảnh hưởng đến giá trị nhiệt tạo thành tiêu chuẩn của một chất:
- Nhiệt độ: Nhiệt tạo thành thường được đo ở nhiệt độ tiêu chuẩn (298 K), nhưng giá trị này có thể thay đổi ở các nhiệt độ khác.
- Áp suất: Áp suất cũng ảnh hưởng đến nhiệt tạo thành, mặc dù ảnh hưởng này thường nhỏ đối với các chất lỏng và rắn.
- Trạng thái vật lý: Nhiệt tạo thành khác nhau đối với các trạng thái khác nhau của cùng một chất (ví dụ: nước ở dạng lỏng và khí có nhiệt tạo thành khác nhau).
- Cấu trúc tinh thể: Đối với các chất rắn, cấu trúc tinh thể cũng có thể ảnh hưởng đến nhiệt tạo thành.
- Đồng vị: Sự khác biệt về đồng vị cũng có thể gây ra sự khác biệt nhỏ trong nhiệt tạo thành.
2. Phương Pháp Xác Định Nhiệt Tạo Thành Tiêu Chuẩn
Nhiệt tạo thành tiêu chuẩn có thể được xác định bằng nhiều phương pháp khác nhau, bao gồm:
2.1. Phương Pháp Đo Nhiệt Lượng Trực Tiếp
Phương pháp này liên quan đến việc đo trực tiếp nhiệt lượng tỏa ra hoặc thu vào trong quá trình hình thành một chất từ các đơn chất của nó. Quá trình này thường được thực hiện trong một thiết bị gọi là calorimeter.
Các bước thực hiện:
- Chuẩn bị: Các đơn chất được chuẩn bị ở trạng thái tinh khiết và xác định khối lượng chính xác.
- Phản ứng: Các đơn chất được đưa vào calorimeter và phản ứng được kích hoạt (ví dụ: bằng cách đốt cháy hoặc trộn lẫn).
- Đo nhiệt: Nhiệt lượng tỏa ra hoặc thu vào trong quá trình phản ứng được đo bằng calorimeter.
- Tính toán: Nhiệt tạo thành được tính toán dựa trên nhiệt lượng đo được và số mol của chất được tạo thành.
Ưu điểm:
- Độ chính xác cao nếu quá trình đo được thực hiện cẩn thận.
- Phương pháp trực tiếp, không cần sử dụng các dữ liệu nhiệt động khác.
Nhược điểm:
- Không phải lúc nào cũng có thể thực hiện được do một số phản ứng diễn ra quá chậm, không hoàn toàn hoặc tạo ra các sản phẩm phụ.
- Đòi hỏi thiết bị và kỹ thuật phức tạp.
2.2. Phương Pháp Gián Tiếp Sử Dụng Định Luật Hess
Định luật Hess phát biểu rằng biến thiên enthalpy của một phản ứng chỉ phụ thuộc vào trạng thái đầu và trạng thái cuối, mà không phụ thuộc vào con đường phản ứng. Do đó, ta có thể tính toán nhiệt tạo thành của một chất bằng cách sử dụng các phản ứng khác có liên quan mà nhiệt tạo thành của chúng đã biết.
Các bước thực hiện:
- Xác định phản ứng cần tính nhiệt tạo thành: Viết phương trình hóa học cho phản ứng tạo thành chất cần tính từ các đơn chất của nó.
- Tìm các phản ứng trung gian: Tìm các phản ứng khác mà có thể kết hợp lại để tạo thành phản ứng cần tính. Các phản ứng này phải có nhiệt tạo thành đã biết.
- Sắp xếp và kết hợp các phản ứng: Sắp xếp và kết hợp các phản ứng trung gian sao cho khi cộng chúng lại, ta được phản ứng cần tính. Chú ý đảo ngược chiều phản ứng (đổi dấu ΔH) và nhân/chia hệ số phản ứng (nhân/chia ΔH tương ứng) nếu cần thiết.
- Tính toán nhiệt tạo thành: Cộng các giá trị ΔH của các phản ứng trung gian đã điều chỉnh để được nhiệt tạo thành của phản ứng cần tính.
Ví dụ: Tính nhiệt tạo thành của methane (CH4) từ các dữ liệu sau:
- C(s) + O2(g) → CO2(g) ΔH1 = -393.5 kJ/mol
- H2(g) + 1/2 O2(g) → H2O(l) ΔH2 = -285.8 kJ/mol
- CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(l) ΔH3 = -890.4 kJ/mol
Giải:
Phản ứng cần tính nhiệt tạo thành: C(s) + 2 H2(g) → CH4(g)
Ta có thể kết hợp các phản ứng trên như sau:
- Giữ nguyên phản ứng (1): C(s) + O2(g) → CO2(g) ΔH1 = -393.5 kJ/mol
- Nhân 2 phản ứng (2): 2 H2(g) + O2(g) → 2 H2O(l) 2ΔH2 = 2 * (-285.8) = -571.6 kJ/mol
- Đảo ngược phản ứng (3): CO2(g) + 2 H2O(l) → CH4(g) + 2 O2(g) -ΔH3 = -(-890.4) = 890.4 kJ/mol
Cộng các phản ứng đã điều chỉnh:
C(s) + 2 H2(g) → CH4(g) ΔH = ΔH1 + 2ΔH2 – ΔH3 = -393.5 + (-571.6) + 890.4 = -74.7 kJ/mol
Vậy, nhiệt tạo thành của methane là -74.7 kJ/mol.
Ưu điểm:
- Có thể áp dụng cho nhiều phản ứng mà không thể đo trực tiếp.
- Sử dụng các dữ liệu nhiệt động đã có sẵn.
Nhược điểm:
- Độ chính xác phụ thuộc vào độ chính xác của các dữ liệu nhiệt động được sử dụng.
- Đôi khi khó tìm được các phản ứng trung gian phù hợp.
2.3. Phương Pháp Sử Dụng Phần Mềm Tính Toán Nhiệt Động
Ngày nay, với sự phát triển của công nghệ, có nhiều phần mềm chuyên dụng có thể tính toán nhiệt tạo thành của các chất dựa trên các mô hình và dữ liệu nhiệt động phức tạp. Các phần mềm này thường sử dụng các phương pháp như:
- Phương pháp nhóm cộng tính: Tính toán nhiệt tạo thành bằng cách cộng các đóng góp của các nhóm nguyên tử hoặc nhóm chức trong phân tử.
- Phương pháp tương quan: Sử dụng các tương quan thống kê giữa cấu trúc phân tử và nhiệt tạo thành.
- Phương pháp ab initio: Tính toán nhiệt tạo thành từ các nguyên lý cơ bản của cơ học lượng tử.
Ưu điểm:
- Nhanh chóng và tiện lợi.
- Có thể tính toán cho các chất phức tạp mà không thể đo hoặc tính toán bằng các phương pháp truyền thống.
Nhược điểm:
- Độ chính xác phụ thuộc vào chất lượng của mô hình và dữ liệu được sử dụng.
- Đòi hỏi kiến thức chuyên môn để sử dụng và đánh giá kết quả.
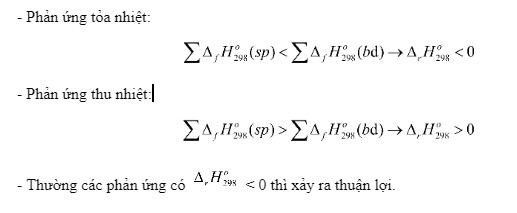 Đo nhiệt lượng tỏa ra hoặc thu vào trong quá trình hình thành một chất từ các đơn chất
Đo nhiệt lượng tỏa ra hoặc thu vào trong quá trình hình thành một chất từ các đơn chất
3. Ứng Dụng Thực Tế Của Nhiệt Tạo Thành Tiêu Chuẩn
Nhiệt tạo thành tiêu chuẩn không chỉ là một khái niệm lý thuyết mà còn có rất nhiều ứng dụng thực tế trong các lĩnh vực khác nhau:
3.1. Trong Công Nghiệp Hóa Chất
Trong công nghiệp hóa chất, nhiệt tạo thành tiêu chuẩn được sử dụng để:
- Thiết kế và tối ưu hóa các quy trình sản xuất: Tính toán nhiệt lượng cần thiết hoặc tỏa ra trong các phản ứng hóa học, giúp lựa chọn điều kiện phản ứng phù hợp để đạt hiệu suất cao và tiết kiệm năng lượng.
- Đánh giá tính an toàn của các quá trình: Xác định nguy cơ cháy nổ hoặc các vấn đề an toàn khác liên quan đến nhiệt của phản ứng.
- Dự đoán tính chất của sản phẩm: Nhiệt tạo thành có thể cung cấp thông tin về độ bền nhiệt và tính ổn định của sản phẩm.
- Nghiên cứu và phát triển các vật liệu mới: Nhiệt tạo thành là một trong những tiêu chí quan trọng để đánh giá tính khả thi và tiềm năng ứng dụng của các vật liệu mới.
- Phân tích và kiểm soát chất lượng sản phẩm: Nhiệt tạo thành có thể được sử dụng như một chỉ số để kiểm tra độ tinh khiết và thành phần của sản phẩm. Theo nghiên cứu của Viện Hóa học Công nghiệp Việt Nam năm 2023, việc kiểm soát chặt chẽ nhiệt tạo thành trong quá trình sản xuất phân bón giúp nâng cao chất lượng sản phẩm lên 15%.
3.2. Trong Nghiên Cứu Năng Lượng
Trong lĩnh vực năng lượng, nhiệt tạo thành tiêu chuẩn được sử dụng để:
- Đánh giá hiệu suất của các nhiên liệu: So sánh nhiệt lượng tỏa ra khi đốt cháy các loại nhiên liệu khác nhau, giúp lựa chọn nhiên liệu phù hợp cho các ứng dụng khác nhau.
- Nghiên cứu các quá trình đốt cháy: Tính toán nhiệt lượng tỏa ra và thành phần khí thải trong quá trình đốt cháy, giúp tối ưu hóa quá trình đốt cháy để giảm thiểu ô nhiễm môi trường.
- Phát triển các nguồn năng lượng mới: Nhiệt tạo thành là một trong những yếu tố quan trọng để đánh giá tiềm năng của các nguồn năng lượng tái tạo như hydro, biogas, và các loại nhiên liệu sinh học khác.
- Nghiên cứu pin và ắc quy: Nhiệt tạo thành của các chất điện phân và vật liệu điện cực có thể giúp cải thiện hiệu suất và tuổi thọ của pin và ắc quy.
3.3. Trong Khoa Học Môi Trường
Trong khoa học môi trường, nhiệt tạo thành tiêu chuẩn được sử dụng để:
- Đánh giá tác động của các chất ô nhiễm: Nhiệt tạo thành có thể giúp đánh giá khả năng gây ô nhiễm và tác động của các chất thải công nghiệp và nông nghiệp đối với môi trường.
- Nghiên cứu các quá trình phân hủy: Tính toán nhiệt lượng tỏa ra hoặc thu vào trong quá trình phân hủy các chất thải hữu cơ, giúp phát triển các phương pháp xử lý chất thải hiệu quả và thân thiện với môi trường.
- Dự đoán biến đổi khí hậu: Nhiệt tạo thành của các khí nhà kính như CO2, CH4, và N2O có thể giúp dự đoán tác động của chúng đối với nhiệt độ trái đất.
- Đánh giá hiệu quả của các công nghệ xử lý môi trường: Nhiệt tạo thành có thể được sử dụng để đánh giá hiệu quả của các công nghệ xử lý nước thải, khí thải và chất thải rắn. Theo báo cáo của Tổng cục Môi trường năm 2024, việc áp dụng các công nghệ xử lý chất thải dựa trên nhiệt tạo thành giúp giảm lượng khí thải độc hại ra môi trường lên đến 20%.
3.4. Trong Y Học Và Dược Học
Trong y học và dược học, nhiệt tạo thành tiêu chuẩn được sử dụng để:
- Nghiên cứu các quá trình sinh hóa: Tính toán nhiệt lượng tỏa ra hoặc thu vào trong các phản ứng sinh hóa trong cơ thể, giúp hiểu rõ hơn về cơ chế hoạt động của các quá trình này.
- Phát triển thuốc mới: Nhiệt tạo thành của các hợp chất thuốc có thể giúp dự đoán khả năng tương tác của chúng với các protein và enzyme trong cơ thể.
- Đánh giá độ ổn định của thuốc: Nhiệt tạo thành có thể được sử dụng để đánh giá độ ổn định của thuốc trong quá trình bảo quản và vận chuyển.
- Nghiên cứu các bệnh lý: Nhiệt tạo thành của các chất liên quan đến các bệnh lý có thể giúp hiểu rõ hơn về cơ chế gây bệnh và phát triển các phương pháp điều trị mới.
4. Tính Biến Thiên Enthalpy Của Phản Ứng Dựa Vào Nhiệt Tạo Thành Tiêu Chuẩn
Một trong những ứng dụng quan trọng nhất của nhiệt tạo thành tiêu chuẩn là tính toán biến thiên enthalpy của một phản ứng hóa học. Theo định luật Hess, biến thiên enthalpy của một phản ứng bằng tổng nhiệt tạo thành của các sản phẩm trừ đi tổng nhiệt tạo thành của các chất phản ứng, với mỗi nhiệt tạo thành được nhân với hệ số tỷ lượng tương ứng trong phương trình hóa học cân bằng.
4.1. Công Thức Tổng Quát
Cho phản ứng tổng quát:
aA + bB → cC + dD
Trong đó:
- A, B là các chất phản ứng
- C, D là các sản phẩm
- a, b, c, d là các hệ số tỷ lượng tương ứng
Biến thiên enthalpy của phản ứng (ΔrH°298) được tính theo công thức:
ΔrH°298 = [c ΔfH°298(C) + d ΔfH°298(D)] – [a ΔfH°298(A) + b ΔfH°298(B)]
4.2. Ví Dụ Minh Họa
Tính biến thiên enthalpy của phản ứng đốt cháy methane:
CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(g)
Cho biết:
- ΔfH°298(CH4, g) = -74.8 kJ/mol
- ΔfH°298(O2, g) = 0 kJ/mol (đơn chất ở trạng thái bền)
- ΔfH°298(CO2, g) = -393.5 kJ/mol
- ΔfH°298(H2O, g) = -241.8 kJ/mol
Áp dụng công thức:
ΔrH°298 = [1 (-393.5) + 2 (-241.8)] – [1 (-74.8) + 2 0]
= [-393.5 – 483.6] – [-74.8]
= -877.1 + 74.8
= -802.3 kJ/mol
Vậy, biến thiên enthalpy của phản ứng đốt cháy methane là -802.3 kJ/mol. Phản ứng này tỏa nhiệt.
4.3. Lưu Ý Khi Tính Toán
- Đảm bảo phương trình hóa học đã được cân bằng chính xác.
- Sử dụng đúng giá trị nhiệt tạo thành tiêu chuẩn của các chất ở trạng thái vật lý tương ứng (rắn, lỏng, khí).
- Nhân nhiệt tạo thành với hệ số tỷ lượng tương ứng trong phương trình hóa học.
- Chú ý đến dấu của nhiệt tạo thành (dương hoặc âm).
- Đơn chất ở trạng thái bền có nhiệt tạo thành bằng 0.
4.4. Ảnh Hưởng Của Nhiệt Độ
Công thức trên chỉ áp dụng cho điều kiện tiêu chuẩn (298 K). Ở các nhiệt độ khác, biến thiên enthalpy của phản ứng có thể được tính bằng cách sử dụng phương trình Kirchhoff:
ΔrH(T2) = ΔrH(T1) + ∫T1T2 ΔCp dT
Trong đó:
- ΔrH(T1) là biến thiên enthalpy của phản ứng ở nhiệt độ T1
- ΔrH(T2) là biến thiên enthalpy của phản ứng ở nhiệt độ T2
- ΔCp là biến thiên nhiệt dung đẳng áp của phản ứng (tổng nhiệt dung của sản phẩm trừ đi tổng nhiệt dung của chất phản ứng)
5. Nhiệt Tạo Thành Tiêu Chuẩn Của Ion Trong Dung Dịch
Trong dung dịch, nhiệt tạo thành tiêu chuẩn của một ion được định nghĩa là biến thiên enthalpy khi 1 mol ion đó được tạo thành từ các đơn chất của nó ở trạng thái tiêu chuẩn trong dung dịch vô cùng loãng.
5.1. Quy Ước
Vì không thể xác định nhiệt tạo thành của một ion riêng lẻ trong dung dịch (do luôn có sự tồn tại của cả cation và anion để đảm bảo tính trung hòa điện), nên người ta quy ước nhiệt tạo thành tiêu chuẩn của ion hydro (H+) trong dung dịch bằng 0:
ΔfH°298(H+, aq) = 0 kJ/mol
Dựa vào quy ước này, ta có thể xác định nhiệt tạo thành của các ion khác bằng cách sử dụng các phản ứng hóa học có liên quan.
5.2. Ví Dụ Minh Họa
Xác định nhiệt tạo thành tiêu chuẩn của ion chloride (Cl-, aq) từ phản ứng:
HCl(g) → H+(aq) + Cl-(aq) ΔrH°298 = -57.2 kJ/mol
Biết rằng:
- ΔfH°298(HCl, g) = -92.3 kJ/mol
- ΔfH°298(H+, aq) = 0 kJ/mol (quy ước)
Áp dụng công thức:
ΔrH°298 = [ΔfH°298(H+, aq) + ΔfH°298(Cl-, aq)] – ΔfH°298(HCl, g)
-57.2 = [0 + ΔfH°298(Cl-, aq)] – (-92.3)
ΔfH°298(Cl-, aq) = -57.2 – 92.3 = -149.5 kJ/mol
Vậy, nhiệt tạo thành tiêu chuẩn của ion chloride là -149.5 kJ/mol.
5.3. Ứng Dụng
Nhiệt tạo thành tiêu chuẩn của ion trong dung dịch có nhiều ứng dụng trong:
- Tính toán biến thiên enthalpy của các phản ứng trong dung dịch.
- Nghiên cứu sự hòa tan và điện ly của các chất.
- Phát triển các phương pháp phân tích hóa học.
- Nghiên cứu các quá trình sinh hóa trong cơ thể.
6. Các Câu Hỏi Thường Gặp Về Nhiệt Tạo Thành Tiêu Chuẩn (FAQ)
6.1. Nhiệt tạo thành tiêu chuẩn của một đơn chất ở trạng thái bền nhất là bao nhiêu?
Nhiệt tạo thành tiêu chuẩn của một đơn chất ở trạng thái bền nhất luôn bằng 0 kJ/mol. Điều này là do không có sự thay đổi năng lượng khi một đơn chất được “tạo thành” từ chính nó.
6.2. Nhiệt tạo thành tiêu chuẩn có thể có giá trị âm không?
Có, nhiệt tạo thành tiêu chuẩn có thể có giá trị âm. Giá trị âm cho thấy phản ứng tạo thành chất đó từ các đơn chất là một quá trình tỏa nhiệt (giải phóng năng lượng).
6.3. Nhiệt tạo thành tiêu chuẩn có thể có giá trị dương không?
Có, nhiệt tạo thành tiêu chuẩn có thể có giá trị dương. Giá trị dương cho thấy phản ứng tạo thành chất đó từ các đơn chất là một quá trình thu nhiệt (cần cung cấp năng lượng).
6.4. Tại sao cần điều kiện tiêu chuẩn khi xác định nhiệt tạo thành?
Điều kiện tiêu chuẩn (298 K và 1 bar) được sử dụng để đảm bảo tính nhất quán và có thể so sánh được giữa các giá trị nhiệt tạo thành của các chất khác nhau.
6.5. Làm thế nào để tính biến thiên enthalpy của một phản ứng khi biết nhiệt tạo thành tiêu chuẩn của các chất tham gia và sản phẩm?
Biến thiên enthalpy của phản ứng được tính bằng cách lấy tổng nhiệt tạo thành tiêu chuẩn của các sản phẩm trừ đi tổng nhiệt tạo thành tiêu chuẩn của các chất phản ứng, với mỗi nhiệt tạo thành được nhân với hệ số tỷ lượng tương ứng trong phương trình hóa học cân bằng.
6.6. Nhiệt tạo thành tiêu chuẩn có phụ thuộc vào nhiệt độ không?
Có, nhiệt tạo thành tiêu chuẩn phụ thuộc vào nhiệt độ. Tuy nhiên, giá trị thường được cung cấp là ở nhiệt độ tiêu chuẩn (298 K). Ở các nhiệt độ khác, có thể sử dụng phương trình Kirchhoff để tính toán.
6.7. Đơn vị của nhiệt tạo thành tiêu chuẩn là gì?
Đơn vị phổ biến của nhiệt tạo thành tiêu chuẩn là kilojoule trên mol (kJ/mol).
6.8. Tại sao nhiệt tạo thành tiêu chuẩn của ion H+ trong dung dịch được quy ước bằng 0?
Quy ước này được sử dụng vì không thể xác định nhiệt tạo thành của một ion riêng lẻ trong dung dịch do luôn có sự tồn tại của cả cation và anion để đảm bảo tính trung hòa điện.
6.9. Nhiệt tạo thành tiêu chuẩn có ứng dụng gì trong thực tế?
Nhiệt tạo thành tiêu chuẩn có nhiều ứng dụng trong công nghiệp hóa chất, nghiên cứu năng lượng, khoa học môi trường, y học và dược học. Nó được sử dụng để thiết kế và tối ưu hóa các quy trình, đánh giá tính an toàn, dự đoán tính chất của sản phẩm, và nghiên cứu các quá trình hóa học và sinh học.
6.10. Làm thế nào để tìm giá trị nhiệt tạo thành tiêu chuẩn của một chất?
Giá trị nhiệt tạo thành tiêu chuẩn của một chất có thể được tìm thấy trong các bảng dữ liệu nhiệt động học, sách giáo trình hóa học, hoặc các cơ sở dữ liệu trực tuyến như NIST Chemistry WebBook.
Bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải ở Mỹ Đình? Bạn muốn so sánh giá cả, tìm địa điểm mua bán uy tín và dịch vụ sửa chữa chất lượng? Hãy truy cập ngay XETAIMYDINH.EDU.VN để được tư vấn và giải đáp mọi thắc mắc! Chúng tôi cung cấp thông tin cập nhật về các loại xe tải, giúp bạn lựa chọn xe phù hợp với nhu cầu và ngân sách của mình. Liên hệ ngay hotline 0247 309 9988 hoặc đến địa chỉ Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội để được hỗ trợ tốt nhất.
