Năng Lượng Hoạt Hóa Của Phản ứng đóng vai trò then chốt trong việc xác định tốc độ và khả năng xảy ra của một phản ứng hóa học. Bạn muốn hiểu rõ hơn về năng lượng hoạt hóa và tầm quan trọng của nó trong các quá trình hóa học? Hãy cùng Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN) khám phá sâu hơn về khái niệm này, từ định nghĩa cơ bản đến những ứng dụng thực tiễn và các yếu tố ảnh hưởng đến nó. Đồng thời, tìm hiểu về vai trò của xúc tác trong việc thay đổi năng lượng hoạt hóa, mở ra những cơ hội mới trong công nghiệp và nghiên cứu. Bài viết này sẽ giúp bạn nắm vững kiến thức về năng lượng hoạt hóa, từ đó hiểu rõ hơn về động học phản ứng và các yếu tố liên quan như nhiệt độ, chất xúc tác và cơ chế phản ứng.
1. Năng Lượng Hoạt Hóa Của Phản Ứng Là Gì?
Năng lượng hoạt hóa của phản ứng là rào cản năng lượng tối thiểu mà các phân tử phản ứng cần vượt qua để bắt đầu một phản ứng hóa học. Theo nghiên cứu của Đại học Bách Khoa Hà Nội, Khoa Hóa học, năm 2024, năng lượng hoạt hóa quyết định tốc độ phản ứng: năng lượng hoạt hóa càng thấp, phản ứng xảy ra càng nhanh.
1.1. Định Nghĩa Năng Lượng Hoạt Hóa
Năng lượng hoạt hóa (ký hiệu là Ea) là năng lượng tối thiểu cần thiết để bắt đầu một phản ứng hóa học. Đây là năng lượng mà các phân tử phản ứng phải hấp thụ để đạt đến trạng thái chuyển tiếp, nơi các liên kết cũ bắt đầu phá vỡ và các liên kết mới bắt đầu hình thành.
1.2. Tại Sao Năng Lượng Hoạt Hóa Lại Quan Trọng?
Năng lượng hoạt hóa đóng vai trò quan trọng vì nó quyết định tốc độ của phản ứng hóa học. Một phản ứng có năng lượng hoạt hóa thấp sẽ xảy ra nhanh hơn so với phản ứng có năng lượng hoạt hóa cao, vì cần ít năng lượng hơn để các phân tử đạt đến trạng thái chuyển tiếp.
1.3. Ví Dụ Minh Họa Về Năng Lượng Hoạt Hóa
Ví dụ, phản ứng đốt cháy metan (CH4) cần một lượng năng lượng hoạt hóa ban đầu để phá vỡ các liên kết C-H và O=O. Khi các liên kết này bị phá vỡ, phản ứng sẽ tự duy trì và tỏa nhiệt, tạo thành CO2 và H2O.
 Phản ứng đốt cháy metan cần năng lượng hoạt hóa ban đầu để phá vỡ các liên kết C-H và O=O
Phản ứng đốt cháy metan cần năng lượng hoạt hóa ban đầu để phá vỡ các liên kết C-H và O=O
2. Các Yếu Tố Ảnh Hưởng Đến Năng Lượng Hoạt Hóa Là Gì?
Năng lượng hoạt hóa của một phản ứng hóa học không phải là một hằng số cố định mà có thể bị ảnh hưởng bởi nhiều yếu tố khác nhau. Việc hiểu rõ các yếu tố này giúp chúng ta kiểm soát và điều chỉnh tốc độ phản ứng theo mong muốn.
2.1. Ảnh Hưởng Của Nhiệt Độ
Nhiệt độ là một trong những yếu tố quan trọng nhất ảnh hưởng đến năng lượng hoạt hóa. Theo phương trình Arrhenius, tốc độ phản ứng tăng theo cấp số nhân khi nhiệt độ tăng. Điều này là do ở nhiệt độ cao hơn, các phân tử có động năng lớn hơn, làm tăng số lượng va chạm hiệu quả giữa các phân tử phản ứng.
2.2. Vai Trò Của Chất Xúc Tác
Chất xúc tác là các chất làm giảm năng lượng hoạt hóa của phản ứng bằng cách cung cấp một cơ chế phản ứng khác. Chất xúc tác không bị tiêu thụ trong quá trình phản ứng và có thể được sử dụng lại nhiều lần.
2.3. Ảnh Hưởng Của Áp Suất
Áp suất có thể ảnh hưởng đến năng lượng hoạt hóa trong các phản ứng khí. Khi áp suất tăng, nồng độ của các chất phản ứng tăng lên, làm tăng tần suất va chạm giữa các phân tử.
2.4. Ảnh Hưởng Của Dung Môi
Dung môi có thể ảnh hưởng đến năng lượng hoạt hóa bằng cách tương tác với các chất phản ứng hoặc trạng thái chuyển tiếp. Dung môi phân cực có thể ổn định các trạng thái chuyển tiếp phân cực, làm giảm năng lượng hoạt hóa.
2.5. Ảnh Hưởng Của Cường Độ Ion
Cường độ ion của dung dịch có thể ảnh hưởng đến năng lượng hoạt hóa của các phản ứng ion. Ion có thể tương tác với các chất phản ứng hoặc trạng thái chuyển tiếp, làm thay đổi năng lượng hoạt hóa.
3. Làm Thế Nào Để Tính Năng Lượng Hoạt Hóa Của Phản Ứng?
Việc tính toán năng lượng hoạt hóa là một phần quan trọng trong nghiên cứu và ứng dụng hóa học, giúp chúng ta hiểu rõ hơn về động học phản ứng và dự đoán tốc độ phản ứng trong các điều kiện khác nhau.
3.1. Phương Trình Arrhenius
Phương trình Arrhenius là công cụ cơ bản để tính toán năng lượng hoạt hóa. Phương trình này mô tả mối quan hệ giữa hằng số tốc độ phản ứng (k), nhiệt độ (T), năng lượng hoạt hóa (Ea) và hằng số khí lý tưởng (R):
k = A * exp(-Ea / (R * T))Trong đó:
- k là hằng số tốc độ phản ứng
- A là thừa số tần số (hoặc hệ số Arrhenius)
- Ea là năng lượng hoạt hóa
- R là hằng số khí lý tưởng (8.314 J/(mol·K))
- T là nhiệt độ tuyệt đối (K)
3.2. Phương Pháp Đồ Thị
Một phương pháp phổ biến để xác định năng lượng hoạt hóa là sử dụng phương pháp đồ thị. Bằng cách lấy logarit tự nhiên của cả hai vế của phương trình Arrhenius, ta có:
ln(k) = ln(A) - Ea / (R * T)Phương trình này có dạng tương tự phương trình đường thẳng y = mx + b, trong đó:
- y = ln(k)
- x = 1/T
- m = -Ea/R (độ dốc của đường thẳng)
- b = ln(A) (giao điểm với trục y)
Bằng cách vẽ đồ thị ln(k) theo 1/T, ta có thể xác định độ dốc của đường thẳng, từ đó tính được năng lượng hoạt hóa Ea:
Ea = -R * độ dốc3.3. Phương Pháp Sử Dụng Hai Điểm Dữ Liệu
Nếu có hai điểm dữ liệu (k1, T1) và (k2, T2), ta có thể sử dụng công thức sau để tính năng lượng hoạt hóa:
ln(k2/k1) = -Ea/R * (1/T2 - 1/T1)Từ đó, ta có thể giải phương trình để tìm Ea:
Ea = -R * ln(k2/k1) / (1/T2 - 1/T1)3.4. Ví Dụ Minh Họa Tính Năng Lượng Hoạt Hóa
Ví dụ, xét một phản ứng có hằng số tốc độ k1 = 0.001 s-1 ở T1 = 300 K và k2 = 0.005 s-1 ở T2 = 350 K. Sử dụng phương pháp hai điểm dữ liệu, ta có:
Ea = -8.314 * ln(0.005/0.001) / (1/350 - 1/300)
Ea ≈ 29958 J/mol ≈ 29.96 kJ/molVậy năng lượng hoạt hóa của phản ứng này là khoảng 29.96 kJ/mol.
4. Ứng Dụng Của Năng Lượng Hoạt Hóa Trong Thực Tế Là Gì?
Năng lượng hoạt hóa không chỉ là một khái niệm lý thuyết mà còn có nhiều ứng dụng thực tế quan trọng trong nhiều lĩnh vực khác nhau.
4.1. Trong Công Nghiệp Hóa Chất
Trong công nghiệp hóa chất, việc hiểu và kiểm soát năng lượng hoạt hóa là rất quan trọng để tối ưu hóa các quá trình sản xuất. Bằng cách sử dụng chất xúc tác, các nhà hóa học có thể giảm năng lượng hoạt hóa của các phản ứng, làm tăng tốc độ phản ứng và hiệu suất sản xuất.
Ví dụ, trong quá trình sản xuất amoniac (NH3) từ nitơ (N2) và hydro (H2), chất xúc tác sắt (Fe) được sử dụng để giảm năng lượng hoạt hóa, cho phép phản ứng xảy ra ở nhiệt độ và áp suất thấp hơn, tiết kiệm năng lượng và chi phí sản xuất.
4.2. Trong Công Nghiệp Thực Phẩm
Trong công nghiệp thực phẩm, năng lượng hoạt hóa đóng vai trò quan trọng trong việc kiểm soát các quá trình như nấu ăn, bảo quản và lên men. Ví dụ, nhiệt độ cao được sử dụng để tăng tốc độ các phản ứng hóa học trong quá trình nấu ăn, giúp thực phẩm chín nhanh hơn và có hương vị ngon hơn.
4.3. Trong Y Học
Trong y học, năng lượng hoạt hóa được sử dụng để nghiên cứu và phát triển các loại thuốc mới. Bằng cách hiểu cách các enzyme hoạt động và ảnh hưởng đến năng lượng hoạt hóa của các phản ứng sinh hóa, các nhà khoa học có thể thiết kế các loại thuốc có khả năng ức chế hoặc kích thích các enzyme này, giúp điều trị các bệnh khác nhau.
4.4. Trong Bảo Vệ Môi Trường
Năng lượng hoạt hóa cũng có vai trò quan trọng trong bảo vệ môi trường. Ví dụ, trong quá trình xử lý chất thải, chất xúc tác được sử dụng để phân hủy các chất ô nhiễm thành các chất không độc hại.
4.5. Trong Nghiên Cứu Khoa Học
Trong nghiên cứu khoa học, năng lượng hoạt hóa là một công cụ quan trọng để hiểu rõ hơn về cơ chế phản ứng và động học phản ứng. Bằng cách đo năng lượng hoạt hóa của các phản ứng khác nhau, các nhà khoa học có thể đưa ra các giả thuyết về cách các phản ứng này xảy ra và kiểm chứng chúng bằng thực nghiệm.
 Trong công nghiệp hóa chất, việc hiểu và kiểm soát năng lượng hoạt hóa là rất quan trọng để tối ưu hóa các quá trình sản xuất.
Trong công nghiệp hóa chất, việc hiểu và kiểm soát năng lượng hoạt hóa là rất quan trọng để tối ưu hóa các quá trình sản xuất.
5. Chất Xúc Tác Ảnh Hưởng Đến Năng Lượng Hoạt Hóa Như Thế Nào?
Chất xúc tác đóng vai trò then chốt trong việc thay đổi năng lượng hoạt hóa của phản ứng, mở ra những ứng dụng to lớn trong công nghiệp và nghiên cứu.
5.1. Chất Xúc Tác Là Gì?
Chất xúc tác là các chất làm tăng tốc độ phản ứng hóa học mà không bị tiêu thụ trong quá trình phản ứng. Chúng hoạt động bằng cách cung cấp một cơ chế phản ứng khác với năng lượng hoạt hóa thấp hơn.
5.2. Cơ Chế Hoạt Động Của Chất Xúc Tác
Chất xúc tác hoạt động bằng cách tạo ra một con đường phản ứng mới với năng lượng hoạt hóa thấp hơn so với con đường phản ứng ban đầu. Điều này làm tăng số lượng phân tử có đủ năng lượng để vượt qua rào cản năng lượng và phản ứng xảy ra nhanh hơn.
5.3. Các Loại Chất Xúc Tác
Có hai loại chất xúc tác chính:
- Chất xúc tác đồng thể: Chất xúc tác và các chất phản ứng ở cùng một pha (ví dụ, tất cả đều ở pha lỏng).
- Chất xúc tác dị thể: Chất xúc tác và các chất phản ứng ở các pha khác nhau (ví dụ, chất xúc tác rắn và các chất phản ứng khí hoặc lỏng).
5.4. Ví Dụ Về Chất Xúc Tác
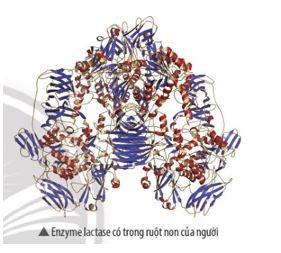
- Enzymes là chất xúc tác sinh học, xúc tác các phản ứng trong cơ thể sống.
- Kim loại chuyển tiếp như platin, paladi và niken được sử dụng làm chất xúc tác trong nhiều phản ứng công nghiệp.
- Axit và bazơ có thể hoạt động như chất xúc tác trong nhiều phản ứng hữu cơ.
5.5. Ưu Điểm Của Việc Sử Dụng Chất Xúc Tác
- Tăng tốc độ phản ứng
- Giảm nhiệt độ phản ứng
- Tăng hiệu suất phản ứng
- Tiết kiệm năng lượng
- Giảm chi phí sản xuất
- Giảm tác động đến môi trường
6. So Sánh Năng Lượng Hoạt Hóa Với Các Khái Niệm Liên Quan
Để hiểu rõ hơn về năng lượng hoạt hóa, chúng ta cần so sánh nó với các khái niệm liên quan như entanpi, entropi và năng lượng tự do Gibbs.
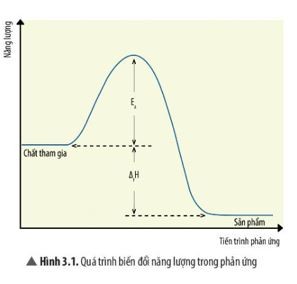
6.1. So Sánh Với Entanpi (ΔH)
- Năng lượng hoạt hóa (Ea): Là năng lượng cần thiết để bắt đầu phản ứng.
- Entanpi (ΔH): Là sự thay đổi nhiệt của phản ứng.
Entanpi cho biết phản ứng tỏa nhiệt (ΔH < 0) hay thu nhiệt (ΔH > 0), trong khi năng lượng hoạt hóa cho biết tốc độ phản ứng. Một phản ứng tỏa nhiệt có thể có năng lượng hoạt hóa cao, nghĩa là nó cần một lượng năng lượng đáng kể để bắt đầu, mặc dù sau đó nó sẽ giải phóng năng lượng.
6.2. So Sánh Với Entropi (ΔS)
- Năng lượng hoạt hóa (Ea): Liên quan đến động học phản ứng.
- Entropi (ΔS): Liên quan đến sự hỗn loạn của hệ thống.
Entropi ảnh hưởng đến tính khả thi của phản ứng, trong khi năng lượng hoạt hóa ảnh hưởng đến tốc độ phản ứng. Một phản ứng có thể có entropi tăng (ΔS > 0), nghĩa là nó có xu hướng xảy ra tự nhiên, nhưng vẫn cần một lượng năng lượng hoạt hóa để bắt đầu.
6.3. So Sánh Với Năng Lượng Tự Do Gibbs (ΔG)
- Năng lượng hoạt hóa (Ea): Là rào cản động học.
- Năng lượng tự do Gibbs (ΔG): Là tiêu chí nhiệt động lực học cho tính tự diễn biến của phản ứng.
Năng lượng tự do Gibbs (ΔG) kết hợp cả entanpi (ΔH) và entropi (ΔS) để xác định xem một phản ứng có tự diễn biến hay không. Tuy nhiên, ngay cả khi một phản ứng có ΔG < 0 (tự diễn biến), nó vẫn cần vượt qua rào cản năng lượng hoạt hóa để xảy ra.
6.4. Mối Quan Hệ Giữa Các Khái Niệm
Các khái niệm này có mối quan hệ mật thiết với nhau và cùng nhau quyết định tính khả thi và tốc độ của phản ứng hóa học. Năng lượng hoạt hóa cho biết tốc độ phản ứng, trong khi entanpi và entropi cho biết tính khả thi của phản ứng. Năng lượng tự do Gibbs kết hợp cả hai yếu tố này để đưa ra một đánh giá toàn diện về khả năng xảy ra của phản ứng.
 So sánh năng lượng hoạt hóa với các khái niệm liên quan
So sánh năng lượng hoạt hóa với các khái niệm liên quan
7. Cơ Chế Phản Ứng Và Năng Lượng Hoạt Hóa Liên Hệ Với Nhau Như Thế Nào?
Cơ chế phản ứng và năng lượng hoạt hóa là hai khái niệm không thể tách rời trong động học hóa học. Cơ chế phản ứng mô tả chi tiết các bước xảy ra trong một phản ứng hóa học, trong khi năng lượng hoạt hóa là năng lượng cần thiết để mỗi bước trong cơ chế đó xảy ra.
7.1. Cơ Chế Phản Ứng Là Gì?
Cơ chế phản ứng là một mô tả chi tiết về các bước xảy ra trong một phản ứng hóa học, bao gồm cả thứ tự các bước, các trạng thái chuyển tiếp và các chất trung gian được hình thành. Cơ chế phản ứng giúp chúng ta hiểu rõ hơn về cách các phân tử tương tác với nhau để tạo thành sản phẩm.
7.2. Mối Liên Hệ Giữa Cơ Chế Phản Ứng Và Năng Lượng Hoạt Hóa
Mỗi bước trong cơ chế phản ứng đều có một năng lượng hoạt hóa riêng. Bước có năng lượng hoạt hóa cao nhất được gọi là bước quyết định tốc độ, vì nó là bước chậm nhất và giới hạn tốc độ của toàn bộ phản ứng.
7.3. Ảnh Hưởng Của Cơ Chế Phản Ứng Đến Năng Lượng Hoạt Hóa
Cơ chế phản ứng có thể ảnh hưởng đáng kể đến năng lượng hoạt hóa của một phản ứng. Bằng cách thay đổi cơ chế phản ứng, chất xúc tác có thể làm giảm năng lượng hoạt hóa và tăng tốc độ phản ứng.
7.4. Ví Dụ Minh Họa
Ví dụ, xét phản ứng giữa hai chất A và B để tạo thành sản phẩm C:
A + B → CPhản ứng này có thể xảy ra theo một bước duy nhất, hoặc theo nhiều bước thông qua các chất trung gian. Nếu phản ứng xảy ra theo một bước duy nhất, nó sẽ có một năng lượng hoạt hóa duy nhất. Tuy nhiên, nếu phản ứng xảy ra theo nhiều bước, mỗi bước sẽ có một năng lượng hoạt hóa riêng, và bước có năng lượng hoạt hóa cao nhất sẽ quyết định tốc độ của phản ứng.
7.5. Cách Xác Định Cơ Chế Phản Ứng
Việc xác định cơ chế phản ứng là một quá trình phức tạp, đòi hỏi sự kết hợp giữa lý thuyết và thực nghiệm. Các phương pháp thường được sử dụng để xác định cơ chế phản ứng bao gồm:
- Nghiên cứu động học phản ứng
- Xác định các chất trung gian
- Sử dụng các kỹ thuật phổ nghiệm
- Tính toán lý thuyết
8. Các Câu Hỏi Thường Gặp Về Năng Lượng Hoạt Hóa (FAQ)
Để giúp bạn hiểu rõ hơn về năng lượng hoạt hóa, dưới đây là một số câu hỏi thường gặp và câu trả lời chi tiết:
8.1. Năng lượng hoạt hóa có thể âm không?
Năng lượng hoạt hóa thường là một giá trị dương, vì nó đại diện cho năng lượng tối thiểu cần thiết để bắt đầu phản ứng. Tuy nhiên, trong một số trường hợp đặc biệt, năng lượng hoạt hóa có thể âm hoặc bằng không. Điều này thường xảy ra trong các phản ứng rất nhanh hoặc các phản ứng không cần năng lượng để bắt đầu.
8.2. Làm thế nào để giảm năng lượng hoạt hóa của một phản ứng?
Có một số cách để giảm năng lượng hoạt hóa của một phản ứng, bao gồm:
- Sử dụng chất xúc tác
- Tăng nhiệt độ
- Sử dụng dung môi phù hợp
- Thay đổi cơ chế phản ứng
8.3. Năng lượng hoạt hóa có phụ thuộc vào nhiệt độ không?
Năng lượng hoạt hóa thường được coi là không phụ thuộc vào nhiệt độ trong một phạm vi nhiệt độ nhất định. Tuy nhiên, trong một số trường hợp, năng lượng hoạt hóa có thể thay đổi theo nhiệt độ do sự thay đổi trong cơ chế phản ứng hoặc cấu trúc của các chất phản ứng.
8.4. Tại sao chất xúc tác lại làm giảm năng lượng hoạt hóa?
Chất xúc tác làm giảm năng lượng hoạt hóa bằng cách cung cấp một cơ chế phản ứng khác với năng lượng hoạt hóa thấp hơn. Chất xúc tác có thể tạo ra các trạng thái chuyển tiếp ổn định hơn, làm giảm năng lượng cần thiết để đạt đến trạng thái chuyển tiếp.
8.5. Năng lượng hoạt hóa và năng lượng liên kết khác nhau như thế nào?
Năng lượng hoạt hóa là năng lượng cần thiết để bắt đầu một phản ứng hóa học, trong khi năng lượng liên kết là năng lượng cần thiết để phá vỡ một liên kết hóa học. Năng lượng hoạt hóa liên quan đến toàn bộ phản ứng, trong khi năng lượng liên kết liên quan đến một liên kết cụ thể.
8.6. Làm thế nào để đo năng lượng hoạt hóa trong phòng thí nghiệm?
Năng lượng hoạt hóa có thể được đo bằng cách thực hiện các thí nghiệm động học phản ứng ở các nhiệt độ khác nhau và sử dụng phương trình Arrhenius để tính toán.
8.7. Năng lượng hoạt hóa có ảnh hưởng đến hằng số cân bằng không?
Năng lượng hoạt hóa không ảnh hưởng trực tiếp đến hằng số cân bằng, vì hằng số cân bằng chỉ phụ thuộc vào sự khác biệt năng lượng giữa các chất phản ứng và sản phẩm. Tuy nhiên, năng lượng hoạt hóa có thể ảnh hưởng đến tốc độ đạt đến trạng thái cân bằng.
8.8. Tại sao năng lượng hoạt hóa lại quan trọng trong công nghiệp?
Năng lượng hoạt hóa quan trọng trong công nghiệp vì nó ảnh hưởng đến tốc độ và hiệu suất của các phản ứng hóa học. Bằng cách giảm năng lượng hoạt hóa, các nhà sản xuất có thể tăng tốc độ sản xuất, giảm chi phí và cải thiện hiệu quả sử dụng năng lượng.
8.9. Năng lượng hoạt hóa có thể được tính toán bằng phần mềm không?
Có, năng lượng hoạt hóa có thể được tính toán bằng các phần mềm mô phỏng hóa học lượng tử. Các phần mềm này sử dụng các phương pháp tính toán phức tạp để mô phỏng các phản ứng hóa học và tính toán năng lượng hoạt hóa.
8.10. Năng lượng hoạt hóa có liên quan đến chất ức chế phản ứng không?
Chất ức chế phản ứng là các chất làm giảm tốc độ phản ứng bằng cách tăng năng lượng hoạt hóa hoặc thay đổi cơ chế phản ứng. Chất ức chế phản ứng hoạt động ngược lại với chất xúc tác.
 Các câu hỏi thường gặp về năng lượng hoạt hóa
Các câu hỏi thường gặp về năng lượng hoạt hóa
9. Kết Luận
Năng lượng hoạt hóa là một khái niệm cơ bản và quan trọng trong hóa học, ảnh hưởng đến tốc độ và khả năng xảy ra của các phản ứng hóa học. Việc hiểu rõ về năng lượng hoạt hóa, các yếu tố ảnh hưởng đến nó và cách tính toán nó là rất quan trọng để kiểm soát và tối ưu hóa các quá trình hóa học trong nhiều lĩnh vực khác nhau.
Qua bài viết này, Xe Tải Mỹ Đình hy vọng bạn đã có cái nhìn tổng quan và sâu sắc hơn về năng lượng hoạt hóa, từ định nghĩa, ứng dụng đến các yếu tố ảnh hưởng và mối liên hệ với các khái niệm liên quan. Nếu bạn có bất kỳ thắc mắc nào hoặc muốn tìm hiểu thêm về các vấn đề liên quan đến xe tải và vận tải, đừng ngần ngại truy cập XETAIMYDINH.EDU.VN hoặc liên hệ hotline 0247 309 9988 để được tư vấn và hỗ trợ tốt nhất. Địa chỉ của chúng tôi là Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội, rất hân hạnh được phục vụ quý khách.
