Một phân tử nước có thể liên kết hydro tối đa với 4 phân tử nước khác; hãy cùng Xe Tải Mỹ Đình tìm hiểu chi tiết về liên kết đặc biệt này và vai trò quan trọng của nó trong thế giới tự nhiên. Để hiểu rõ hơn về các đặc tính độc đáo của nước, một hợp chất thiết yếu cho sự sống, hãy cùng XETAIMYDINH.EDU.VN khám phá sâu hơn về liên kết hydrogen, cấu trúc phân tử nước và những ảnh hưởng quan trọng của chúng. Bài viết này sẽ cung cấp cho bạn những thông tin hữu ích về các đặc điểm của nước và tác động của nó đến môi trường và đời sống hàng ngày, giúp bạn hiểu rõ hơn về vai trò của nước trong thế giới quanh ta.
1. Liên Kết Hydrogen Là Gì?
Liên kết hydrogen là một loại lực hút tĩnh điện yếu xảy ra giữa một nguyên tử hydro (H) đã liên kết cộng hóa trị với một nguyên tử có độ âm điện cao (như oxy (O), nitơ (N) hoặc flo (F)) và một nguyên tử âm điện khác trong một phân tử lân cận. Nó không phải là một liên kết hóa học thực sự như liên kết cộng hóa trị hay liên kết ion, mà là một lực hút giữa các điện tích dương và âm cục bộ.
1.1. Cơ Chế Hình Thành Liên Kết Hydrogen
Liên kết hydrogen hình thành do sự phân cực trong phân tử. Trong phân tử nước (H₂O), oxy có độ âm điện cao hơn hydro, hút các electron về phía mình. Điều này tạo ra một điện tích âm cục bộ (δ-) trên oxy và điện tích dương cục bộ (δ+) trên hydro. Do đó, nguyên tử hydro mang điện tích dương của một phân tử nước hút các nguyên tử oxy mang điện tích âm của các phân tử nước khác, tạo thành liên kết hydrogen.
1.2. Đặc Điểm Của Liên Kết Hydrogen
- Tính yếu: Liên kết hydrogen yếu hơn nhiều so với liên kết cộng hóa trị (khoảng 5-10 lần). Năng lượng liên kết hydrogen thường nằm trong khoảng 20 kJ/mol, trong khi liên kết cộng hóa trị có thể lên đến 400 kJ/mol.
- Tính định hướng: Liên kết hydrogen có tính định hướng cao, mạnh nhất khi ba nguyên tử (ví dụ, O-H···O) nằm trên một đường thẳng. Góc liên kết tối ưu là 180 độ.
- Tính linh hoạt: Mặc dù yếu, số lượng lớn các liên kết hydrogen trong một hệ thống có thể tạo ra một lực liên kết đáng kể. Các liên kết này cũng có thể dễ dàng hình thành và phá vỡ, cho phép các phân tử di chuyển và sắp xếp lại.
2. Cấu Trúc Phân Tử Nước Và Khả Năng Tạo Liên Kết Hydrogen
2.1. Cấu Trúc Đặc Biệt Của Phân Tử Nước
Phân tử nước (H₂O) có cấu trúc hình chữ V, với nguyên tử oxy ở trung tâm và hai nguyên tử hydro liên kết với nó. Góc giữa hai liên kết O-H là khoảng 104.5 độ. Cấu trúc này tạo ra sự phân cực mạnh mẽ trong phân tử nước, làm cho nó trở thành một phân tử lưỡng cực.
2.2. Số Lượng Liên Kết Hydrogen Tối Đa
Mỗi phân tử nước có khả năng tạo tối đa bốn liên kết hydrogen với các phân tử nước khác. Điều này xảy ra như sau:
- Hai liên kết qua nguyên tử oxy: Nguyên tử oxy mang điện tích âm cục bộ (δ-) có thể tạo liên kết hydrogen với hai nguyên tử hydro (δ+) của hai phân tử nước khác.
- Hai liên kết qua nguyên tử hydro: Mỗi nguyên tử hydro mang điện tích dương cục bộ (δ+) có thể tạo liên kết hydrogen với nguyên tử oxy (δ-) của hai phân tử nước khác.
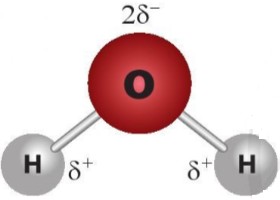 Cấu trúc liên kết hydrogen giữa các phân tử nước, thể hiện khả năng liên kết tối đa bốn phân tử
Cấu trúc liên kết hydrogen giữa các phân tử nước, thể hiện khả năng liên kết tối đa bốn phân tử
2.3. Tại Sao Là Bốn Liên Kết?
Khả năng tạo bốn liên kết hydrogen là do cấu trúc tetrahedral (tứ diện) xung quanh mỗi phân tử nước. Nguyên tử oxy ở trung tâm có hai cặp electron liên kết với hydro và hai cặp electron cô đơn. Các cặp electron này đẩy nhau, tạo ra một hình tứ diện ảo xung quanh oxy, với các nguyên tử hydro và các cặp electron cô đơn nằm ở các đỉnh của tứ diện. Điều này cho phép mỗi phân tử nước liên kết với bốn phân tử nước khác một cách tối ưu.
3. Ảnh Hưởng Của Liên Kết Hydrogen Đến Tính Chất Của Nước
Liên kết hydrogen đóng vai trò quan trọng trong việc xác định các tính chất vật lý và hóa học độc đáo của nước.
3.1. Nhiệt Dung Riêng Cao
Nước có nhiệt dung riêng cao, nghĩa là cần một lượng lớn nhiệt để làm tăng nhiệt độ của nước. Điều này là do phần lớn năng lượng nhiệt được sử dụng để phá vỡ các liên kết hydrogen giữa các phân tử nước thay vì làm tăng động năng của chúng. Theo số liệu từ Bộ Tài nguyên và Môi trường, nhiệt dung riêng của nước là 4.184 J/kg°C, cao hơn nhiều so với các chất lỏng khác.
3.2. Nhiệt Bay Hơi Cao
Tương tự, nước có nhiệt bay hơi cao, nghĩa là cần một lượng lớn nhiệt để chuyển nước từ trạng thái lỏng sang trạng thái khí. Điều này cũng là do cần năng lượng để phá vỡ hoàn toàn các liên kết hydrogen giữa các phân tử nước. Điều này giúp nước trở thành một chất làm mát hiệu quả, vì nó có thể hấp thụ một lượng lớn nhiệt khi bay hơi.
3.3. Sức Căng Bề Mặt Lớn
Liên kết hydrogen tạo ra sức căng bề mặt lớn cho nước. Các phân tử nước trên bề mặt chỉ liên kết với các phân tử nước bên dưới và bên cạnh, tạo ra một lực kéo vào trong. Điều này làm cho bề mặt nước co lại và tạo thành một “màng” đàn hồi. Hiện tượng này cho phép các loài côn trùng nhỏ có thể đi trên mặt nước.
3.4. Tính Chất Dung Môi
Nước là một dung môi phân cực tuyệt vời, có khả năng hòa tan nhiều chất phân cực và ion. Điều này là do các phân tử nước có thể bao quanh các ion hoặc các phân tử phân cực khác, tương tác với chúng thông qua lực hút tĩnh điện và liên kết hydrogen, phá vỡ các liên kết giữa các phân tử chất tan và phân tán chúng trong nước.
3.5. Sự Giãn Nở Khi Đóng Băng
Một trong những tính chất kỳ lạ nhất của nước là nó giãn nở khi đóng băng. Khi nước đóng băng, các phân tử nước sắp xếp thành một cấu trúc tinh thể mở, trong đó mỗi phân tử nước liên kết với bốn phân tử nước khác thông qua liên kết hydrogen. Cấu trúc này chiếm nhiều không gian hơn so với trạng thái lỏng, làm cho băng có mật độ thấp hơn nước lỏng. Điều này giải thích tại sao băng lại nổi trên mặt nước.
4. Vai Trò Của Liên Kết Hydrogen Trong Sinh Học
Liên kết hydrogen đóng vai trò vô cùng quan trọng trong nhiều quá trình sinh học.
4.1. Cấu Trúc Của Protein
Liên kết hydrogen giúp duy trì cấu trúc ba chiều của protein. Các liên kết này hình thành giữa các nhóm amino acid khác nhau trong chuỗi polypeptide, tạo ra các cấu trúc như alpha helix và beta sheet. Cấu trúc này rất quan trọng cho chức năng của protein, vì nó xác định hình dạng và khả năng tương tác của protein với các phân tử khác.
4.2. Cấu Trúc Của DNA
Liên kết hydrogen cũng rất quan trọng trong cấu trúc của DNA. Hai chuỗi polynucleotide trong DNA được giữ với nhau bằng các liên kết hydrogen giữa các base nitơ. Adenine (A) liên kết với thymine (T) bằng hai liên kết hydrogen, và guanine (G) liên kết với cytosine (C) bằng ba liên kết hydrogen. Các liên kết này giúp duy trì cấu trúc xoắn kép của DNA và đảm bảo sự sao chép và phiên mã chính xác.
4.3. Chức Năng Của Enzyme
Enzyme là các protein xúc tác các phản ứng hóa học trong cơ thể. Liên kết hydrogen đóng vai trò quan trọng trong việc liên kết enzyme với chất nền và trong quá trình xúc tác. Các liên kết này giúp định hướng chất nền trong vị trí hoạt động của enzyme và tạo điều kiện cho phản ứng xảy ra.
4.4. Vận Chuyển Nước Trong Thực Vật
Liên kết hydrogen đóng vai trò quan trọng trong việc vận chuyển nước từ rễ lên lá trong thực vật. Sự bốc hơi nước từ lá tạo ra một lực hút, kéo các phân tử nước lên trên. Các phân tử nước liên kết với nhau thông qua liên kết hydrogen, tạo thành một cột nước liên tục trong các mạch dẫn của cây.
4.5. Duy Trì Hình Dạng Tế Bào
Liên kết hydrogen giúp duy trì hình dạng và cấu trúc của tế bào. Các liên kết này hình thành giữa các phân tử nước và các thành phần khác của tế bào, tạo ra một mạng lưới hỗ trợ.
5. Ứng Dụng Của Liên Kết Hydrogen Trong Đời Sống
Liên kết hydrogen không chỉ quan trọng trong tự nhiên mà còn có nhiều ứng dụng trong đời sống hàng ngày.
5.1. Sản Xuất Giấy
Trong quá trình sản xuất giấy, liên kết hydrogen được sử dụng để liên kết các sợi cellulose với nhau, tạo ra một tờ giấy chắc chắn. Các sợi cellulose có nhiều nhóm hydroxyl (OH), có thể tạo liên kết hydrogen với nhau và với các phân tử nước.
5.2. Sản Xuất Vải
Tương tự, liên kết hydrogen cũng được sử dụng trong sản xuất vải. Các sợi tự nhiên như bông và lanh có nhiều nhóm hydroxyl, cho phép chúng liên kết với nhau thông qua liên kết hydrogen, tạo ra một loại vải bền và chắc chắn.
5.3. Sản Xuất Thực Phẩm
Liên kết hydrogen đóng vai trò quan trọng trong nhiều loại thực phẩm. Ví dụ, trong protein, liên kết hydrogen giúp duy trì cấu trúc ba chiều, ảnh hưởng đến hương vị và kết cấu của thực phẩm. Trong tinh bột, liên kết hydrogen giúp tạo ra cấu trúc hạt, ảnh hưởng đến độ đặc và độ dẻo của thực phẩm.
5.4. Sản Xuất Mỹ Phẩm
Liên kết hydrogen được sử dụng trong nhiều loại mỹ phẩm để tạo độ ẩm và độ mịn cho da. Các chất giữ ẩm như glycerin và hyaluronic acid có nhiều nhóm hydroxyl, có thể tạo liên kết hydrogen với nước, giữ nước trên bề mặt da và ngăn ngừa sự mất nước.
5.5. Trong Công Nghiệp Dược Phẩm
Liên kết hydrogen đóng vai trò quan trọng trong việc thiết kế và phát triển thuốc. Các nhà khoa học sử dụng liên kết hydrogen để tạo ra các loại thuốc có thể liên kết với các mục tiêu cụ thể trong cơ thể, chẳng hạn như enzyme hoặc protein thụ thể.
6. Các Yếu Tố Ảnh Hưởng Đến Liên Kết Hydrogen
Mặc dù liên kết hydrogen là một lực hút tương đối yếu, nhưng nó có thể bị ảnh hưởng bởi nhiều yếu tố.
6.1. Nhiệt Độ
Nhiệt độ là một trong những yếu tố quan trọng nhất ảnh hưởng đến liên kết hydrogen. Khi nhiệt độ tăng, các phân tử chuyển động nhanh hơn, làm tăng động năng của chúng. Điều này làm cho các liên kết hydrogen dễ bị phá vỡ hơn.
6.2. Áp Suất
Áp suất cũng có thể ảnh hưởng đến liên kết hydrogen. Khi áp suất tăng, các phân tử bị ép lại gần nhau hơn, làm tăng khả năng hình thành liên kết hydrogen. Tuy nhiên, áp suất quá cao có thể làm biến dạng cấu trúc phân tử và làm giảm độ bền của liên kết hydrogen.
6.3. Độ pH
Độ pH của dung dịch có thể ảnh hưởng đến liên kết hydrogen bằng cách thay đổi điện tích của các phân tử. Ví dụ, trong môi trường axit, các phân tử có thể tích điện dương, làm tăng khả năng hình thành liên kết hydrogen với các phân tử âm điện. Trong môi trường kiềm, các phân tử có thể tích điện âm, làm giảm khả năng hình thành liên kết hydrogen với các phân tử dương điện.
6.4. Sự Hiện Diện Của Các Ion
Sự hiện diện của các ion trong dung dịch cũng có thể ảnh hưởng đến liên kết hydrogen. Các ion có thể cạnh tranh với các phân tử nước để liên kết với các phân tử khác, làm giảm số lượng liên kết hydrogen.
6.5. Bản Chất Của Dung Môi
Bản chất của dung môi cũng có thể ảnh hưởng đến liên kết hydrogen. Các dung môi phân cực có thể cạnh tranh với các phân tử nước để liên kết với các phân tử khác, làm giảm số lượng liên kết hydrogen. Các dung môi không phân cực không có khả năng này.
7. Các Nghiên Cứu Mới Nhất Về Liên Kết Hydrogen
Các nhà khoa học vẫn đang tiếp tục nghiên cứu về liên kết hydrogen để hiểu rõ hơn về vai trò của nó trong tự nhiên và trong các ứng dụng công nghệ.
7.1. Liên Kết Hydrogen Trong Các Hệ Sinh Học
Các nghiên cứu gần đây đã tập trung vào vai trò của liên kết hydrogen trong các hệ sinh học phức tạp, chẳng hạn như trong quá trình gấp nếp protein và trong sự hình thành của các cấu trúc tế bào. Các nhà khoa học đang sử dụng các kỹ thuật tiên tiến như kính hiển vi lực nguyên tử và mô phỏng máy tính để nghiên cứu các liên kết hydrogen ở cấp độ phân tử.
7.2. Liên Kết Hydrogen Trong Vật Liệu Mới
Các nhà khoa học cũng đang nghiên cứu cách sử dụng liên kết hydrogen để tạo ra các vật liệu mới với các tính chất độc đáo. Ví dụ, các nhà khoa học đã tạo ra các vật liệu tự lắp ráp dựa trên liên kết hydrogen, có thể được sử dụng trong các ứng dụng như phân phối thuốc và cảm biến sinh học.
7.3. Liên Kết Hydrogen Trong Năng Lượng Tái Tạo
Liên kết hydrogen cũng có thể đóng vai trò trong năng lượng tái tạo. Các nhà khoa học đang nghiên cứu cách sử dụng liên kết hydrogen để lưu trữ năng lượng trong các phân tử, chẳng hạn như trong hydro. Hydro có thể được sử dụng làm nhiên liệu sạch, không tạo ra khí thải nhà kính.
8. So Sánh Liên Kết Hydrogen Với Các Loại Liên Kết Khác
Để hiểu rõ hơn về tầm quan trọng của liên kết hydrogen, chúng ta hãy so sánh nó với các loại liên kết khác.
8.1. Liên Kết Cộng Hóa Trị
Liên kết cộng hóa trị là loại liên kết mạnh nhất, hình thành khi hai nguyên tử chia sẻ electron để đạt được cấu hình electron bền vững. Ví dụ, trong phân tử nước, oxy và hydro chia sẻ electron để tạo thành liên kết cộng hóa trị. Liên kết cộng hóa trị mạnh hơn nhiều so với liên kết hydrogen, thường có năng lượng liên kết từ 200 đến 400 kJ/mol.
8.2. Liên Kết Ion
Liên kết ion hình thành khi một nguyên tử chuyển electron cho một nguyên tử khác, tạo ra các ion tích điện trái dấu hút nhau. Ví dụ, trong natri clorua (NaCl), natri chuyển một electron cho clo, tạo ra ion natri dương (Na+) và ion clorua âm (Cl-). Lực hút tĩnh điện giữa các ion này tạo thành liên kết ion. Liên kết ion cũng mạnh hơn liên kết hydrogen, thường có năng lượng liên kết từ 100 đến 350 kJ/mol.
8.3. Tương Tác Van Der Waals
Tương tác Van der Waals là các lực hút yếu giữa các phân tử do sự dao động tạm thời của các electron, tạo ra các lưỡng cực tạm thời. Các tương tác này rất yếu, thường có năng lượng liên kết chỉ từ 0.4 đến 4 kJ/mol. Tuy nhiên, trong các phân tử lớn, số lượng lớn các tương tác Van der Waals có thể tạo ra một lực hút đáng kể.
8.4. So Sánh Tổng Quan
| Loại Liên Kết | Năng Lượng Liên Kết (kJ/mol) | Đặc Điểm |
|---|---|---|
| Liên Kết Cộng Hóa Trị | 200 – 400 | Mạnh, hình thành do sự chia sẻ electron |
| Liên Kết Ion | 100 – 350 | Mạnh, hình thành do lực hút tĩnh điện giữa các ion trái dấu |
| Liên Kết Hydrogen | 20 – 40 | Yếu, hình thành do lực hút giữa các điện tích dương và âm cục bộ |
| Tương Tác Van Der Waals | 0.4 – 4 | Rất yếu, hình thành do sự dao động tạm thời của các electron |
Mặc dù liên kết hydrogen yếu hơn nhiều so với liên kết cộng hóa trị và liên kết ion, nhưng nó lại rất quan trọng trong nhiều quá trình sinh học và hóa học.
9. Tương Lai Của Nghiên Cứu Về Liên Kết Hydrogen
Nghiên cứu về liên kết hydrogen vẫn là một lĩnh vực năng động và đầy hứa hẹn. Các nhà khoa học đang tiếp tục khám phá các khía cạnh mới của liên kết này và ứng dụng nó trong nhiều lĩnh vực khác nhau.
9.1. Phát Triển Các Vật Liệu Mới
Các nhà khoa học đang tìm cách sử dụng liên kết hydrogen để tạo ra các vật liệu mới với các tính chất độc đáo, chẳng hạn như khả năng tự phục hồi, khả năng thay đổi hình dạng và khả năng đáp ứng với các kích thích bên ngoài. Các vật liệu này có thể được sử dụng trong nhiều ứng dụng, từ y học đến kỹ thuật.
9.2. Hiểu Rõ Hơn Về Các Quá Trình Sinh Học
Các nhà khoa học đang sử dụng các kỹ thuật tiên tiến để nghiên cứu liên kết hydrogen trong các quá trình sinh học phức tạp, chẳng hạn như quá trình gấp nếp protein và quá trình truyền tín hiệu tế bào. Hiểu rõ hơn về vai trò của liên kết hydrogen trong các quá trình này có thể giúp chúng ta phát triển các phương pháp điều trị mới cho các bệnh khác nhau.
9.3. Ứng Dụng Trong Năng Lượng Tái Tạo
Các nhà khoa học đang nghiên cứu cách sử dụng liên kết hydrogen để lưu trữ năng lượng trong các phân tử, chẳng hạn như trong hydro. Phát triển các phương pháp hiệu quả để lưu trữ hydro có thể giúp chúng ta tạo ra một nguồn năng lượng sạch và bền vững.
10. Câu Hỏi Thường Gặp Về Liên Kết Hydrogen (FAQ)
10.1. Liên kết hydrogen có mạnh hơn liên kết Van der Waals không?
Có, liên kết hydrogen mạnh hơn đáng kể so với liên kết Van der Waals. Năng lượng liên kết hydrogen thường nằm trong khoảng 20 kJ/mol, trong khi năng lượng liên kết Van der Waals chỉ từ 0.4 đến 4 kJ/mol.
10.2. Tại sao nước lại có nhiệt độ sôi cao bất thường?
Nước có nhiệt độ sôi cao bất thường là do sự hiện diện của liên kết hydrogen giữa các phân tử nước. Cần một lượng lớn năng lượng để phá vỡ các liên kết này, làm cho nước khó bay hơi hơn so với các chất lỏng khác có kích thước phân tử tương tự.
10.3. Liên kết hydrogen có vai trò gì trong DNA?
Liên kết hydrogen giữ hai chuỗi polynucleotide trong DNA với nhau, tạo ra cấu trúc xoắn kép đặc trưng. Adenine (A) liên kết với thymine (T) bằng hai liên kết hydrogen, và guanine (G) liên kết với cytosine (C) bằng ba liên kết hydrogen.
10.4. Liên kết hydrogen có thể hình thành giữa các phân tử khác nhau không?
Có, liên kết hydrogen có thể hình thành giữa các phân tử khác nhau, miễn là có một nguyên tử hydro liên kết với một nguyên tử có độ âm điện cao (như oxy, nitơ hoặc flo) và một nguyên tử âm điện khác trong phân tử lân cận.
10.5. Nhiệt độ ảnh hưởng như thế nào đến liên kết hydrogen?
Khi nhiệt độ tăng, các phân tử chuyển động nhanh hơn, làm tăng động năng của chúng. Điều này làm cho các liên kết hydrogen dễ bị phá vỡ hơn.
10.6. Áp suất ảnh hưởng như thế nào đến liên kết hydrogen?
Khi áp suất tăng, các phân tử bị ép lại gần nhau hơn, làm tăng khả năng hình thành liên kết hydrogen. Tuy nhiên, áp suất quá cao có thể làm biến dạng cấu trúc phân tử và làm giảm độ bền của liên kết hydrogen.
10.7. Liên kết hydrogen có quan trọng trong công nghiệp thực phẩm không?
Có, liên kết hydrogen đóng vai trò quan trọng trong nhiều loại thực phẩm. Ví dụ, trong protein, liên kết hydrogen giúp duy trì cấu trúc ba chiều, ảnh hưởng đến hương vị và kết cấu của thực phẩm. Trong tinh bột, liên kết hydrogen giúp tạo ra cấu trúc hạt, ảnh hưởng đến độ đặc và độ dẻo của thực phẩm.
10.8. Liên kết hydrogen có vai trò gì trong sản xuất giấy?
Trong quá trình sản xuất giấy, liên kết hydrogen được sử dụng để liên kết các sợi cellulose với nhau, tạo ra một tờ giấy chắc chắn. Các sợi cellulose có nhiều nhóm hydroxyl (OH), có thể tạo liên kết hydrogen với nhau và với các phân tử nước.
10.9. Làm thế nào để nghiên cứu liên kết hydrogen ở cấp độ phân tử?
Các nhà khoa học sử dụng các kỹ thuật tiên tiến như kính hiển vi lực nguyên tử và mô phỏng máy tính để nghiên cứu các liên kết hydrogen ở cấp độ phân tử.
10.10. Liên kết hydrogen có thể được sử dụng để tạo ra các vật liệu mới không?
Có, các nhà khoa học đã tạo ra các vật liệu tự lắp ráp dựa trên liên kết hydrogen, có thể được sử dụng trong các ứng dụng như phân phối thuốc và cảm biến sinh học.
Bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải ở Mỹ Đình? Bạn muốn so sánh giá cả, tìm hiểu về dịch vụ sửa chữa uy tín hoặc cần tư vấn để chọn được chiếc xe tải phù hợp nhất? Hãy đến với XETAIMYDINH.EDU.VN ngay hôm nay! Đội ngũ chuyên gia của Xe Tải Mỹ Đình luôn sẵn sàng giải đáp mọi thắc mắc và cung cấp cho bạn những thông tin chính xác và cập nhật nhất. Liên hệ ngay hotline 0247 309 9988 hoặc ghé thăm địa chỉ Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội để được hỗ trợ tốt nhất. Xe Tải Mỹ Đình – đối tác tin cậy của bạn trên mọi nẻo đường!