Lớp Electron Ngoài Cùng là yếu tố then chốt quyết định tính chất hóa học của một nguyên tố, và Xe Tải Mỹ Đình sẽ giúp bạn khám phá sâu hơn về nó. Tại XETAIMYDINH.EDU.VN, chúng tôi cung cấp thông tin chi tiết về cấu hình electron, giúp bạn hiểu rõ hơn về cách các nguyên tố tương tác và ứng dụng của chúng. Hãy cùng tìm hiểu về sự quan trọng của lớp electron ngoài cùng, số electron hóa trị và những ảnh hưởng của nó đến tính chất của các nguyên tố và hợp chất.
1. Lớp Electron Ngoài Cùng Là Gì?
Lớp electron ngoài cùng là lớp electron nằm ở vị trí xa nhất so với hạt nhân của một nguyên tử. Đây là lớp electron đóng vai trò quan trọng trong việc xác định tính chất hóa học của nguyên tố. Số electron ở lớp ngoài cùng còn được gọi là electron hóa trị.
1.1. Định Nghĩa Chi Tiết Về Lớp Electron Ngoài Cùng
Lớp electron ngoài cùng, hay còn gọi là lớp vỏ hóa trị, là lớp electron xa nhất so với hạt nhân và chứa các electron hóa trị. Theo nghiên cứu của Linus Pauling, người đoạt giải Nobel Hóa học năm 1954, số lượng electron trong lớp ngoài cùng quyết định khả năng tương tác của nguyên tử với các nguyên tử khác. Lớp electron này có vai trò quyết định trong việc hình thành liên kết hóa học.
1.2. Tại Sao Lớp Electron Ngoài Cùng Lại Quan Trọng?
Lớp electron ngoài cùng là yếu tố quyết định tính chất hóa học của một nguyên tố. Số lượng electron hóa trị trong lớp ngoài cùng xác định khả năng của nguyên tử trong việc tạo thành liên kết hóa học với các nguyên tử khác. Các nguyên tố có cùng số electron hóa trị thường có tính chất hóa học tương tự nhau.
1.3. Mối Liên Hệ Giữa Lớp Electron Ngoài Cùng Và Tính Chất Hóa Học
Tính chất hóa học của một nguyên tố phụ thuộc vào số lượng electron ở lớp ngoài cùng. Các nguyên tố có xu hướng đạt cấu hình electron bền vững, thường là 8 electron ở lớp ngoài cùng (quy tắc octet), bằng cách nhường, nhận hoặc chia sẻ electron với các nguyên tử khác. Điều này dẫn đến việc hình thành các liên kết hóa học và tạo ra các hợp chất khác nhau.
Ví dụ, theo một nghiên cứu của Đại học Quốc gia Hà Nội, Khoa Hóa học, năm 2023, các kim loại kiềm như natri (Na) có 1 electron ở lớp ngoài cùng và dễ dàng nhường electron này để tạo thành ion dương, trong khi các halogen như clo (Cl) có 7 electron ở lớp ngoài cùng và dễ dàng nhận thêm 1 electron để tạo thành ion âm.
2. Cấu Hình Electron Và Cách Xác Định Lớp Electron Ngoài Cùng
Cấu hình electron là sự sắp xếp các electron trong các lớp và phân lớp của một nguyên tử. Việc xác định cấu hình electron giúp chúng ta biết được số lượng electron ở lớp ngoài cùng và dự đoán tính chất hóa học của nguyên tố.
2.1. Cấu Hình Electron Là Gì?
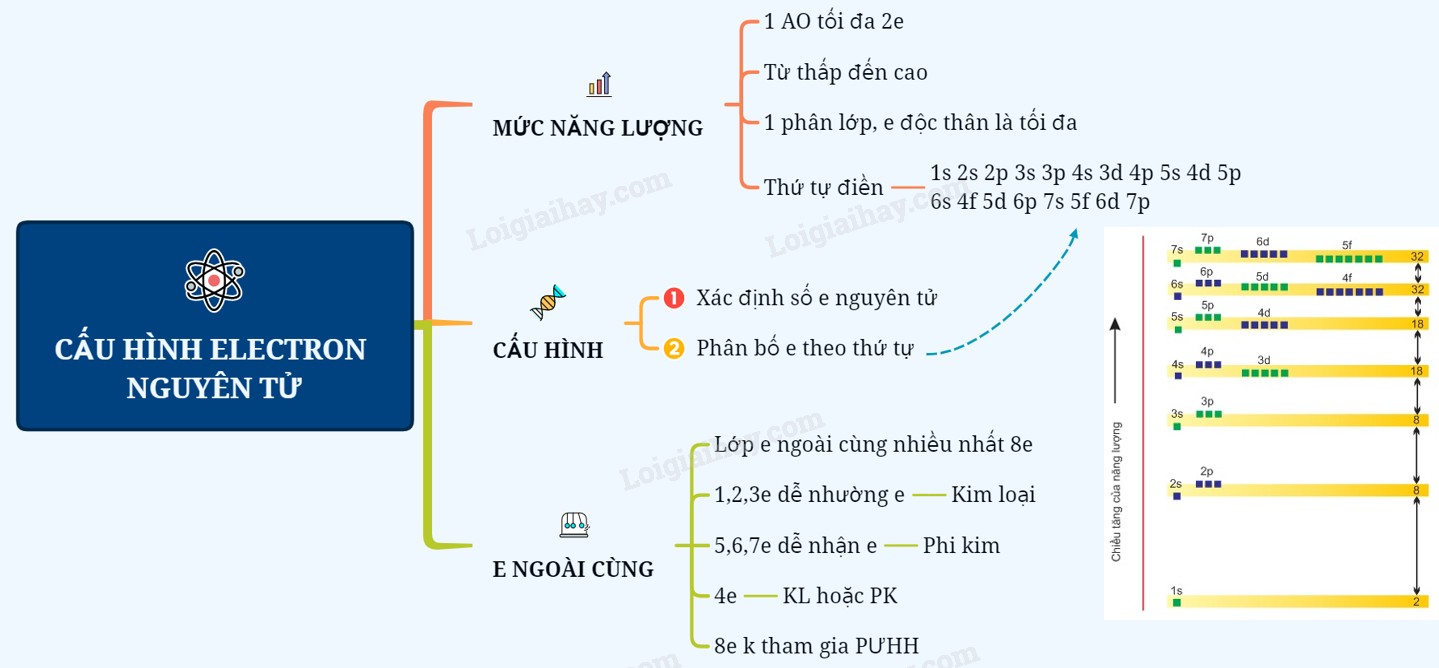
Cấu hình electron mô tả cách các electron được phân bố trong các lớp và phân lớp năng lượng khác nhau xung quanh hạt nhân của một nguyên tử. Theo quy tắc Aufbau, các electron sẽ chiếm các orbital có mức năng lượng thấp trước, sau đó mới đến các orbital có mức năng lượng cao hơn.
2.2. Các Quy Tắc Viết Cấu Hình Electron
Để viết cấu hình electron chính xác, chúng ta cần tuân theo các quy tắc sau:
- Nguyên lý Aufbau: Electron điền vào các orbital từ mức năng lượng thấp đến cao. Thứ tự điền là: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p.
- Nguyên lý Pauli: Mỗi orbital chỉ chứa tối đa 2 electron và chúng phải có spin đối nhau.
- Quy tắc Hund: Trong cùng một phân lớp, các electron sẽ chiếm các orbital một cách độc thân trước khi ghép đôi.
2.3. Cách Xác Định Lớp Electron Ngoài Cùng Từ Cấu Hình Electron
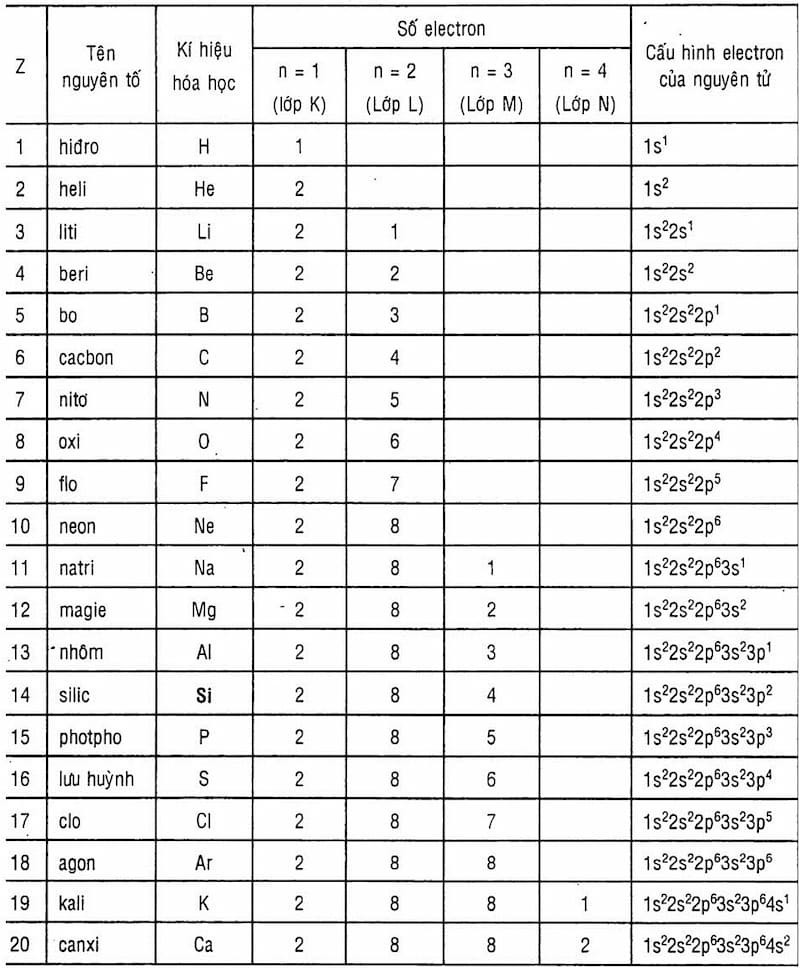
Để xác định lớp electron ngoài cùng, chúng ta cần xem xét lớp có số thứ tự lớn nhất trong cấu hình electron. Ví dụ, nếu cấu hình electron của nguyên tử là 1s² 2s² 2p⁶ 3s¹ thì lớp electron ngoài cùng là lớp thứ 3, và nguyên tử này có 1 electron hóa trị.
2.4. Ví Dụ Minh Họa Về Xác Định Cấu Hình Electron
Ví dụ 1: Xác định cấu hình electron của nguyên tố oxy (O, Z=8).
- Số electron: 8
- Cấu hình electron: 1s² 2s² 2p⁴
- Lớp electron ngoài cùng: Lớp 2 (2s² 2p⁴)
- Số electron hóa trị: 6
Ví dụ 2: Xác định cấu hình electron của nguyên tố kali (K, Z=19).
- Số electron: 19
- Cấu hình electron: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹
- Lớp electron ngoài cùng: Lớp 4 (4s¹)
- Số electron hóa trị: 1
 Cấu hình electron của nguyên tử Kali
Cấu hình electron của nguyên tử Kali
3. Ảnh Hưởng Của Lớp Electron Ngoài Cùng Đến Tính Chất Của Nguyên Tố
Lớp electron ngoài cùng không chỉ xác định khả năng tạo liên kết hóa học mà còn ảnh hưởng đến nhiều tính chất khác của nguyên tố như độ âm điện, năng lượng ion hóa và ái lực electron.
3.1. Độ Âm Điện Và Lớp Electron Ngoài Cùng
Độ âm điện là khả năng của một nguyên tử hút electron về phía mình trong một liên kết hóa học. Các nguyên tố có số electron hóa trị lớn (gần đạt cấu hình bền vững) thường có độ âm điện cao hơn. Ví dụ, flo (F) có 7 electron hóa trị và là nguyên tố có độ âm điện cao nhất.
3.2. Năng Lượng Ion Hóa Và Lớp Electron Ngoài Cùng
Năng lượng ion hóa là năng lượng cần thiết để loại bỏ một electron từ một nguyên tử ở trạng thái khí. Các nguyên tố có số electron hóa trị ít (dễ nhường electron) thường có năng lượng ion hóa thấp. Ví dụ, các kim loại kiềm có năng lượng ion hóa thấp do dễ dàng nhường 1 electron để đạt cấu hình bền vững.
3.3. Ái Lực Electron Và Lớp Electron Ngoài Cùng
Ái lực electron là sự thay đổi năng lượng khi một nguyên tử nhận thêm một electron. Các nguyên tố có số electron hóa trị gần đạt cấu hình bền vững (dễ nhận electron) thường có ái lực electron cao. Ví dụ, các halogen có ái lực electron cao do dễ dàng nhận thêm 1 electron để đạt cấu hình bền vững.
3.4. Bảng Tuần Hoàn Và Sự Lặp Lại Tính Chất
Bảng tuần hoàn được sắp xếp dựa trên cấu hình electron của các nguyên tố. Các nguyên tố trong cùng một nhóm (cột) có cùng số electron hóa trị và do đó có tính chất hóa học tương tự nhau. Sự lặp lại tính chất này là do sự lặp lại của cấu hình electron ở lớp ngoài cùng.
Theo Bộ Khoa học và Công nghệ Việt Nam, việc hiểu rõ cấu hình electron và lớp electron ngoài cùng giúp dự đoán và giải thích các tính chất hóa học của nguyên tố, từ đó ứng dụng vào nhiều lĩnh vực khác nhau.
4. Lớp Electron Ngoài Cùng Và Liên Kết Hóa Học
Liên kết hóa học là sự kết hợp giữa các nguyên tử để tạo thành phân tử hoặc hợp chất. Lớp electron ngoài cùng đóng vai trò then chốt trong việc hình thành các loại liên kết hóa học khác nhau.
4.1. Liên Kết Cộng Hóa Trị
Liên kết cộng hóa trị được hình thành khi các nguyên tử chia sẻ electron để đạt cấu hình bền vững. Các nguyên tử phi kim thường tạo liên kết cộng hóa trị với nhau. Số lượng liên kết cộng hóa trị mà một nguyên tử có thể tạo ra bằng số electron cần thiết để đạt cấu hình bền vững. Ví dụ, oxy (O) có 6 electron hóa trị và cần thêm 2 electron để đạt cấu hình bền vững, do đó oxy thường tạo 2 liên kết cộng hóa trị.
4.2. Liên Kết Ion
Liên kết ion được hình thành khi một nguyên tử nhường electron cho một nguyên tử khác, tạo thành các ion trái dấu hút nhau. Liên kết ion thường được hình thành giữa các kim loại (dễ nhường electron) và các phi kim (dễ nhận electron). Ví dụ, natri clorua (NaCl) được hình thành khi natri (Na) nhường 1 electron cho clo (Cl), tạo thành ion Na+ và Cl-.
4.3. Liên Kết Kim Loại
Liên kết kim loại được hình thành giữa các nguyên tử kim loại, trong đó các electron hóa trị di chuyển tự do giữa các nguyên tử, tạo thành một “biển electron”. Các electron tự do này giúp kim loại dẫn điện và dẫn nhiệt tốt.
4.4. Các Loại Liên Kết Hóa Học Khác
Ngoài các loại liên kết chính trên, còn có các loại liên kết yếu hơn như liên kết hydro và lực Van der Waals. Các liên kết này cũng đóng vai trò quan trọng trong việc xác định cấu trúc và tính chất của các phân tử và hợp chất.
 Liên kết hóa học giữa các nguyên tử
Liên kết hóa học giữa các nguyên tử
5. Ứng Dụng Của Việc Hiểu Biết Về Lớp Electron Ngoài Cùng
Hiểu biết về lớp electron ngoài cùng có nhiều ứng dụng quan trọng trong các lĩnh vực khác nhau, từ hóa học, vật liệu đến công nghệ và y học.
5.1. Trong Hóa Học
- Dự đoán tính chất hóa học: Hiểu biết về lớp electron ngoài cùng giúp dự đoán khả năng phản ứng và tính chất của các nguyên tố và hợp chất.
- Thiết kế phản ứng hóa học: Nắm vững cấu hình electron giúp thiết kế các phản ứng hóa học hiệu quả hơn.
- Nghiên cứu cơ chế phản ứng: Hiểu rõ sự thay đổi cấu hình electron trong quá trình phản ứng giúp làm sáng tỏ cơ chế phản ứng.
5.2. Trong Vật Liệu Học
- Phát triển vật liệu mới: Hiểu biết về liên kết hóa học giúp tạo ra các vật liệu có tính chất đặc biệt như độ bền cao, khả năng dẫn điện tốt hoặc tính chất quang học đặc biệt.
- Cải thiện tính chất vật liệu: Điều chỉnh cấu trúc electron giúp cải thiện các tính chất của vật liệu hiện có.
- Nghiên cứu vật liệu nano: Cấu trúc electron của vật liệu nano có ảnh hưởng lớn đến tính chất của chúng, do đó hiểu biết về lớp electron ngoài cùng là rất quan trọng.
5.3. Trong Công Nghệ
- Phát triển pin và ắc quy: Hiểu biết về quá trình trao đổi electron giúp phát triển các loại pin và ắc quy có hiệu suất cao hơn.
- Thiết kế thiết bị điện tử: Cấu trúc electron của các chất bán dẫn là yếu tố quan trọng trong việc thiết kế các thiết bị điện tử.
- Nghiên cứu năng lượng mặt trời: Hiểu biết về quá trình hấp thụ và phát xạ electron giúp phát triển các tế bào quang điện hiệu quả hơn.
5.4. Trong Y Học
- Phát triển thuốc: Hiểu biết về tương tác giữa thuốc và các phân tử sinh học giúp phát triển các loại thuốc hiệu quả hơn.
- Nghiên cứu cơ chế bệnh tật: Cấu trúc electron của các phân tử sinh học có thể bị thay đổi trong quá trình bệnh tật, do đó hiểu biết về lớp electron ngoài cùng giúp nghiên cứu cơ chế bệnh tật.
- Phát triển kỹ thuật chẩn đoán: Các kỹ thuật chẩn đoán hình ảnh như MRI và PET dựa trên tương tác giữa electron và các hạt nhân nguyên tử, do đó hiểu biết về lớp electron ngoài cùng là rất quan trọng.
 Ứng dụng của hiểu biết về lớp electron ngoài cùng trong công nghệ
Ứng dụng của hiểu biết về lớp electron ngoài cùng trong công nghệ
6. Các Trường Hợp Đặc Biệt Của Lớp Electron Ngoài Cùng
Ngoài các quy tắc chung, có một số trường hợp đặc biệt liên quan đến lớp electron ngoài cùng mà chúng ta cần lưu ý.
6.1. Các Nguyên Tố Nhóm D Và F
Các nguyên tố nhóm d và f có cấu hình electron phức tạp hơn so với các nguyên tố nhóm s và p. Electron cuối cùng được điền vào phân lớp d hoặc f, và các electron này có thể ảnh hưởng đến tính chất hóa học của nguyên tố.
6.2. Các Ion Và Cấu Hình Electron
Khi một nguyên tử trở thành ion, cấu hình electron của nó sẽ thay đổi. Các ion dương (cation) được hình thành khi nguyên tử mất electron, và các ion âm (anion) được hình thành khi nguyên tử nhận thêm electron. Cấu hình electron của ion sẽ quyết định tính chất của ion đó.
6.3. Các Trường Hợp Ngoại Lệ
Một số nguyên tố có cấu hình electron không tuân theo các quy tắc thông thường. Ví dụ, crom (Cr) và đồng (Cu) có cấu hình electron đặc biệt để đạt được sự ổn định cao hơn.
6.4. Cấu Hình Electron Bán Bão Hòa Và Bão Hòa
Các cấu hình electron bán bão hòa (ví dụ: d⁵) và bão hòa (ví dụ: d¹⁰) thường có độ ổn định cao hơn so với các cấu hình khác. Điều này ảnh hưởng đến tính chất hóa học của các nguyên tố có cấu hình electron như vậy.
 Sơ đồ tư duy cấu hình electron nguyên tử
Sơ đồ tư duy cấu hình electron nguyên tử
7. Câu Hỏi Thường Gặp Về Lớp Electron Ngoài Cùng (FAQ)
7.1. Tại Sao Lớp Electron Ngoài Cùng Quyết Định Tính Chất Hóa Học?
Lớp electron ngoài cùng quyết định tính chất hóa học vì nó chứa các electron hóa trị, là các electron tham gia vào quá trình hình thành liên kết hóa học. Số lượng và cách sắp xếp của các electron này xác định khả năng của nguyên tử tương tác với các nguyên tử khác.
7.2. Làm Thế Nào Để Xác Định Số Electron Hóa Trị?
Số electron hóa trị được xác định bằng số electron ở lớp electron ngoài cùng. Để xác định số electron này, bạn cần viết cấu hình electron của nguyên tử và xác định lớp có số thứ tự lớn nhất.
7.3. Quy Tắc Octet Là Gì?
Quy tắc octet nói rằng các nguyên tử có xu hướng đạt cấu hình electron bền vững với 8 electron ở lớp ngoài cùng (tương tự như cấu hình của các khí hiếm). Các nguyên tử có thể đạt được cấu hình này bằng cách nhường, nhận hoặc chia sẻ electron với các nguyên tử khác.
7.4. Lớp Electron Ngoài Cùng Có Liên Quan Gì Đến Bảng Tuần Hoàn?
Bảng tuần hoàn được sắp xếp dựa trên cấu hình electron của các nguyên tố. Các nguyên tố trong cùng một nhóm có cùng số electron hóa trị và do đó có tính chất hóa học tương tự nhau.
7.5. Độ Âm Điện Ảnh Hưởng Đến Lớp Electron Ngoài Cùng Như Thế Nào?
Độ âm điện là khả năng của một nguyên tử hút electron về phía mình trong một liên kết hóa học. Các nguyên tố có độ âm điện cao có xu hướng hút electron từ các nguyên tử khác, làm thay đổi cấu hình electron của lớp ngoài cùng và ảnh hưởng đến tính chất hóa học của chúng.
7.6. Năng Lượng Ion Hóa Là Gì Và Tại Sao Nó Quan Trọng?
Năng lượng ion hóa là năng lượng cần thiết để loại bỏ một electron từ một nguyên tử ở trạng thái khí. Năng lượng ion hóa thấp cho thấy nguyên tử dễ dàng mất electron, trong khi năng lượng ion hóa cao cho thấy nguyên tử khó mất electron.
7.7. Ái Lực Electron Là Gì Và Nó Ảnh Hưởng Đến Tính Chất Hóa Học Như Thế Nào?
Ái lực electron là sự thay đổi năng lượng khi một nguyên tử nhận thêm một electron. Ái lực electron cao cho thấy nguyên tử dễ dàng nhận electron, trong khi ái lực electron thấp cho thấy nguyên tử khó nhận electron.
7.8. Liên Kết Cộng Hóa Trị Được Hình Thành Như Thế Nào?
Liên kết cộng hóa trị được hình thành khi các nguyên tử chia sẻ electron để đạt cấu hình bền vững. Các electron được chia sẻ nằm trong vùng không gian giữa các nguyên tử và tạo ra lực hút giữ các nguyên tử lại với nhau.
7.9. Liên Kết Ion Được Hình Thành Như Thế Nào?
Liên kết ion được hình thành khi một nguyên tử nhường electron cho một nguyên tử khác, tạo thành các ion trái dấu hút nhau. Lực hút tĩnh điện giữa các ion này tạo ra liên kết ion.
7.10. Tại Sao Hiểu Biết Về Lớp Electron Ngoài Cùng Lại Quan Trọng Trong Công Nghệ?
Hiểu biết về lớp electron ngoài cùng giúp chúng ta thiết kế và phát triển các vật liệu và thiết bị công nghệ tiên tiến. Ví dụ, nó giúp chúng ta tạo ra các chất bán dẫn, pin mặt trời và các vật liệu có tính chất đặc biệt khác.
Kết Luận
Lớp electron ngoài cùng là yếu tố then chốt quyết định tính chất hóa học của một nguyên tố. Hiểu rõ về cấu hình electron và lớp electron ngoài cùng giúp chúng ta dự đoán, giải thích và ứng dụng các tính chất của nguyên tố vào nhiều lĩnh vực khác nhau. Xe Tải Mỹ Đình hy vọng rằng bài viết này đã cung cấp cho bạn những kiến thức hữu ích và cái nhìn sâu sắc hơn về vai trò quan trọng của lớp electron ngoài cùng.
Bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải ở Mỹ Đình? Bạn muốn được tư vấn lựa chọn xe phù hợp với nhu cầu và ngân sách của mình? Hãy truy cập ngay XETAIMYDINH.EDU.VN để được giải đáp mọi thắc mắc và nhận sự hỗ trợ tốt nhất từ đội ngũ chuyên gia của chúng tôi. Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội. Hotline: 0247 309 9988.
