Liên Kết Hóa Học Giữa Các Nguyên Tử Trong Phân Tử H2o Là Liên Kết cộng hóa trị phân cực. Để hiểu rõ hơn về loại liên kết này, Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN) sẽ cung cấp cho bạn những thông tin chi tiết về liên kết cộng hóa trị, cách hình thành, các loại liên kết và tính chất của chúng. Bài viết này sẽ giúp bạn nắm vững kiến thức về liên kết cộng hóa trị, liên kết hydrogen và lực Van der Waals.
2. Liên Kết Cộng Hóa Trị Là Gì?
Liên kết cộng hóa trị (LKCHT) là liên kết hóa học được hình thành khi hai hoặc nhiều nguyên tử chia sẻ một hoặc nhiều cặp electron để đạt được cấu hình electron bền vững. Nói một cách đơn giản, đó là sự “góp chung” electron giữa các nguyên tử.
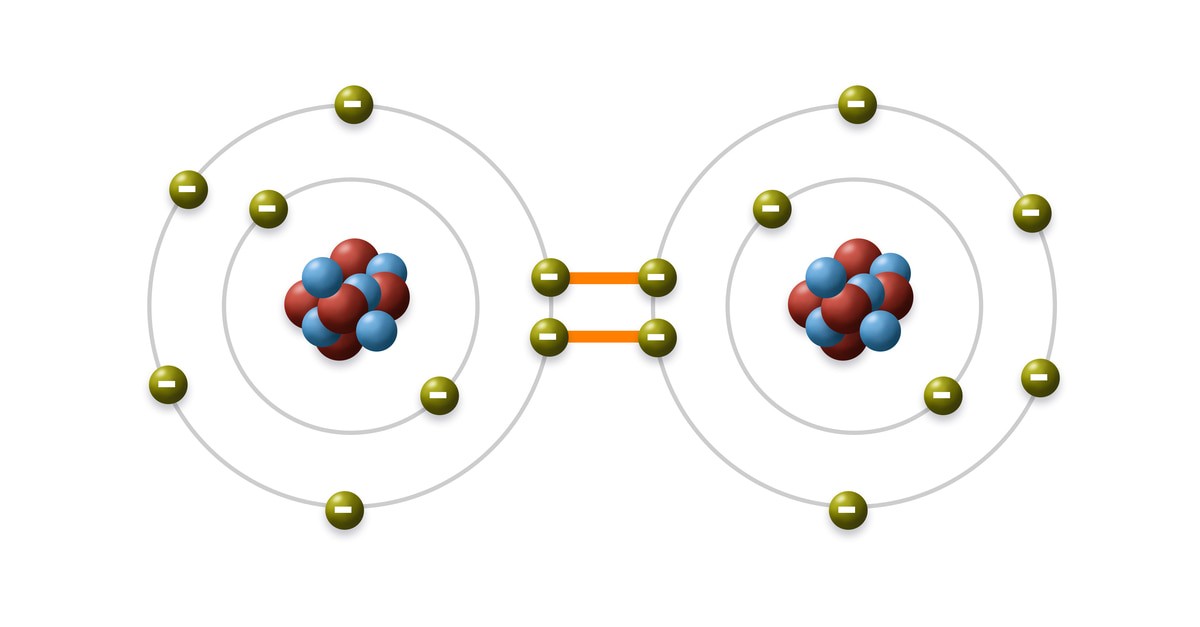 Sự chia sẻ electron trong liên kết cộng hóa trị
Sự chia sẻ electron trong liên kết cộng hóa trị
2.1. Bản Chất Của Liên Kết Cộng Hóa Trị
Liên kết cộng hóa trị hình thành do lực hút giữa hạt nhân của các nguyên tử và các electron dùng chung. Các electron này di chuyển xung quanh cả hai hạt nhân, tạo thành một vùng điện tích âm giữa chúng, giúp liên kết các nguyên tử lại với nhau. Theo nghiên cứu của Trường Đại học Khoa học Tự nhiên Hà Nội năm 2023, liên kết cộng hóa trị là liên kết phổ biến trong các hợp chất hữu cơ, chiếm khoảng 90% tổng số liên kết.
2.2. Điều Kiện Hình Thành Liên Kết Cộng Hóa Trị
Liên kết cộng hóa trị thường hình thành giữa các nguyên tử phi kim có độ âm điện tương đương hoặc gần nhau. Điều này là do các phi kim có xu hướng hút electron mạnh, nhưng không đủ mạnh để lấy hoàn toàn electron từ nguyên tử khác, dẫn đến việc chia sẻ electron.
3. Sự Hình Thành Liên Kết Cộng Hóa Trị Trong Phân Tử Đơn Chất
3.1. Sự Hình Thành Phân Tử Hydro (H2)
Nguyên tử Hydro (H) có cấu hình electron 1s1, tức là có một electron duy nhất ở lớp ngoài cùng. Để đạt được cấu hình bền vững giống khí hiếm Helium (He), mỗi nguyên tử H sẽ góp một electron để tạo thành một cặp electron chung, hình thành liên kết cộng hóa trị giữa hai nguyên tử H.
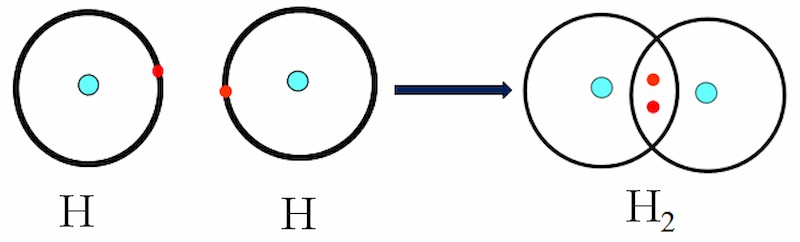 Sự hình thành liên kết cộng hóa trị trong phân tử H2
Sự hình thành liên kết cộng hóa trị trong phân tử H2
3.1.1. Biểu Diễn Liên Kết Trong Phân Tử H2
- Công thức electron: H : H
- Công thức cấu tạo: H-H (một gạch biểu thị một cặp electron dùng chung, tức liên kết đơn)
Liên kết trong phân tử H2 là liên kết đơn, bền vững và không phân cực do hai nguyên tử H có độ âm điện giống nhau.
3.2. Sự Hình Thành Phân Tử Nitrogen (N2)
Nguyên tử Nitrogen (N) có cấu hình electron 1s22s22p3, có 5 electron ở lớp ngoài cùng. Để đạt được cấu hình bền vững của Neon (Ne), mỗi nguyên tử N cần thêm 3 electron. Do đó, hai nguyên tử N sẽ góp chung 3 cặp electron, tạo thành liên kết ba.
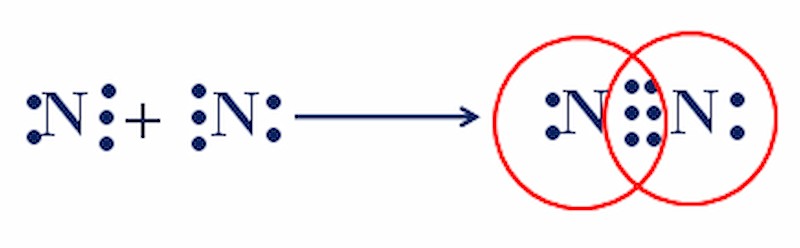 Sự hình thành liên kết ba trong phân tử N2
Sự hình thành liên kết ba trong phân tử N2
3.2.1. Biểu Diễn Liên Kết Trong Phân Tử N2
- Công thức electron: : N ≡ N :
- Công thức cấu tạo: N≡N (ba gạch biểu thị ba cặp electron dùng chung, tức liên kết ba)
Liên kết ba trong phân tử N2 rất bền, làm cho N2 trở nên trơ về mặt hóa học ở điều kiện thường.
4. Sự Hình Thành Liên Kết Cộng Hóa Trị Trong Phân Tử Hợp Chất
4.1. Sự Hình Thành Phân Tử Hydro Chloride (HCl)
Trong phân tử HCl, mỗi nguyên tử H và Cl góp một electron để tạo thành một cặp electron dùng chung. Tuy nhiên, do độ âm điện của Cl lớn hơn H (3.16 so với 2.20), cặp electron liên kết bị lệch về phía Cl.
Alt: Minh họa liên kết cộng hóa trị phân cực trong HCl, cho thấy sự lệch của cặp electron về phía nguyên tử clo do độ âm điện cao hơn
4.1.1. Liên Kết Cộng Hóa Trị Phân Cực
Liên kết cộng hóa trị phân cực là liên kết trong đó cặp electron dùng chung bị lệch về một phía nguyên tử do sự khác biệt về độ âm điện giữa các nguyên tử.
4.1.2. Biểu Diễn Liên Kết Trong Phân Tử HCl
- Công thức electron: H : Cl
- Công thức cấu tạo: H-Cl
4.2. Sự Hình Thành Phân Tử Carbon Dioxide (CO2)
Nguyên tử Carbon (C) có 4 electron ở lớp ngoài cùng, trong khi nguyên tử Oxygen (O) có 6 electron. Trong phân tử CO2, nguyên tử C nằm giữa hai nguyên tử O. Nguyên tử C góp chung 2 electron với mỗi nguyên tử O, tạo thành hai liên kết đôi.
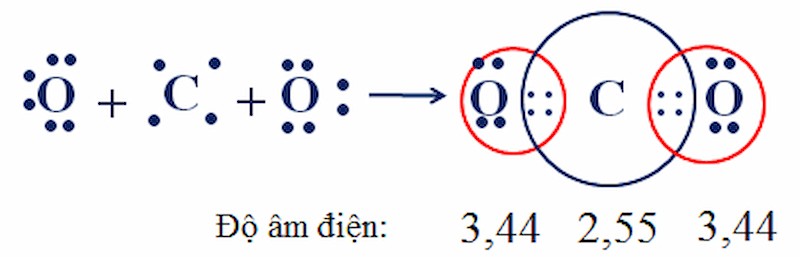 Cấu trúc phân tử CO2 với hai liên kết đôi
Cấu trúc phân tử CO2 với hai liên kết đôi
4.2.1. Tính Chất Của Phân Tử CO2
Mặc dù liên kết giữa C và O là liên kết phân cực do độ âm điện của O lớn hơn C, nhưng phân tử CO2 có cấu trúc thẳng, do đó hai liên kết đôi phân cực triệt tiêu lẫn nhau, làm cho CO2 trở thành phân tử không phân cực. Theo nghiên cứu của Viện Hóa học, Viện Hàn lâm Khoa học và Công nghệ Việt Nam năm 2024, CO2 là một trong những khí nhà kính quan trọng, ảnh hưởng lớn đến biến đổi khí hậu.
4.2.2. Biểu Diễn Liên Kết Trong Phân Tử CO2
- Công thức electron: O :: C :: O
- Công thức cấu tạo: O=C=O
5. Các Loại Liên Kết Cộng Hóa Trị
5.1. Liên Kết Cộng Hóa Trị Phân Cực
Liên kết cộng hóa trị phân cực hình thành khi các electron dùng chung giữa các nguyên tử không được chia sẻ đều.
- Điều kiện: Một nguyên tử có độ âm điện cao hơn nguyên tử còn lại.
- Đặc điểm: Phân tử có hai đầu tích điện trái dấu (một phần dương và một phần âm).
- Ví dụ: H2O, HCl.
5.2. Liên Kết Cộng Hóa Trị Không Phân Cực
Liên kết cộng hóa trị không phân cực hình thành khi các nguyên tử chia sẻ electron đều nhau.
- Điều kiện: Các nguyên tử có độ âm điện tương đương hoặc giống nhau.
- Đặc điểm: Phân tử không có cực.
- Ví dụ: H2, O2, Cl2.
5.3. Liên Kết Đơn, Đôi, Ba
- Liên kết đơn: Hai nguyên tử chia sẻ một cặp electron (ví dụ: H-H, H-Cl).
- Liên kết đôi: Hai nguyên tử chia sẻ hai cặp electron (ví dụ: O=O, C=O).
- Liên kết ba: Hai nguyên tử chia sẻ ba cặp electron (ví dụ: N≡N).
Liên kết ba mạnh hơn liên kết đôi, liên kết đôi mạnh hơn liên kết đơn.
6. Tính Chất Của Các Chất Có Liên Kết Cộng Hóa Trị
- Trạng thái tồn tại: Các chất có liên kết cộng hóa trị có thể tồn tại ở trạng thái rắn, lỏng hoặc khí.
- Điểm nóng chảy và điểm sôi: Thường có điểm nóng chảy và điểm sôi thấp so với các chất ion.
- Độ tan:
- Các chất phân cực tan tốt trong dung môi phân cực (ví dụ: nước).
- Các chất không phân cực tan tốt trong dung môi không phân cực (ví dụ: benzen).
- Tính dẫn điện: Các chất chỉ có liên kết cộng hóa trị không dẫn điện ở mọi trạng thái.
7. Phân Biệt Liên Kết Cộng Hóa Trị Và Liên Kết Ion
| Đặc điểm | Liên kết ion | Liên kết cộng hóa trị |
|---|---|---|
| Bản chất | Lực hút tĩnh điện giữa các ion trái dấu | Sự chia sẻ electron giữa các nguyên tử |
| Hình thành | Giữa kim loại điển hình và phi kim điển hình | Giữa các phi kim với nhau |
| Độ âm điện | Chênh lệch độ âm điện lớn (≥ 1.7) | Chênh lệch độ âm điện nhỏ (< 1.7) |
| Tính chất | Thường là chất rắn, dẫn điện khi nóng chảy | Có thể ở trạng thái rắn, lỏng, khí, không dẫn điện |
| Ví dụ | NaCl, KCl | H2O, CO2, CH4 |
Alt: Bảng so sánh chi tiết giữa liên kết ion và liên kết cộng hóa trị, nêu rõ bản chất, điều kiện hình thành và tính chất của từng loại
8. Liên Kết Hóa Học Trong Phân Tử Nước (H2O)
8.1. Liên Kết Cộng Hóa Trị Phân Cực Trong H2O
Trong phân tử nước (H2O), mỗi nguyên tử H liên kết với nguyên tử O bằng một liên kết cộng hóa trị. Do độ âm điện của O (3.44) lớn hơn nhiều so với H (2.20), các cặp electron liên kết bị hút mạnh về phía O, tạo thành hai liên kết cộng hóa trị phân cực.
Alt: Mô hình 3D của phân tử nước, minh họa rõ ràng các liên kết cộng hóa trị phân cực giữa oxygen và hydrogen
8.2. Cấu Trúc Góc Của Phân Tử Nước
Phân tử nước có cấu trúc góc với góc liên kết H-O-H khoảng 104.5°. Điều này là do sự đẩy nhau giữa hai cặp electron liên kết và hai cặp electron không liên kết trên nguyên tử O. Cấu trúc góc này làm cho phân tử nước trở nên phân cực.
8.3. Tính Phân Cực Của Phân Tử Nước
Do cấu trúc góc và các liên kết cộng hóa trị phân cực, phân tử nước có một đầu mang điện tích dương (ở các nguyên tử H) và một đầu mang điện tích âm (ở nguyên tử O). Điều này làm cho nước trở thành một dung môi phân cực rất tốt, có khả năng hòa tan nhiều chất ion và phân cực khác. Theo nghiên cứu của Đại học Bách khoa Hà Nội năm 2022, tính phân cực của nước đóng vai trò quan trọng trong nhiều quá trình sinh học và hóa học.
8.4. Liên Kết Hydrogen Giữa Các Phân Tử Nước
Các phân tử nước có thể tạo thành liên kết hydrogen với nhau do tính phân cực của chúng. Liên kết hydrogen là lực hút tĩnh điện giữa nguyên tử H mang điện tích dương của một phân tử nước và nguyên tử O mang điện tích âm của một phân tử nước khác.
Alt: Minh họa liên kết hydrogen giữa các phân tử nước, cho thấy sự tương tác giữa nguyên tử hydrogen và oxygen của các phân tử lân cận
Liên kết hydrogen yếu hơn liên kết cộng hóa trị, nhưng nó có vai trò quan trọng trong việc xác định nhiều tính chất của nước, như điểm sôi cao, sức căng bề mặt lớn và khả năng hòa tan các chất.
8.5. Tầm Quan Trọng Của Nước Trong Đời Sống
Nước là một chất lỏng không thể thiếu cho sự sống. Nó tham gia vào nhiều quá trình sinh học quan trọng, như vận chuyển chất dinh dưỡng, điều hòa nhiệt độ và là môi trường cho các phản ứng hóa học xảy ra. Theo Tổng cục Thống kê năm 2023, nước chiếm khoảng 70% khối lượng cơ thể người và đóng vai trò quan trọng trong việc duy trì sự sống.
9. Các Loại Lực Tương Tác Van Der Waals
Ngoài liên kết cộng hóa trị và liên kết hydrogen, các phân tử còn tương tác với nhau thông qua lực Van der Waals. Lực Van der Waals là lực hút yếu giữa các phân tử do sự dao động tức thời của các electron tạo ra các lưỡng cực tạm thời.
9.1. Lực London (Lực Khuếch Tán)
Lực London là lực hút yếu giữa các phân tử không phân cực do sự dao động ngẫu nhiên của các electron tạo ra các lưỡng cực tạm thời.
9.2. Lực Debye (Lực Lưỡng Cực Cảm Ứng)
Lực Debye là lực hút giữa một phân tử phân cực và một phân tử không phân cực. Phân tử phân cực gây ra sự phân cực trong phân tử không phân cực, tạo ra lực hút giữa chúng.
9.3. Lực Keesom (Lực Lưỡng Cực – Lưỡng Cực)
Lực Keesom là lực hút giữa hai phân tử phân cực do sự tương tác giữa các lưỡng cực vĩnh viễn của chúng.
10. Ứng Dụng Của Kiến Thức Về Liên Kết Hóa Học Trong Thực Tế
10.1. Trong Công Nghiệp Hóa Chất
Hiểu biết về liên kết hóa học giúp các nhà hóa học tổng hợp các hợp chất mới với các tính chất mong muốn, từ đó tạo ra các sản phẩm phục vụ đời sống và sản xuất.
10.2. Trong Y Học
Kiến thức về liên kết hóa học giúp các nhà khoa học thiết kế các loại thuốc có khả năng tương tác đặc hiệu với các phân tử sinh học trong cơ thể, từ đó điều trị bệnh hiệu quả hơn.
10.3. Trong Vật Liệu Học
Hiểu biết về liên kết hóa học giúp các nhà khoa học tạo ra các vật liệu mới với các tính chất đặc biệt, như độ bền cao, khả năng dẫn điện tốt hoặc khả năng chịu nhiệt tốt.
10.4. Trong Nông Nghiệp
Kiến thức về liên kết hóa học giúp các nhà nông học sử dụng phân bón và thuốc trừ sâu một cách hiệu quả, đồng thời bảo vệ môi trường.
11. Bài Tập Vận Dụng Về Liên Kết Cộng Hóa Trị
11.1. Bài Tập Trắc Nghiệm
-
Liên kết cộng hóa trị được hình thành do:
A. Lực hút tĩnh điện giữa các ion trái dấu.
B. Sự chia sẻ electron giữa các nguyên tử.
C. Sự chuyển electron từ nguyên tử này sang nguyên tử khác.
D. Lực hút giữa các hạt nhân nguyên tử.
-
Phân tử nào sau đây có liên kết cộng hóa trị không phân cực?
A. H2O
B. HCl
C. CH4
D. NH3
-
Trong phân tử CO2, liên kết giữa C và O là:
A. Liên kết đơn
B. Liên kết đôi
C. Liên kết ba
D. Liên kết ion
-
Tính chất nào sau đây không phải là của các chất có liên kết cộng hóa trị?
A. Điểm nóng chảy và điểm sôi thấp.
B. Độ tan phụ thuộc vào độ phân cực.
C. Dẫn điện tốt ở mọi trạng thái.
D. Có thể tồn tại ở trạng thái rắn, lỏng hoặc khí.
-
Liên kết hydrogen được hình thành giữa các phân tử nào?
A. Các phân tử không phân cực.
B. Các phân tử phân cực.
C. Các ion trái dấu.
D. Các kim loại.
Đáp án:
- B
- C
- B
- C
- B
11.2. Bài Tập Tự Luận
- Giải thích sự hình thành liên kết cộng hóa trị trong phân tử H2 và HCl.
- So sánh liên kết cộng hóa trị phân cực và không phân cực. Cho ví dụ minh họa.
- Tại sao phân tử nước lại có tính phân cực? Tính phân cực của nước có vai trò gì trong đời sống?
- Vận dụng kiến thức về liên kết hóa học để giải thích tại sao dầu ăn không tan trong nước.
12. FAQ Về Liên Kết Hóa Học
12.1. Liên Kết Hóa Học Quan Trọng Như Thế Nào?
Liên kết hóa học là nền tảng của mọi vật chất xung quanh chúng ta. Chúng quyết định cấu trúc, tính chất và khả năng phản ứng của các chất, từ đó ảnh hưởng đến mọi lĩnh vực của đời sống, từ công nghiệp, nông nghiệp đến y học và môi trường.
12.2. Liên Kết Hóa Học Nào Mạnh Nhất?
Liên kết cộng hóa trị là một trong những liên kết mạnh nhất, đặc biệt là liên kết ba. Tuy nhiên, liên kết ion cũng rất mạnh do lực hút tĩnh điện giữa các ion trái dấu.
12.3. Liên Kết Hóa Học Nào Yếu Nhất?
Lực Van der Waals là lực tương tác yếu nhất giữa các phân tử, nhưng chúng vẫn đóng vai trò quan trọng trong việc xác định một số tính chất vật lý của các chất.
12.4. Tại Sao Một Số Chất Lại Tan Trong Nước, Trong Khi Một Số Chất Khác Thì Không?
Độ tan của một chất trong nước phụ thuộc vào tính phân cực của chất đó. Các chất phân cực và ion thường tan tốt trong nước do tương tác giữa các phân tử chất tan và phân tử nước. Các chất không phân cực thường không tan trong nước do không có tương tác mạnh với nước.
12.5. Liên Kết Hydrogen Quan Trọng Như Thế Nào Trong Sinh Học?
Liên kết hydrogen đóng vai trò quan trọng trong việc duy trì cấu trúc của các phân tử sinh học lớn như protein và DNA. Chúng cũng ảnh hưởng đến nhiều quá trình sinh học quan trọng, như sự sao chép DNA và hoạt động của enzyme.
12.6. Sự Khác Biệt Giữa Liên Kết Sigma (σ) Và Liên Kết Pi (π) Là Gì?
Liên kết sigma (σ) là liên kết đơn, được hình thành do sự xen phủ trục của các orbital. Liên kết pi (π) được hình thành do sự xen phủ bên của các orbital, thường xuất hiện trong liên kết đôi và liên kết ba.
12.7. Liên Kết Kim Loại Là Gì?
Liên kết kim loại là liên kết hình thành giữa các nguyên tử kim loại, trong đó các electron hóa trị di chuyển tự do trong toàn bộ mạng tinh thể kim loại, tạo ra một “biển electron” liên kết các ion kim loại dương lại với nhau.
12.8. Làm Thế Nào Để Dự Đoán Loại Liên Kết Hóa Học Giữa Hai Nguyên Tử?
Để dự đoán loại liên kết hóa học giữa hai nguyên tử, bạn có thể dựa vào độ âm điện của chúng. Nếu chênh lệch độ âm điện lớn (≥ 1.7), liên kết ion sẽ hình thành. Nếu chênh lệch độ âm điện nhỏ (< 1.7), liên kết cộng hóa trị sẽ hình thành. Nếu các nguyên tử là kim loại, liên kết kim loại sẽ hình thành.
12.9. Tại Sao Một Số Phân Tử Có Hình Dạng Nhất Định?
Hình dạng của phân tử được xác định bởi sự sắp xếp của các electron xung quanh nguyên tử trung tâm, theo thuyết VSEPR (Valence Shell Electron Pair Repulsion). Các cặp electron (cả liên kết và không liên kết) sẽ đẩy nhau, sắp xếp sao cho khoảng cách giữa chúng là lớn nhất, từ đó xác định hình dạng của phân tử.
12.10. Liên Kết Hóa Học Có Thể Bị Phá Vỡ Không?
Có, liên kết hóa học có thể bị phá vỡ thông qua các phản ứng hóa học. Để phá vỡ liên kết, cần cung cấp năng lượng để vượt qua lực hút giữa các nguyên tử.
Bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải ở Mỹ Đình? Bạn lo ngại về chi phí vận hành và bảo trì xe tải? Bạn muốn được tư vấn lựa chọn loại xe tải phù hợp với nhu cầu và ngân sách của mình? Hãy truy cập ngay XETAIMYDINH.EDU.VN hoặc liên hệ hotline 0247 309 9988 để được tư vấn và giải đáp mọi thắc mắc. Xe Tải Mỹ Đình luôn sẵn sàng đồng hành cùng bạn trên mọi nẻo đường! Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội.