Kí Hiệu Nguyên Tử Khối là một khái niệm quan trọng trong hóa học, biểu thị khối lượng của một nguyên tử. Hãy cùng Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN) tìm hiểu sâu hơn về định nghĩa, cách tính và ứng dụng của nó, giúp bạn nắm vững kiến thức và giải quyết các bài tập liên quan một cách dễ dàng. Bài viết này sẽ cung cấp cho bạn những thông tin chi tiết về khối lượng nguyên tử, đơn vị đo và bảng nguyên tử khối đầy đủ nhất.
1. Nguyên Tử Khối Là Gì?
1.1. Định Nghĩa Nguyên Tử Khối
Nguyên tử khối là khối lượng tương đối của một nguyên tử, được tính bằng đơn vị khối lượng nguyên tử (amu) hoặc đơn vị Dalton (Da). Theo định nghĩa của IUPAC, một amu (hoặc Da) bằng 1/12 khối lượng của một nguyên tử carbon-12 ở trạng thái cơ bản.
 khối lượng của một nguyên tử được tính bằng đvC
khối lượng của một nguyên tử được tính bằng đvC
Khối lượng nguyên tử chủ yếu tập trung ở hạt nhân, bao gồm proton và neutron, trong khi electron có khối lượng rất nhỏ không đáng kể. Do đó, khối lượng nguyên tử xấp xỉ bằng tổng số proton và neutron trong hạt nhân. Ví dụ, nguyên tử khối của bạc (Ag) là 108 amu và của magie (Mg) là 24 amu.
1.2. Đơn Vị Đo Nguyên Tử Khối
Đơn vị đo nguyên tử khối là amu (atomic mass unit) hoặc Da (Dalton). Một amu (hoặc Da) được định nghĩa là 1/12 khối lượng của một nguyên tử carbon-12. Theo Viện Tiêu chuẩn và Công nghệ Quốc gia Hoa Kỳ (NIST), 1 amu tương đương 1.66053906660(50) × 10−27 kg.
Việc sử dụng amu giúp biểu diễn khối lượng nguyên tử một cách thuận tiện hơn so với việc sử dụng gram (g), vì khối lượng của một nguyên tử là vô cùng nhỏ bé. Ví dụ, khối lượng của một nguyên tử carbon-12 là khoảng 1.9926 x 10^-23 g, nhưng khi sử dụng đơn vị amu, nó chỉ là 12 amu.
1.3. Nguyên Tử Khối Trung Bình
Nguyên tử khối trung bình là giá trị trung bình của khối lượng nguyên tử của tất cả các đồng vị của một nguyên tố, có xét đến tỷ lệ phần trăm của mỗi đồng vị trong tự nhiên. Hầu hết các nguyên tố hóa học tồn tại dưới dạng hỗn hợp của nhiều đồng vị với tỷ lệ khác nhau. Theo số liệu từ Hiệp hội Hóa học Hoàng gia Anh (RSC), công thức tính nguyên tử khối trung bình như sau:
Atb = (a1*A1 + a2*A2 + ... + an*An) / 100Trong đó:
- Atb là nguyên tử khối trung bình của nguyên tố.
- a1, a2, …, an là tỷ lệ phần trăm số nguyên tử của các đồng vị tương ứng.
- A1, A2, …, An là nguyên tử khối của các đồng vị.
Ví dụ, clo có hai đồng vị là Cl-35 (chiếm 75.77%) và Cl-37 (chiếm 24.23%). Nguyên tử khối trung bình của clo là:
Atb = (75.77 * 35 + 24.23 * 37) / 100 = 35.4846 amu2. Phân Tử Khối Là Gì?
Phân tử khối là tổng khối lượng của tất cả các nguyên tử có trong một phân tử, được tính bằng đơn vị amu (hoặc Da). Để tính phân tử khối, chúng ta cần biết công thức hóa học của phân tử và nguyên tử khối của từng nguyên tố có trong phân tử đó.
Ví dụ, phân tử nước (H2O) có hai nguyên tử hydro (H) và một nguyên tử oxy (O). Nguyên tử khối của H là 1 amu và của O là 16 amu. Vậy phân tử khối của H2O là:
Phân tử khối (H2O) = 2 * 1 + 16 = 18 amuTương tự, phân tử khối của khí carbonic (CO2) là:
Phân tử khối (CO2) = 12 + 2 * 16 = 44 amu3. Bảng Nguyên Tử Khối Chi Tiết Của Các Nguyên Tố
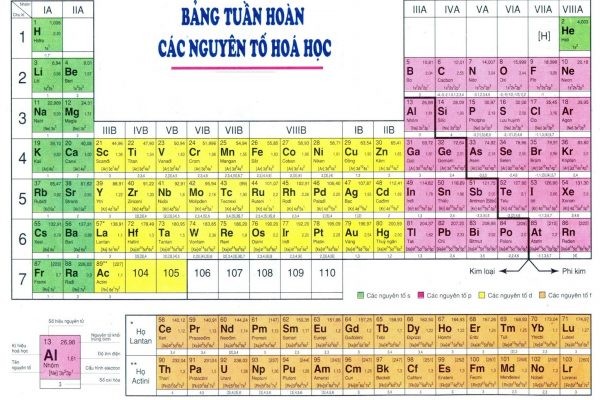
Để giúp bạn dễ dàng tra cứu và tổng hợp kiến thức, Xe Tải Mỹ Đình xin chia sẻ bảng nguyên tử khối chi tiết của các nguyên tố hóa học. Dưới đây là bảng tổng hợp các nguyên tố thường gặp, cùng với kí hiệu hóa học và nguyên tử khối tương ứng:
| STT | Tên nguyên tố | Kí hiệu hóa học | Nguyên tử khối |
|---|---|---|---|
| 1 | Hydro | H | 1 |
| 2 | Heli | He | 4 |
| 3 | Liti | Li | 7 |
| 4 | Beri | Be | 9 |
| 5 | Bo | B | 11 |
| 6 | Cacbon | C | 12 |
| 7 | Nitơ | N | 14 |
| 8 | Oxi | O | 16 |
| 9 | Flo | F | 19 |
| 10 | Neon | Ne | 20 |
| 11 | Natri | Na | 23 |
| 12 | Magie | Mg | 24 |
| 13 | Nhôm | Al | 27 |
| 14 | Silic | Si | 28 |
| 15 | Photpho | P | 31 |
| 16 | Lưu huỳnh | S | 32 |
| 17 | Clo | Cl | 35.5 |
| 18 | Argon | Ar | 40 |
| 19 | Kali | K | 39 |
| 20 | Canxi | Ca | 40 |
| 21 | Crom | Cr | 52 |
| 22 | Mangan | Mn | 55 |
| 23 | Sắt | Fe | 56 |
| 24 | Đồng | Cu | 64 |
| 25 | Kẽm | Zn | 65 |
| 26 | Bạc | Ag | 108 |
| 27 | Iot | I | 127 |
| 28 | Vàng | Au | 197 |
| 29 | Thủy ngân | Hg | 201 |
| 30 | Chì | Pb | 207 |
Mặc dù có bảng nguyên tử khối, bạn nên cố gắng ghi nhớ nguyên tử khối của một số chất thường gặp như Na, Ba, Ca, H, O,… vì các hợp chất này thường xuyên xuất hiện trong bài tập. Điều này sẽ giúp bạn tiết kiệm thời gian tra cứu, tập trung vào việc tìm phương án giải bài tập. Theo kinh nghiệm của nhiều giáo viên, việc học thuộc bảng này giúp học sinh chủ động hơn trong quá trình làm bài kiểm tra và thi cử.
4. Cách Tính Khối Lượng Thực Của Nguyên Tử
Khối lượng nguyên tử tính bằng gam có giá trị rất nhỏ, gây khó khăn trong tính toán. Vì vậy, người ta quy ước lấy 1/12 khối lượng nguyên tử carbon-12 làm đơn vị khối lượng nguyên tử (amu). Tuy nhiên, việc tính khối lượng bằng gam của các nguyên tử vẫn có thể thực hiện được, và khối lượng tính bằng gam đó chính là khối lượng thực của nguyên tử.
Bước 1: Ghi nhớ cách quy đổi: 1 amu = 1.66053906660(50) × 10−24 g
Bước 2: Tra bảng để tìm nguyên tử khối của nguyên tố. Ví dụ, nguyên tố A có nguyên tử khối là a, tức A = a amu.
Bước 3: Tính khối lượng thực của nguyên tố A:
mA = a * 1.66053906660(50) × 10−24 gVí dụ, tính khối lượng thực của nguyên tử natri (Na):
- Nguyên tử khối của Na là 23 amu.
- Khối lượng thực của Na: mA = 23 * 1.66053906660(50) × 10−24 g = 3.81924 × 10−23 g.
5. Phương Pháp Học Thuộc Bảng Nguyên Tử Khối Siêu Dễ Nhớ
5.1. Học Thuộc Lòng Bằng Flashcards
Sử dụng flashcards là một phương pháp học tập rất hiệu quả. Bạn có thể ôn luyện hàng ngày và tăng thời gian cho việc học bằng cách sử dụng flashcards. Theo một nghiên cứu của Đại học California, San Diego, việc sử dụng flashcards giúp tăng khả năng ghi nhớ lên đến 30%.
 học bảng nguyên tử khối bằng flashcards
học bảng nguyên tử khối bằng flashcards
5.2. Bài Ca Nguyên Tử Khối
Một cách học khác là sử dụng thơ vè hoặc bài hát để ghi nhớ các nguyên tử khối. Dưới đây là một ví dụ:
“Hydro là một (1)
Mười hai (12) cột carbon
Nitơ mười bốn (14) tròn
Oxi mỏi mòn mười sáu (16)
Natri hay láu táu
Nhảy tót lên hai ba (23)
Khiến Magie gần nhà
Ngậm ngùi đành hai bốn (24)…”
6. Ứng Dụng Của Bảng Nguyên Tử Khối Trong Bài Tập Hóa Học
Bảng nguyên tử khối có tính ứng dụng rất cao trong môn hóa học, đặc biệt là phần kiến thức của hóa vô cơ. Hầu hết các bài tập hóa học đều phải sử dụng bảng này.
6.1. Tìm Nguyên Tố Trong Hợp Chất
Đây là một trong những dạng bài tập phổ biến nhất. Ví dụ: Hợp chất của kim loại A kết hợp với axit H2SO4 tạo ra muối có công thức A2SO4. Tổng phân tử khối của hợp chất này là 160 amu. Xác định nguyên tố A là gì.
Dựa vào bảng nguyên tử khối:
- Nguyên tử khối của S là 32 amu.
- Nguyên tử khối của O là 16 amu.
Theo công thức hợp chất trên, ta có: 2A + 32 + 16×4 = 160 => A = 32.
Vậy, nguyên tố A cần tìm là Lưu huỳnh (S).
6.2. Tìm Nguyên Tố Khi Biết Nguyên Tử Khối
Đối với các dạng bài tập đơn giản, bạn sẽ thường xuyên bắt gặp một số câu hỏi như xác định nguyên tố có nguyên tử khối gấp 2 lần so với oxy.
Để làm được bài tập này, bạn cần ghi nhớ nguyên tử khối của oxy là 16 amu. Nguyên tố với nguyên tử khối gấp 2 lần oxy có nguyên tử khối là 32 amu. Vậy nên ta có thể dễ dàng nhận ra đó là lưu huỳnh (S).
Các dạng bài tập được nêu ở trên là một trong những dạng đơn giản và cơ bản nhất của hóa học ở bậc trung học. Tuy nhiên, trước khi đi làm việc và tìm hiểu kỹ hơn về hóa học, bạn cũng cần phải ghi nhớ các kiến thức cơ bản nhất để có một khởi đầu suôn sẻ và một nền tảng thật vững chắc.
7. Bài Tập Luyện Tập Về Nguyên Tử Khối
Câu 1: Một nguyên tử nhôm (Al) chứa 13 proton, 13 electron và 14 neutron. Xác định khối lượng của một nguyên tử nhôm.
Lời giải:
- mp = 13 1.6726 10^-24 = 2.174 * 10^-23 g
- mn = 14 1.675 10^-24 = 2.345 * 10^-23 g
- me = 13 9.1 10^-28 = 0.01183 * 10^-24 g
=> Khối lượng 1 nguyên tử nhôm: mp + mn + me = 45.19 * 10^-24 g
Câu 2: So sánh nguyên tử magie và cacbon, nguyên tử nào nặng hay nhẹ hơn bao nhiêu lần?
Lời giải:
- Nguyên tử khối của Mg là 24 amu; nguyên tử khối của C là 12 amu.
- Nguyên tử Mg nặng hơn C và nặng 24/12 = 2 lần.
Câu 3: Vẽ cấu trúc của nguyên tử X, biết trong hạt nhân của nguyên tử X chứa 19 proton.
Lời giải:
Vì nguyên tử trung hòa về điện nên số e = số p = 19.
=> Lớp 1 có 2e, lớp 2 có 8e, lớp 3 có 8e và lớp 4 có 1e.
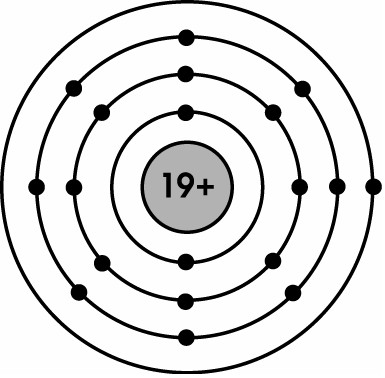 Hình minh họa bài tập về khối lượng nguyên tử
Hình minh họa bài tập về khối lượng nguyên tử
Câu 4: Nguyên tử X nặng gấp 4 lần nguyên tử nitơ. Tính nguyên tử khối của X và cho biết nó là nguyên tố nào?
Lời giải:
- Nguyên tử khối của Nitơ = 14 amu
- Nguyên tử khối của nguyên tố X = 4 * 14 = 56 amu
Vậy X là nguyên tố sắt (Fe).
Câu 5: Khối lượng tương đối của một phân tử H2O là bao nhiêu?
Lời giải:
Khối lượng tương đối của một phân tử H2O = MH2O = 2 * 1 + 16 = 18 amu.
Câu 6: Biết 4 nguyên tử Mg nặng bằng 3 nguyên tử của nguyên tố X. Vậy X là nguyên tố nào?
Lời giải:
24 amu là nguyên tử khối của Mg. Đặt nguyên tử khối của X là M.
Theo đề bài, ta có: 4 24 = 3 M => M = (4 * 24) / 3 = 32 amu
Vậy X chính là nguyên tố lưu huỳnh (S).
Câu 7: Một hợp chất được tạo thành bởi 2 nguyên tử Oxi liên kết với 1 nguyên tử X. Biết hợp chất này có phân tử khối nặng hơn phân tử hidro 22 lần.
a) Tìm phân tử khối hợp chất đó.
b) Tìm nguyên tử khối của X và từ đó cho biết tên nguyên tố và kí hiệu hóa học.
Lời giải:
Phân tử hidro có công thức hóa học là H2 => MH2 = 2 * 1 = 2 amu
Theo đề bài:
Hợp chất nặng hơn phân tử H 22 lần.
=> M = 2 * 22 = 44
1 nguyên tử X liên kết với 2 nguyên tử O tạo ra hợp chất (1X; 2O)
Nên ta có: M = X + 2 * 16 = X + 32
Mà bên trên chúng ta đã tìm được M = 44
=> X + 32 = 44
=> X = 44 – 32 = 12
Vậy X là nguyên tố cacbon (C)
Câu 8: Đồng có 2 đồng vị là 63Cu và 65Cu. Nguyên tử khối trung bình của Cu bằng 63.54. Thành phần phần trăm số nguyên tử của mỗi đồng vị bằng bao nhiêu?
Lời giải:
Đặt thành phần phần trăm của 63Cu là x (%)
Suy ra thành phần phần trăm của đồng vị 65Cu là 100 – x (%)
Ta có:
M = (63 x + 65 (100-x)) / 100 = 63.54
63x + 6500 – 65x = 6354
-2x = -146
x = 73 (%)
=> % 63Cu = 73% và % 65Cu = 27%
Câu 9: Trong tự nhiên, X có hai đồng vị 35X và 37X, chiếm lần lượt 75.77% và 24.23% số nguyên tử X. Y có hai đồng vị 1Y và 2Y, chiếm lần lượt 99.2% và 0.8% số nguyên tử Y.
a) Trong tự nhiên tồn tại bao nhiêu loại phân tử XY?
b) Phân tử khối trung bình của phân tử XY bằng bao nhiêu?
Lời giải:
a) Số loại phân tử XY có trong tự nhiên là: 35X – 1Y, 35X – 2Y, 37X – 1Y, 37X – 2Y
b) Nguyên tử khối TB của X là: (75.77 35 + 24.23 37) / 100 = 35.485
Nguyên tử khối TB của Y là: (99.2 1 + 0.8 2) / 100 = 1.008
Phân tử khối TB của XY: 35.485 + 1.008 = 36.493 ≈ 36.5
Câu 10: Nguyên tố Cl có 2 đồng vị bền trong tự nhiên bao gồm: 37Cl chiếm 24.23% tổng số nguyên tử, còn lại là 35Cl. Thành phần % theo KL của 37Cl trong HClO4 là bao nhiêu?
Lời giải:
Ta có: % 37Cl = 24.23% => % 35Cl = 100% – 24.23% = 75.77%
ACl = (37 24.23 + 35 75.77) / 100 = 35.4846
=> Phần trăm đồng vị 37Cl trong HClO4 là: (37 24.23) / (1 + 35.4846 + 16 4) * 100 = 8.92%
Kiến thức về nguyên tử khối sẽ luôn đi theo bạn, đòi hỏi bạn phải nhớ bảng nguyên tử khối và áp dụng nó vào các bài tập. Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN) đã giúp bạn học tốt hơn phần này bằng cách tổng hợp cô đọng lý thuyết và bài tập.
Nếu bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải ở Mỹ Đình, hãy truy cập XETAIMYDINH.EDU.VN ngay hôm nay. Chúng tôi cung cấp thông tin cập nhật, so sánh giá cả và thông số kỹ thuật giữa các dòng xe, cùng với dịch vụ tư vấn chuyên nghiệp để giúp bạn đưa ra quyết định tốt nhất.
Liên hệ ngay với Xe Tải Mỹ Đình để được tư vấn miễn phí:
- Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội
- Hotline: 0247 309 9988
- Trang web: XETAIMYDINH.EDU.VN
Hãy để Xe Tải Mỹ Đình đồng hành cùng bạn trên mọi nẻo đường!