Hợp chất vô cơ đóng vai trò quan trọng trong nhiều lĩnh vực của đời sống và công nghiệp. Bạn đang thắc mắc Hợp Chất Vô Cơ Là Gì, chúng được phân loại và ứng dụng ra sao? Bài viết này của XETAIMYDINH.EDU.VN sẽ cung cấp cho bạn cái nhìn tổng quan và chi tiết nhất về hợp chất vô cơ, từ định nghĩa, phân loại đến ứng dụng thực tiễn. Khám phá ngay để hiểu rõ hơn về thế giới hóa học vô cơ, từ đó mở rộng kiến thức về hóa học và ứng dụng của chúng trong thực tế, giúp bạn có cái nhìn sâu sắc hơn về thế giới xung quanh.
1. Hợp Chất Vô Cơ Là Gì? Định Nghĩa Chi Tiết Nhất
Hợp chất vô cơ là các hợp chất hóa học không chứa liên kết carbon-hydro (C-H) trong thành phần cấu tạo, ngoại trừ một số trường hợp đặc biệt. Nói một cách dễ hiểu, hợp chất vô cơ là những hợp chất hóa học không thuộc về “thế giới” của các hợp chất hữu cơ.
Vậy những trường hợp ngoại lệ đó là gì? Theo quy ước, một số hợp chất chứa carbon nhưng vẫn được xếp vào loại vô cơ, bao gồm:
- Các oxit của carbon: Carbon monoxide (CO) và carbon dioxide (CO2).
- Axit carbonic (H2CO3) và các muối của nó như carbonates (ví dụ: CaCO3) và bicarbonates (ví dụ: NaHCO3).
- Các carbides kim loại (ví dụ: CaC2).
- Một số hợp chất chứa cyanide (CN-).
Ví dụ về hợp chất vô cơ:
- Nước (H2O)
- Muối ăn (NaCl)
- Axit sulfuric (H2SO4)
- Ammonia (NH3)
- Calcium carbonate (CaCO3)
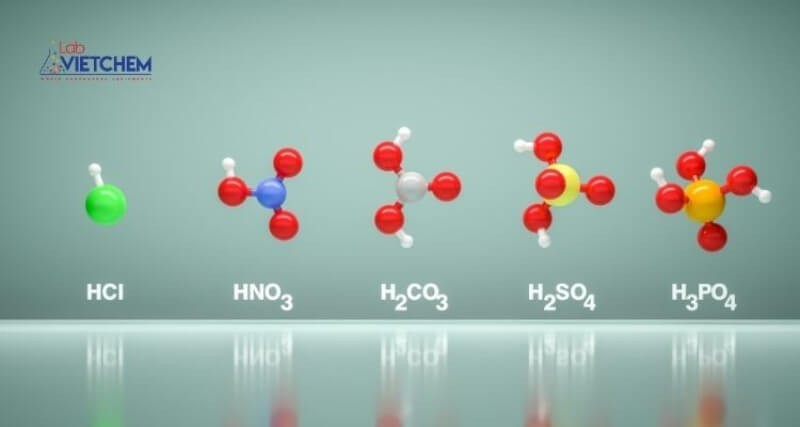 Hợp chất vô cơ là gì
Hợp chất vô cơ là gì
Hợp chất vô cơ có mặt ở khắp mọi nơi trong tự nhiên, từ khoáng chất trong lòng đất, các thành phần của nước biển đến các chất khí trong khí quyển. Chúng cũng được tổng hợp rộng rãi trong các phòng thí nghiệm, nhà máy hóa chất và được ứng dụng trong nhiều ngành công nghiệp khác nhau. Theo một nghiên cứu của trường Đại học Khoa học Tự nhiên Hà Nội năm 2024, hợp chất vô cơ đóng vai trò quan trọng trong sản xuất phân bón, vật liệu xây dựng và nhiều sản phẩm công nghiệp khác.
1.1. Sự Khác Biệt Giữa Hợp Chất Vô Cơ và Hữu Cơ
Sự khác biệt cơ bản giữa hợp chất vô cơ và hữu cơ nằm ở thành phần và cấu trúc phân tử:
| Đặc điểm | Hợp chất hữu cơ | Hợp chất vô cơ |
|---|---|---|
| Thành phần chính | Carbon (C) và hydro (H) | Các nguyên tố khác (kim loại, phi kim,…) |
| Liên kết | Chủ yếu là liên kết cộng hóa trị C-C và C-H | Liên kết ion hoặc cộng hóa trị |
| Độ bền nhiệt | Thường kém bền nhiệt, dễ bị phân hủy ở nhiệt độ cao | Thường bền nhiệt hơn, khó bị phân hủy ở nhiệt độ cao |
| Tính tan | Thường tan trong dung môi hữu cơ | Thường tan trong nước hoặc dung môi phân cực |
| Tính dẫn điện | Thường không dẫn điện | Có thể dẫn điện (ví dụ: dung dịch muối) |
| Tính cháy | Dễ cháy | Thường không cháy |
1.2. Vai Trò Quan Trọng Của Hợp Chất Vô Cơ Trong Đời Sống
Hợp chất vô cơ đóng vai trò vô cùng quan trọng trong nhiều khía cạnh của đời sống và sản xuất:
- Trong tự nhiên: Tham gia vào các quá trình địa chất, hình thành khoáng chất, cấu tạo nên đất đá, nước biển và khí quyển.
- Trong công nghiệp: Được sử dụng làm nguyên liệu để sản xuất phân bón, xi măng, thủy tinh, gốm sứ, kim loại, hóa chất, dược phẩm,…
- Trong nông nghiệp: Cung cấp các chất dinh dưỡng cần thiết cho cây trồng, giúp tăng năng suất và chất lượng nông sản.
- Trong y học: Được sử dụng làm thuốc chữa bệnh, chất khử trùng, chất bảo quản,…
- Trong đời sống hàng ngày: Có mặt trong các vật dụng gia đình, đồ dùng cá nhân, thực phẩm,…
2. Phân Loại Hợp Chất Vô Cơ Phổ Biến Nhất Hiện Nay
Các hợp chất vô cơ được phân loại dựa trên thành phần và tính chất hóa học của chúng. Dưới đây là các loại hợp chất vô cơ phổ biến nhất:
2.1. Oxit: Khái Niệm, Phân Loại và Ứng Dụng
Oxit là hợp chất hóa học được tạo thành từ hai nguyên tố, trong đó có một nguyên tố là oxy và nguyên tố còn lại thường là kim loại hoặc phi kim. Công thức tổng quát của oxit là MxOy, trong đó M là nguyên tố khác oxy, x và y là chỉ số biểu thị số lượng nguyên tử của mỗi nguyên tố.
Phân loại oxit:
- Oxit bazơ: Là oxit của kim loại, tác dụng với axit tạo thành muối và nước. Ví dụ: Na2O, CaO, MgO, Fe2O3,…
- Oxit axit: Là oxit của phi kim, tác dụng với bazơ tạo thành muối và nước. Ví dụ: CO2, SO2, P2O5, N2O5,…
- Oxit lưỡng tính: Là oxit vừa có tính axit, vừa có tính bazơ, có thể tác dụng với cả axit và bazơ. Ví dụ: Al2O3, ZnO, Cr2O3,…
- Oxit trung tính: Là oxit không tác dụng với cả axit và bazơ. Ví dụ: CO, NO, N2O,…
Ứng dụng của oxit:
- Sản xuất kim loại: Fe2O3 (quặng hematit) được dùng để sản xuất gang thép.
- Sản xuất vật liệu xây dựng: CaO (vôi sống) được dùng để sản xuất vữa xây dựng.
- Sản xuất phân bón: P2O5 (phosphor pentoxit) được dùng để sản xuất phân lân.
- Sản xuất hóa chất: SO2 (lưu huỳnh dioxit) được dùng để sản xuất axit sulfuric.
- Trong đời sống: H2O (nước) là chất lỏng không thể thiếu cho sự sống.
2.2. Axit: Định Nghĩa, Tính Chất và Ứng Dụng Thực Tế
Axit là hợp chất hóa học có khả năng cho proton (H+) hoặc nhận electron. Trong dung dịch nước, axit làm tăng nồng độ ion H+ và có pH nhỏ hơn 7. Công thức tổng quát của axit là HxA, trong đó A là gốc axit và x là hóa trị của gốc axit.
Tính chất của axit:
- Có vị chua (không nên nếm thử trừ khi được chỉ định).
- Làm đổi màu chất chỉ thị: làm quỳ tím hóa đỏ, phenolphtalein không màu vẫn giữ nguyên.
- Tác dụng với kim loại đứng trước hydro trong dãy hoạt động hóa học tạo thành muối và giải phóng khí hydro.
- Tác dụng với oxit bazơ tạo thành muối và nước.
- Tác dụng với bazơ tạo thành muối và nước (phản ứng trung hòa).
- Tác dụng với muối tạo thành muối mới và axit mới (điều kiện: sản phẩm phải có chất kết tủa hoặc chất khí).
Ứng dụng của axit:
- Sản xuất phân bón: H2SO4 (axit sulfuric) được dùng để sản xuất phân supe lân.
- Sản xuất hóa chất: HCl (axit clohydric) được dùng để sản xuất nhiều loại hóa chất khác nhau.
- Trong công nghiệp luyện kim: Axit được dùng để tẩy rửa kim loại, loại bỏ gỉ sét.
- Trong y học: HCl có trong dịch vị dạ dày giúp tiêu hóa thức ăn.
- Trong đời sống: CH3COOH (axit axetic) có trong giấm ăn.
2.3. Bazơ: Khái Niệm, Tính Chất Hóa Học và Ứng Dụng
Bazơ là hợp chất hóa học có khả năng nhận proton (H+) hoặc cho electron. Trong dung dịch nước, bazơ làm tăng nồng độ ion OH- và có pH lớn hơn 7. Công thức tổng quát của bazơ là M(OH)n, trong đó M là kim loại và n là hóa trị của kim loại.
Tính chất của bazơ:
- Có vị đắng (không nên nếm thử).
- Có tính nhờn, ăn mòn da.
- Làm đổi màu chất chỉ thị: làm quỳ tím hóa xanh, phenolphtalein không màu hóa hồng.
- Tác dụng với axit tạo thành muối và nước (phản ứng trung hòa).
- Tác dụng với oxit axit tạo thành muối và nước.
- Tác dụng với muối tạo thành bazơ mới và muối mới (điều kiện: sản phẩm phải có chất kết tủa hoặc chất khí).
Ứng dụng của bazơ:
- Sản xuất xà phòng: NaOH (natri hidroxit) được dùng để sản xuất xà phòng.
- Sản xuất giấy: NaOH được dùng trong quá trình sản xuất giấy.
- Sản xuất thuốc tẩy: Ca(OH)2 (canxi hidroxit) được dùng để sản xuất thuốc tẩy.
- Trong nông nghiệp: Ca(OH)2 được dùng để khử chua đất.
- Trong y học: Mg(OH)2 (magie hidroxit) được dùng làm thuốc chữa đau dạ dày.
 Ứng dụng của bazơ trong sản xuất xà phòng
Ứng dụng của bazơ trong sản xuất xà phòng
2.4. Muối: Khái Niệm, Phân Loại và Ứng Dụng Quan Trọng
Muối là hợp chất hóa học được tạo thành từ sự kết hợp giữa cation (ion dương) của kim loại hoặc gốc NH4+ và anion (ion âm) của gốc axit.
Phân loại muối:
- Muối trung hòa: Là muối mà trong phân tử không còn nguyên tử hydro có khả năng thay thế bằng kim loại hoặc gốc NH4+. Ví dụ: NaCl, K2SO4, CaCO3,…
- Muối axit: Là muối mà trong phân tử vẫn còn nguyên tử hydro có khả năng thay thế bằng kim loại hoặc gốc NH4+. Ví dụ: NaHCO3, NaHSO4, Ca(H2PO4)2,…
- Muối bazơ: Là muối mà trong phân tử vẫn còn nhóm OH-. Ví dụ: Cu(OH)Cl, Mg(OH)Cl,…
- Muối kép: Là muối được tạo thành từ hai muối khác nhau. Ví dụ: KAl(SO4)2,…
Ứng dụng của muối:
- Trong đời sống: NaCl (natri clorua) là muối ăn hàng ngày.
- Trong công nghiệp: CaCO3 (canxi cacbonat) được dùng để sản xuất xi măng, thủy tinh.
- Trong nông nghiệp: (NH4)2SO4 (amoni sunfat) được dùng làm phân đạm.
- Trong y học: NaHCO3 (natri bicacbonat) được dùng làm thuốc chữa đau dạ dày.
- Chất bảo quản thực phẩm: Muối được sử dụng để bảo quản thực phẩm.
3. Các Hợp Chất Vô Cơ Thường Gặp Trong Đời Sống
Hợp chất vô cơ có mặt ở khắp mọi nơi xung quanh chúng ta. Dưới đây là một số hợp chất vô cơ thường gặp và ứng dụng của chúng:
3.1. Các Axit Vô Cơ Quan Trọng và Ứng Dụng
| Axit | Công thức hóa học | Ứng dụng |
|---|---|---|
| Axit sulfuric | H2SO4 | Sản xuất phân bón, chất tẩy rửa, thuốc nhuộm, chất dẻo, xử lý nước thải, sản xuất kim loại |
| Axit clohydric | HCl | Sản xuất hóa chất, tẩy rửa kim loại, sản xuất dược phẩm, chế biến thực phẩm |
| Axit nitric | HNO3 | Sản xuất phân bón, thuốc nổ, chất dẻo, thuốc nhuộm, chất tẩy rửa kim loại |
| Axit photphoric | H3PO4 | Sản xuất phân bón, chất tẩy rửa, phụ gia thực phẩm, sản xuất dược phẩm |
| Axit cacbonic | H2CO3 | Sản xuất nước giải khát có gas, chất chữa cháy |
| Axit flohydric | HF | Khắc thủy tinh, sản xuất chất bán dẫn, chất tẩy rửa |
3.2. Các Bazơ Vô Cơ Thường Gặp và Ứng Dụng
| Bazơ | Công thức hóa học | Ứng dụng |
|---|---|---|
| Natri hidroxit | NaOH | Sản xuất xà phòng, giấy, chất tẩy rửa, xử lý nước thải, sản xuất hóa chất |
| Canxi hidroxit | Ca(OH)2 | Sản xuất vữa xây dựng, khử chua đất, xử lý nước thải, sản xuất giấy, chất khử trùng |
| Kali hidroxit | KOH | Sản xuất xà phòng lỏng, chất điện phân trong pin kiềm, sản xuất hóa chất |
| Amoni hidroxit | NH4OH | Sản xuất phân bón, chất tẩy rửa, sản xuất hóa chất |
| Magie hidroxit | Mg(OH)2 | Sản xuất thuốc chữa đau dạ dày, chất chống cháy, chất xử lý nước thải |
| Aluminium hidroxit | Al(OH)3 | Sản xuất chất keo tụ trong xử lý nước, chất độn trong sản xuất giấy, chất chống axit trong dược phẩm |
3.3. Các Muối Vô Cơ Phổ Biến và Ứng Dụng Đa Dạng
| Muối | Công thức hóa học | Ứng dụng |
|---|---|---|
| Natri clorua | NaCl | Muối ăn, chất bảo quản thực phẩm, sản xuất hóa chất (NaOH, Cl2, H2) |
| Canxi cacbonat | CaCO3 | Sản xuất xi măng, vôi, thủy tinh, chất độn trong sản xuất giấy, dược phẩm |
| Natri bicacbonat | NaHCO3 | Thuốc chữa đau dạ dày, bột nở trong làm bánh, chất chữa cháy |
| Natri nitrat | NaNO3 | Phân bón, chất bảo quản thực phẩm, sản xuất thuốc nổ |
| Đồng sunfat | CuSO4 | Thuốc trừ sâu, thuốc diệt nấm, chất điện phân trong pin, chất tạo màu trong gốm sứ |
| Sắt sunfat | FeSO4 | Thuốc chữa thiếu máu, chất keo tụ trong xử lý nước thải, chất khử trong công nghiệp dệt nhuộm |
4. Gọi Tên Các Hợp Chất Vô Cơ: Hướng Dẫn Chi Tiết
Việc gọi tên các hợp chất vô cơ tuân theo một số quy tắc nhất định. Dưới đây là hướng dẫn chi tiết cách gọi tên các loại hợp chất vô cơ phổ biến:
4.1. Quy Tắc Gọi Tên Oxit
- Oxit kim loại: Tên kim loại (kèm hóa trị nếu kim loại có nhiều hóa trị) + oxit.
- Ví dụ:
- Na2O: Natri oxit
- CuO: Đồng(II) oxit (hoặc Đồng oxit)
- Fe2O3: Sắt(III) oxit (hoặc Sắt oxit)
- Ví dụ:
- Oxit phi kim: Tiền tố chỉ số nguyên tử phi kim + tên phi kim + tiền tố chỉ số nguyên tử oxy + oxit.
- Tiền tố:
- 1: Mono (thường bỏ qua)
- 2: Đi
- 3: Tri
- 4: Tetra
- 5: Penta
- Ví dụ:
- CO2: Carbon đioxit
- SO3: Lưu huỳnh trioxit
- N2O5: Đinitơ pentaoxit
- Tiền tố:
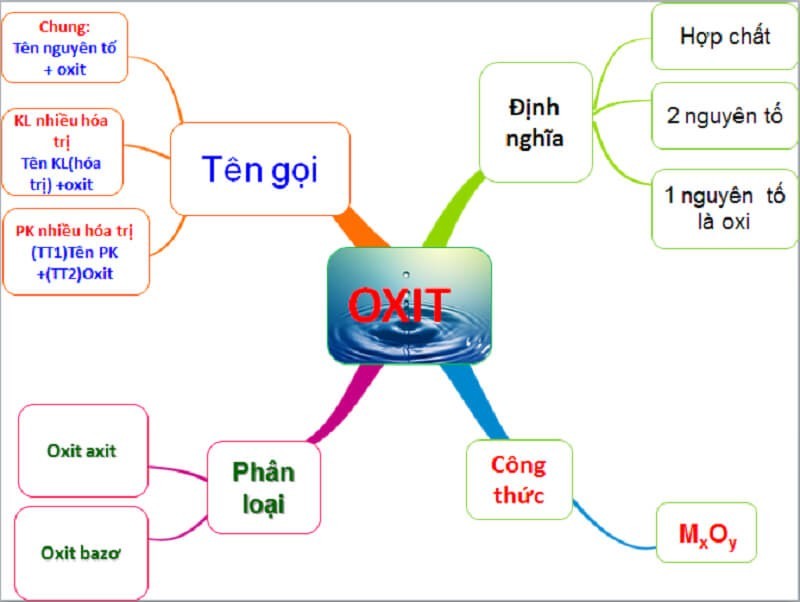 Cách gọi tên oxit dựa vào thành phần cấu tạo
Cách gọi tên oxit dựa vào thành phần cấu tạo
4.2. Quy Tắc Gọi Tên Bazơ
Tên kim loại (kèm hóa trị nếu kim loại có nhiều hóa trị) + hidroxit.
- Ví dụ:
- NaOH: Natri hidroxit
- Ca(OH)2: Canxi hidroxit
- Fe(OH)3: Sắt(III) hidroxit (hoặc Sắt hidroxit)
4.3. Quy Tắc Gọi Tên Axit
- Axit không có oxy: Axit + tên phi kim + hidric.
- Ví dụ:
- HCl: Axit clohidric
- HBr: Axit bromhidric
- HF: Axit flohidric
- Ví dụ:
- Axit có oxy:
- Axit có nhiều oxy: Axit + tên phi kim + ic
- Axit có ít oxy: Axit + tên phi kim + ơ
- Ví dụ:
- H2SO4: Axit sulfuric
- HNO3: Axit nitric
- H2SO3: Axit sunfurơ
- HNO2: Axit nitrơ
4.4. Quy Tắc Gọi Tên Muối
Tên kim loại (kèm hóa trị nếu kim loại có nhiều hóa trị) + tên gốc axit.
- Tên gốc axit:
- Gốc axit của axit có đuôi “ic” đổi thành “at”
- Gốc axit của axit có đuôi “ơ” đổi thành “it”
- Ví dụ:
- NaCl: Natri clorua (gốc clorua từ axit clohidric)
- CaCO3: Canxi cacbonat (gốc cacbonat từ axit cacbonic)
- Na2SO4: Natri sunfat (gốc sunfat từ axit sulfuric)
- NaNO2: Natri nitrit (gốc nitrit từ axit nitrơ)
5. Sơ Đồ Tư Duy Hợp Chất Vô Cơ: Tổng Quan Kiến Thức
Sơ đồ tư duy là một công cụ hữu ích giúp bạn hệ thống hóa kiến thức về hợp chất vô cơ một cách trực quan và dễ nhớ. Dưới đây là một số mẫu sơ đồ tư duy về hợp chất vô cơ mà bạn có thể tham khảo:
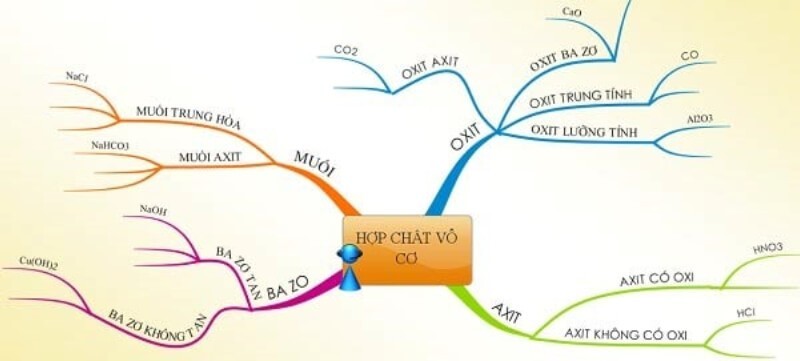 Sơ đồ tư duy các hợp chất vô cơ
Sơ đồ tư duy các hợp chất vô cơ
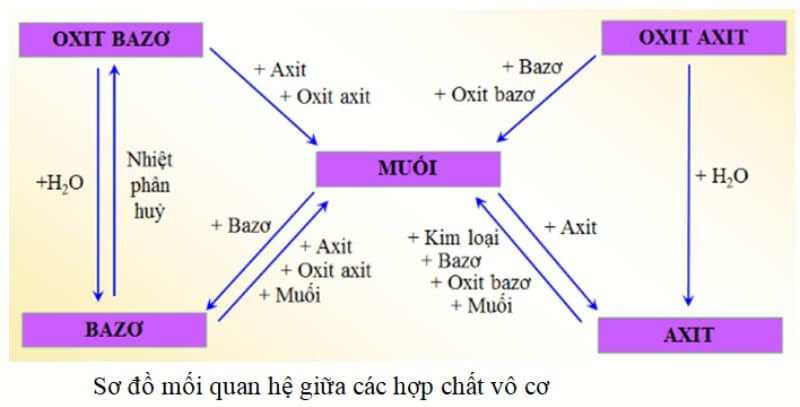 Sơ đồ tư duy các hợp chất vô cơ
Sơ đồ tư duy các hợp chất vô cơ
6. Bài Tập Về Hợp Chất Vô Cơ: Vận Dụng Kiến Thức
Để củng cố kiến thức về hợp chất vô cơ, bạn có thể làm một số bài tập vận dụng sau:
Bài 1: Hoàn thành chuỗi phản ứng sau:
Fe → FeCl2 → Fe(OH)2 → FeO → Fe
Lời giải:
- Fe + 2HCl → FeCl2 + H2
- FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl
- Fe(OH)2 → FeO + H2O (điều kiện: nhiệt độ)
- FeO + CO → Fe + CO2 (điều kiện: nhiệt độ)
Bài 2: Nhận biết các dung dịch mất nhãn sau: HCl, NaOH, NaCl.
Lời giải:
- Dùng quỳ tím:
- HCl làm quỳ tím hóa đỏ.
- NaOH làm quỳ tím hóa xanh.
- NaCl không làm đổi màu quỳ tím.
Bài 3: Cho 11,2 gam sắt tác dụng hoàn toàn với dung dịch HCl dư. Tính thể tích khí H2 thu được ở điều kiện tiêu chuẩn.
Lời giải:
- Số mol Fe = 11,2 / 56 = 0,2 mol
- Fe + 2HCl → FeCl2 + H2
- Theo phương trình, số mol H2 = số mol Fe = 0,2 mol
- Thể tích H2 = 0,2 x 22,4 = 4,48 lít
7. FAQ: Giải Đáp Các Câu Hỏi Thường Gặp Về Hợp Chất Vô Cơ
Dưới đây là một số câu hỏi thường gặp về hợp chất vô cơ và câu trả lời chi tiết:
Câu 1: Hợp chất vô cơ có độc hại không?
Trả lời: Có. Một số hợp chất vô cơ có thể độc hại, gây nguy hiểm cho sức khỏe và môi trường. Ví dụ: các axit mạnh (H2SO4, HCl), các muối kim loại nặng (chì, thủy ngân, cadmi),… Tuy nhiên, cũng có nhiều hợp chất vô cơ an toàn và cần thiết cho cuộc sống.
Câu 2: Làm thế nào để phân biệt hợp chất vô cơ và hữu cơ?
Trả lời: Cách đơn giản nhất là dựa vào thành phần. Hợp chất hữu cơ chứa carbon và hydro, thường có liên kết C-H. Hợp chất vô cơ không chứa liên kết C-H (ngoại trừ một số trường hợp đặc biệt).
Câu 3: Tại sao nước (H2O) lại là hợp chất vô cơ?
Trả lời: Vì nước chỉ chứa hydro và oxy, không chứa carbon.
Câu 4: Hợp chất vô cơ có tan trong nước không?
Trả lời: Có. Nhiều hợp chất vô cơ tan trong nước, đặc biệt là các muối, axit và bazơ. Tuy nhiên, cũng có một số hợp chất vô cơ không tan trong nước.
Câu 5: Hợp chất vô cơ có vai trò gì trong cơ thể sống?
Trả lời: Hợp chất vô cơ đóng vai trò quan trọng trong nhiều quá trình sinh học, ví dụ: nước (H2O) là dung môi cho các phản ứng sinh hóa, muối khoáng (NaCl, KCl, CaCl2) tham gia vào điều hòa áp suất thẩm thấu và hoạt động của hệ thần kinh.
Câu 6: Ứng dụng của hợp chất vô cơ trong ngành xây dựng là gì?
Trả lời: Hợp chất vô cơ được sử dụng rộng rãi trong ngành xây dựng, ví dụ: xi măng (CaCO3, CaO), vôi (Ca(OH)2), cát (SiO2), đá (CaCO3, MgCO3),…
Câu 7: Hợp chất vô cơ có thể gây ô nhiễm môi trường không?
Trả lời: Có. Việc xả thải các hợp chất vô cơ độc hại (axit, bazơ, muối kim loại nặng) vào môi trường có thể gây ô nhiễm nguồn nước, đất và không khí.
Câu 8: Làm thế nào để xử lý chất thải chứa hợp chất vô cơ?
Trả lời: Có nhiều phương pháp xử lý chất thải chứa hợp chất vô cơ, tùy thuộc vào tính chất và nồng độ của chất thải. Một số phương pháp phổ biến là: trung hòa, kết tủa, hấp phụ, trao đổi ion, oxy hóa khử,…
Câu 9: Tìm hiểu về hợp chất vô cơ ở đâu?
Trả lời: Bạn có thể tìm hiểu về hợp chất vô cơ trong sách giáo khoa hóa học, các trang web khoa học uy tín, các bài báo khoa học, hoặc tham gia các khóa học về hóa học.
Câu 10: Làm thế nào để nhớ các quy tắc gọi tên hợp chất vô cơ?
Trả lời: Cách tốt nhất là luyện tập thường xuyên. Hãy bắt đầu với các hợp chất đơn giản, sau đó dần dần chuyển sang các hợp chất phức tạp hơn. Bạn cũng có thể sử dụng các sơ đồ tư duy hoặc bảng tổng hợp để ghi nhớ các quy tắc một cách dễ dàng hơn.
Bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về các loại xe tải phù hợp với nhu cầu vận chuyển hàng hóa tại khu vực Mỹ Đình, Hà Nội? Đừng ngần ngại truy cập ngay XETAIMYDINH.EDU.VN để được tư vấn và giải đáp mọi thắc mắc. Chúng tôi cung cấp thông tin cập nhật về các dòng xe tải, so sánh giá cả, thông số kỹ thuật, cũng như các dịch vụ sửa chữa và bảo dưỡng xe tải uy tín trong khu vực. Liên hệ ngay với Xe Tải Mỹ Đình qua hotline 0247 309 9988 hoặc ghé thăm địa chỉ Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội để được hỗ trợ tốt nhất!