Nitơ là một nguyên tố hóa học thiết yếu cho sự sống, nhưng bạn có biết nitơ hóa trị mấy và nó có những tính chất, ứng dụng gì đặc biệt? Hãy cùng XETAIMYDINH.EDU.VN khám phá tất tần tật về nitơ, từ hóa trị đến ứng dụng thực tế, để hiểu rõ hơn về nguyên tố quan trọng này. Chúng tôi sẽ cung cấp thông tin chi tiết, dễ hiểu, giúp bạn nắm vững kiến thức về nitơ.
1. Nitơ Là Gì? Tìm Hiểu Tổng Quan Về Nguyên Tố Nitơ
Nitơ, với công thức hóa học là N₂, là một nguyên tố phi kim phổ biến, chiếm phần lớn khí quyển Trái Đất. Nitơ đóng vai trò vô cùng quan trọng trong sinh học và công nghiệp. Theo Tổng cục Thống kê, nitơ chiếm khoảng 78% thể tích không khí, là thành phần không thể thiếu của protein và axit nucleic, những yếu tố cấu tạo nên sự sống.
Nitơ tồn tại ở hai dạng chính:
- Nitơ khí (N₂): Dạng phổ biến nhất, không màu, không mùi, không vị và tương đối trơ ở điều kiện thường.
- Nitơ lỏng: Được tạo ra bằng cách làm lạnh nitơ khí đến nhiệt độ cực thấp (-196°C), có nhiều ứng dụng trong công nghiệp và y học.
 Công thức hóa học của Nitơ là N2
Công thức hóa học của Nitơ là N2
2. Nitơ Hóa Trị Mấy? Các Hóa Trị Phổ Biến Của Nitơ
Không giống như nhiều nguyên tố chỉ có một hóa trị duy nhất, nitơ thể hiện nhiều hóa trị khác nhau trong các hợp chất hóa học. Vậy nitơ hóa trị mấy là câu hỏi được nhiều người quan tâm. Nitơ có thể có các hóa trị sau:
- Hóa trị II (2): Ít phổ biến hơn, thường gặp trong một số hợp chất phức tạp.
- Hóa trị III (3): Phổ biến trong amoniac (NH₃) và các hợp chất hữu cơ chứa nitơ.
- Hóa trị IV (4): Gặp trong nitơ đioxit (NO₂) và một số oxit khác của nitơ.
3. Số Oxi Hóa Của Nitơ Là Gì?
Số oxi hóa của nitơ có thể thay đổi tùy thuộc vào hợp chất mà nó tham gia. Các số oxi hóa phổ biến của nitơ bao gồm:
- -3: Trong amoniac (NH₃) và các muối amoni.
- 0: Trong phân tử nitơ (N₂).
- +1: Trong nitơ oxit (N₂O).
- +2: Trong nitơ monoxit (NO).
- +3: Trong nitơ trioxit (N₂O₃).
- +4: Trong nitơ đioxit (NO₂).
- +5: Trong nitơ pentoxit (N₂O₅) và axit nitric (HNO₃).
4. Tính Chất Vật Lý Của Nitơ Như Thế Nào?
Nitơ là một chất khí không màu, không mùi, không vị và nhẹ hơn không khí. Nó ít tan trong nước và hóa rắn ở nhiệt độ rất thấp. Dưới đây là một số tính chất vật lý quan trọng của nitơ:
- Ký hiệu nguyên tử: N
- Số hiệu nguyên tử: 7 (thuộc nhóm VA trong bảng tuần hoàn)
- Số oxi hóa: -3, 0, +1, +2, +3, +4, +5
- Nhiệt độ sôi: -195.8°C (77.36 K)
- Nhiệt độ nóng chảy: -210.0°C (63.15 K)
- Khối lượng riêng: 1.251 kg/m³ (ở 0°C)
 Nitơ là chất khí và nhẹ hơn không khí
Nitơ là chất khí và nhẹ hơn không khí
5. Tính Chất Hóa Học Của Nitơ Ra Sao?
Nitơ có nhiều số oxi hóa khác nhau, từ -3 đến +5, cho phép nó vừa thể hiện tính khử, vừa thể hiện tính oxi hóa. Tuy nhiên, ở điều kiện thường, nitơ là một chất trơ về mặt hóa học.
5.1 Tính Khử Của Nitơ
Do có tính khử, nitơ có thể phản ứng với các nguyên tố có độ âm điện lớn hơn, đặc biệt ở nhiệt độ cao (trên 3000°C).
-
Phản ứng với Oxi: Ở nhiệt độ rất cao, nitơ phản ứng với oxi tạo thành nitơ monoxit (NO).
Phương trình phản ứng: N₂ + O₂ → 2NO (khí không màu)
Trong đó, N₂ có hóa trị 0, N trong NO có hóa trị +2.
-
Phản ứng với Oxi trong không khí: Ở điều kiện thường, nitơ monoxit (NO) tác dụng với oxi trong không khí tạo thành nitơ đioxit (NO₂), có màu nâu đỏ.
Phương trình phản ứng: 2NO + O₂ → 2NO₂
Trong đó, N trong NO₂ có hóa trị +4.
5.2 Tính Oxi Hóa Của Nitơ
Nitơ cũng thể hiện tính oxi hóa khi tác dụng với các nguyên tố có độ âm điện nhỏ hơn, như kim loại và hidro.
-
Tác dụng với kim loại: Ở điều kiện thường, nitơ chỉ tác dụng với liti (Li) tạo thành liti nitrua.
Phương trình: 6Li + N₂ → 2Li₃N
Ở nhiệt độ cao, nitơ có thể tác dụng với nhiều kim loại khác tạo thành nitrua. Tuy nhiên, các nitrua này dễ bị thủy phân tạo thành amoniac (NH₃).
Ví dụ: 3Mg + N₂ → Mg₃N₂
-
Tác dụng với hidro: Nitơ phản ứng với hidro ở nhiệt độ và áp suất cao, có xúc tác, tạo thành amoniac.
Phương trình phản ứng: N₂ + 3H₂ ⇌ 2NH₃
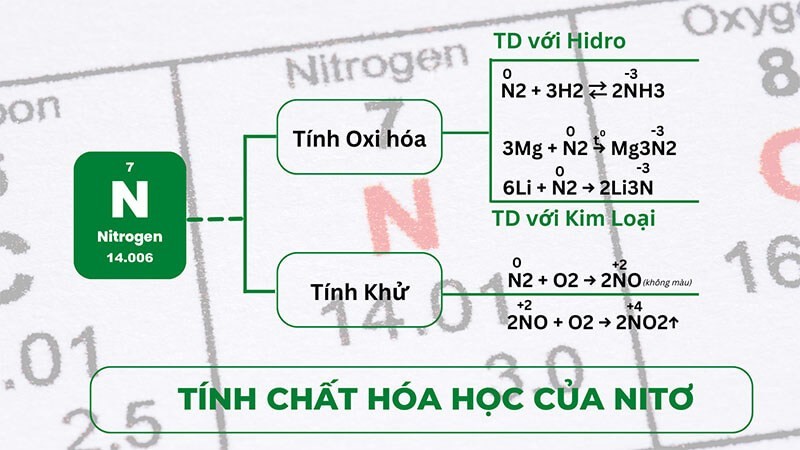 Tính chất hóa học của Nitơ
Tính chất hóa học của Nitơ
6. Ứng Dụng Quan Trọng Của Nitơ Trong Đời Sống Và Sản Xuất
Nitơ, đặc biệt là nitơ khí, có rất nhiều ứng dụng quan trọng trong đời sống và sản xuất.
- Trong nghiên cứu và giáo dục: Dùng để phân tích mẫu và nghiên cứu các hợp chất hóa học.
- Trong chế biến và bảo quản thực phẩm: Nitơ lỏng được sử dụng để làm lạnh nhanh thực phẩm, bảo quản thực phẩm tươi sống trong quá trình vận chuyển.
- Trong y học: Nitơ lỏng được dùng để bảo quản các mẫu sinh học, mô, tế bào, và các bộ phận cơ thể không bị phân hủy, đặc biệt là bảo quản trứng và tinh trùng.
- Trong luyện kim và chế tạo kim loại: Nitơ được sử dụng trong sản xuất thép không gỉ, linh kiện điện tử, và luyện kim để tạo môi trường trơ, ngăn chặn quá trình oxi hóa.
- Trong sản xuất máy bay và lốp ô tô: Bơm lốp ô tô và máy bay bằng khí nitơ giúp duy trì áp suất ổn định và giảm nguy cơ cháy nổ.
- Trong hàn ống và chế biến kim loại: Nitơ được sử dụng để làm sạch đường ống và giảm thiểu hư hại trong quá trình sử dụng thiết bị.
- Trong bảo quản thực phẩm: Nitơ có tính trơ, ngăn chặn quá trình oxi hóa, giúp bảo quản thực phẩm lâu hơn.
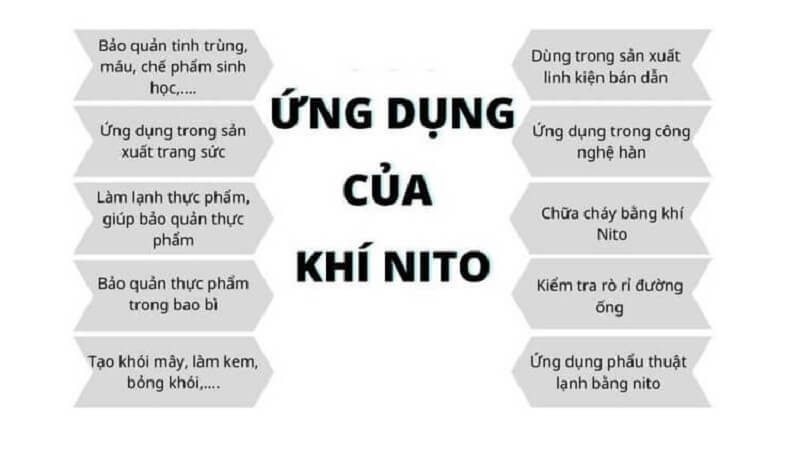 Nitơ có nhiều ứng dụng trong đời sống
Nitơ có nhiều ứng dụng trong đời sống
7. Điều Chế Nitơ Như Thế Nào Trong Phòng Thí Nghiệm Và Công Nghiệp?
Nitơ có thể được điều chế bằng nhiều phương pháp khác nhau, tùy thuộc vào quy mô và mục đích sử dụng.
7.1 Điều Chế Nitơ Trong Phòng Thí Nghiệm
Trong phòng thí nghiệm, nitơ thường được điều chế bằng cách nhiệt phân dung dịch muối amoni nitrit bão hòa.
Phương trình phản ứng: NH₄NO₂ → N₂ + 2H₂O
7.2 Điều Chế Nitơ Trong Công Nghiệp
Trong công nghiệp, nitơ được sản xuất chủ yếu bằng phương pháp chưng cất phân đoạn không khí lỏng. Quá trình này dựa trên sự khác biệt về nhiệt độ sôi giữa nitơ (-196°C) và oxi (-183°C). Nitơ thu được có độ tinh khiết cao và được lưu trữ trong các bình thép nén ở áp suất cao (khoảng 125 atm).
8. Những Lưu Ý Quan Trọng Khi Sử Dụng Và Bảo Quản Nitơ
Khi sử dụng và bảo quản nitơ, đặc biệt là nitơ lỏng, cần tuân thủ các biện pháp an toàn sau:
- Thông gió tốt: Đảm bảo khu vực làm việc thông thoáng để tránh tích tụ khí nitơ, gây ngạt thở.
- Sử dụng thiết bị bảo hộ: Đeo găng tay cách nhiệt và kính bảo hộ khi tiếp xúc với nitơ lỏng để tránh bị bỏng lạnh.
- Bảo quản đúng cách: Lưu trữ nitơ trong các bình chứa chuyên dụng, đặt ở nơi khô ráo, thoáng mát và tránh xa nguồn nhiệt.
- Tránh xa vật liệu dễ cháy: Nitơ không cháy, nhưng nó có thể hỗ trợ quá trình cháy của các vật liệu khác.
- Không đổ nitơ lỏng xuống cống: Điều này có thể gây hư hại cho hệ thống thoát nước và gây nguy hiểm cho môi trường.
9. Nitơ Có Độc Không? Ảnh Hưởng Của Nitơ Đến Sức Khỏe Và Môi Trường
Nitơ ở dạng khí (N₂) không độc và chiếm phần lớn không khí chúng ta hít thở hàng ngày. Tuy nhiên, trong một số điều kiện nhất định, nitơ có thể gây hại cho sức khỏe và môi trường.
- Ngạt thở: Nồng độ nitơ quá cao trong không khí có thể làm giảm lượng oxi, gây ngạt thở. Điều này đặc biệt nguy hiểm trong không gian kín.
- Các oxit của nitơ: Một số oxit của nitơ, như NO₂ và NOx, là chất ô nhiễm không khí, gây ra các vấn đề về hô hấp và góp phần vào hiện tượng mưa axit.
- Ô nhiễm nguồn nước: Sử dụng quá nhiều phân bón chứa nitơ trong nông nghiệp có thể gây ô nhiễm nguồn nước, ảnh hưởng đến hệ sinh thái.
10. Phân Biệt Các Hợp Chất Quan Trọng Của Nitơ: Amoniac, Axit Nitric, Phân Đạm
Nitơ tạo thành nhiều hợp chất quan trọng, mỗi hợp chất có tính chất và ứng dụng riêng.
- Amoniac (NH₃): Là một hợp chất quan trọng trong sản xuất phân bón, chất tẩy rửa và nhiều hóa chất khác. Amoniac có mùi khai đặc trưng và có tính bazơ.
- Axit nitric (HNO₃): Là một axit mạnh, được sử dụng trong sản xuất phân bón, thuốc nổ và nhiều sản phẩm công nghiệp khác. Axit nitric có tính oxi hóa mạnh và ăn mòn.
- Phân đạm: Là loại phân bón chứa nitơ, cung cấp dinh dưỡng cho cây trồng. Các loại phân đạm phổ biến bao gồm ure, amoni nitrat và amoni sulfat.
11. Tìm Hiểu Về Chu Trình Nitơ Trong Tự Nhiên
Chu trình nitơ là một quá trình phức tạp, mô tả sự chuyển đổi của nitơ giữa các dạng khác nhau trong môi trường. Quá trình này bao gồm các giai đoạn chính:
- Cố định nitơ: Chuyển đổi nitơ khí (N₂) thành các dạng nitơ hữu dụng (như amoniac) bởi vi khuẩn cố định nitơ.
- Nitrat hóa: Chuyển đổi amoniac thành nitrit và sau đó thành nitrat bởi vi khuẩn nitrat hóa.
- Đồng hóa: Cây trồng hấp thụ nitrat và amoni để tổng hợp protein và các hợp chất hữu cơ khác.
- Amon hóa: Phân hủy các chất hữu cơ chứa nitơ thành amoniac.
- Phản nitrat hóa: Chuyển đổi nitrat trở lại thành nitơ khí (N₂), trả lại nitơ vào khí quyển.
Chu trình nitơ đóng vai trò quan trọng trong việc duy trì sự cân bằng sinh thái và cung cấp nitơ cho sự sống.
12. Các Loại Phân Bón Chứa Nitơ Và Ảnh Hưởng Của Chúng Đến Nông Nghiệp
Phân bón chứa nitơ là một yếu tố quan trọng trong nông nghiệp hiện đại, giúp tăng năng suất cây trồng. Các loại phân bón chứa nitơ phổ biến bao gồm:
- Ure (CO(NH₂)₂): Chứa hàm lượng nitơ cao nhất (khoảng 46%), dễ hòa tan trong nước và dễ sử dụng.
- Amoni nitrat (NH₄NO₃): Chứa khoảng 33-34% nitơ, có tác dụng nhanh chóng nhưng dễ bị rửa trôi.
- Amoni sulfat ((NH₄)₂SO₄): Chứa khoảng 21% nitơ, cung cấp thêm lưu huỳnh cho cây trồng.
- Phân lân nung chảy: Chứa nitơ và các khoáng chất khác, thích hợp cho đất chua.
Việc sử dụng phân bón chứa nitơ cần được thực hiện đúng cách để tránh gây ô nhiễm môi trường và ảnh hưởng đến chất lượng nông sản.
13. Vai Trò Của Nitơ Trong Sản Xuất Thép Và Các Vật Liệu Kim Loại
Nitơ được sử dụng rộng rãi trong ngành luyện kim để cải thiện tính chất của thép và các vật liệu kim loại khác.
- Thép không gỉ: Nitơ được thêm vào thép không gỉ để tăng độ bền, độ cứng và khả năng chống ăn mòn.
- Luyện kim: Nitơ được sử dụng để tạo môi trường trơ trong quá trình luyện kim, ngăn chặn quá trình oxi hóa và cải thiện chất lượng sản phẩm.
- Xử lý nhiệt: Nitơ được sử dụng trong quá trình xử lý nhiệt để cải thiện độ cứng và độ bền của các chi tiết kim loại.
14. Ứng Dụng Của Nitơ Lỏng Trong Y Học Và Nghiên Cứu Khoa Học
Nitơ lỏng có nhiệt độ rất thấp (-196°C), được sử dụng rộng rãi trong y học và nghiên cứu khoa học.
- Bảo quản mẫu sinh học: Nitơ lỏng được sử dụng để bảo quản các mẫu sinh học, tế bào, mô và các bộ phận cơ thể trong thời gian dài.
- Phẫu thuật lạnh (cryosurgery): Nitơ lỏng được sử dụng để đóng băng và phá hủy các tế bào ung thư hoặc các mô bất thường khác.
- Nghiên cứu khoa học: Nitơ lỏng được sử dụng trong nhiều thí nghiệm khoa học, như làm lạnh các vật liệu để nghiên cứu tính chất của chúng ở nhiệt độ thấp.
15. Các Biện Pháp Giảm Thiểu Tác Động Tiêu Cực Của Nitơ Đến Môi Trường
Việc sử dụng nitơ không đúng cách có thể gây ra các tác động tiêu cực đến môi trường. Dưới đây là một số biện pháp giảm thiểu tác động này:
- Sử dụng phân bón hợp lý: Sử dụng đúng loại phân bón, đúng liều lượng và đúng thời điểm để giảm thiểu lượng nitơ thất thoát vào môi trường.
- Cải thiện quản lý đất: Áp dụng các biện pháp quản lý đất bền vững để tăng khả năng giữ nitơ trong đất.
- Xử lý nước thải: Xây dựng và vận hành các hệ thống xử lý nước thải hiệu quả để loại bỏ nitơ trước khi xả ra môi trường.
- Kiểm soát khí thải: Sử dụng các công nghệ kiểm soát khí thải để giảm lượng oxit nitơ thải ra từ các nhà máy và phương tiện giao thông.
FAQ – Các Câu Hỏi Thường Gặp Về Nitơ
-
Nitơ có vai trò gì đối với sự sống?
Nitơ là thành phần thiết yếu của protein và axit nucleic, những phân tử quan trọng cho sự sống.
-
Nitơ có gây ô nhiễm không khí không?
Một số oxit của nitơ (NOx) là chất ô nhiễm không khí, gây ra các vấn đề về hô hấp và góp phần vào hiện tượng mưa axit.
-
Nitơ lỏng có nguy hiểm không?
Nitơ lỏng có thể gây bỏng lạnh nếu tiếp xúc trực tiếp với da. Ngoài ra, nó có thể gây ngạt thở nếu nồng độ trong không khí quá cao.
-
Tại sao nitơ được sử dụng để bảo quản thực phẩm?
Nitơ có tính trơ, ngăn chặn quá trình oxi hóa, giúp bảo quản thực phẩm lâu hơn.
-
Phân đạm có tác dụng gì đối với cây trồng?
Phân đạm cung cấp nitơ, một chất dinh dưỡng quan trọng giúp cây trồng phát triển và tăng năng suất.
-
Nitơ được điều chế như thế nào trong công nghiệp?
Nitơ được điều chế chủ yếu bằng phương pháp chưng cất phân đoạn không khí lỏng.
-
Nitơ có màu gì?
Nitơ ở dạng khí không màu.
-
Nitơ có mùi không?
Nitơ ở dạng khí không mùi.
-
Nitơ có vị không?
Nitơ ở dạng khí không vị.
-
Làm thế nào để giảm thiểu tác động tiêu cực của nitơ đến môi trường?
Sử dụng phân bón hợp lý, cải thiện quản lý đất, xử lý nước thải và kiểm soát khí thải là những biện pháp hiệu quả.
Bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải ở Mỹ Đình? Hãy truy cập ngay XETAIMYDINH.EDU.VN để được tư vấn và giải đáp mọi thắc mắc về các loại xe tải, giá cả, thủ tục mua bán và dịch vụ sửa chữa uy tín. Đừng ngần ngại liên hệ với chúng tôi qua hotline 0247 309 9988 hoặc đến trực tiếp địa chỉ Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội để được hỗ trợ tốt nhất. Xe Tải Mỹ Đình luôn sẵn sàng đồng hành cùng bạn trên mọi nẻo đường!