Hcl Quỳ Tím là một chủ đề quan trọng trong hóa học, đặc biệt khi nói đến tính axit. Vậy, HCL làm quỳ tím chuyển màu gì? Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN) sẽ giải đáp thắc mắc này, đồng thời cung cấp thông tin chi tiết về ứng dụng, tính chất và những điều cần biết về HCL, giúp bạn hiểu rõ hơn về loại hóa chất này. Cùng Xe Tải Mỹ Đình khám phá thế giới hóa học và tìm hiểu về độ pH, tính ăn mòn và các phản ứng hóa học liên quan đến HCL.
1. HCL Là Gì? Tổng Quan Về Axit Clohidric
HCL, hay axit clohidric (còn gọi là acid hydrocloric), là một axit vô cơ mạnh được tạo ra từ sự hòa tan của khí hidro clorua (HCl) trong nước. Cả hidro clorua và axit clohidric đều có tính ăn mòn cao, là một trong những hóa chất quan trọng trong nhiều ngành công nghiệp.
Công thức hóa học: HCl
Đặc điểm:
- Dạng tồn tại: Chất lỏng không màu hoặc hơi vàng, có mùi xốc đặc trưng.
- Tính chất: Axit mạnh, ăn mòn cao.
- Ứng dụng: Rộng rãi trong công nghiệp, phòng thí nghiệm và đời sống.
2. HCL Quỳ Tím: Giải Thích Chi Tiết Về Sự Đổi Màu
2.1. HCL Tác Dụng Với Quỳ Tím Như Thế Nào?
HCL là một axit mạnh, do đó, khi tiếp xúc với quỳ tím, nó sẽ làm quỳ tím chuyển sang màu đỏ. Phản ứng này xảy ra do HCL có khả năng cho ion H+ trong dung dịch.
Giải thích chi tiết:
- Quỳ tím: Là một chất chỉ thị pH, có khả năng thay đổi màu sắc tùy thuộc vào môi trường axit hoặc bazơ.
- Môi trường axit: Quỳ tím chuyển sang màu đỏ.
- Môi trường bazơ: Quỳ tím chuyển sang màu xanh.
- Môi trường trung tính: Quỳ tím giữ nguyên màu tím.
2.2. Tại Sao HCL Làm Quỳ Tím Chuyển Sang Màu Đỏ?
Khi HCL hòa tan trong nước, nó phân ly hoàn toàn thành các ion H+ và Cl-. Ion H+ chính là tác nhân gây ra sự đổi màu của quỳ tím. Các ion H+ này tác dụng với các phân tử trong quỳ tím, làm thay đổi cấu trúc của chúng và do đó làm thay đổi màu sắc.
Phản ứng hóa học:
HCl + H₂O → H₃O⁺ + Cl⁻
Ion H₃O⁺ (ion hydronium) là dạng tồn tại chính của ion H+ trong dung dịch nước và là yếu tố quyết định tính axit của dung dịch.
2.3. Lưu Ý Quan Trọng Khi Sử Dụng Quỳ Tím Với HCL
- Nồng độ HCL: Nồng độ HCL càng cao, màu đỏ của quỳ tím càng đậm.
- Dạng tồn tại: Phản ứng chỉ xảy ra khi HCL ở dạng dung dịch. Khí HCL khô không làm đổi màu quỳ tím.
- An toàn: HCL là một axit mạnh, cần sử dụng cẩn thận và tuân thủ các biện pháp an toàn khi thực hiện thí nghiệm.
 HCL-lam-quy-tim-chuyen-mau-gi-1
HCL-lam-quy-tim-chuyen-mau-gi-1
HCL làm quỳ tím chuyển màu đỏ do tính axit mạnh
3. HCL Là Axit Mạnh Hay Yếu? Đánh Giá Chi Tiết
HCL là một axit mạnh. Trong dung dịch nước, nó phân ly hoàn toàn thành các ion hydronium (H₃O⁺) và ion clorua (Cl⁻). Điều này có nghĩa là gần như tất cả các phân tử HCL đều giải phóng ion H⁺ vào dung dịch, làm tăng nồng độ ion hydronium và làm giảm độ pH.
Phản ứng phân ly:
HCl (aq) → H⁺ (aq) + Cl⁻ (aq)
hoặc
HCl + H₂O → H₃O⁺ + Cl⁻
4. Độ pH Của HCL: Xác Định Mức Độ Axit
Độ pH là một chỉ số quan trọng để đo độ axit hoặc bazơ của một dung dịch. Thang pH thường dao động từ 0 đến 14, với:
- pH < 7: Dung dịch có tính axit
- pH = 7: Dung dịch trung tính
- pH > 7: Dung dịch có tính bazơ
HCL là một axit mạnh, vì vậy dung dịch HCL có độ pH rất thấp. Độ pH của dung dịch HCL phụ thuộc vào nồng độ của nó:
| Nồng độ HCL (M) | Độ pH (ước tính) |
|---|---|
| 1.0 | 0 |
| 0.1 | 1 |
| 0.01 | 2 |
| 0.001 | 3 |
Lưu ý:
- Độ pH có thể được đo bằng máy đo pH hoặc bằng các chất chỉ thị pH.
- Việc xác định chính xác độ pH của dung dịch HCL là rất quan trọng trong nhiều ứng dụng, đặc biệt là trong công nghiệp và phòng thí nghiệm.
5. Hướng Dẫn Đo Độ pH Của HCL: Phương Pháp Chi Tiết
Để đo độ pH của dung dịch HCL một cách chính xác, bạn có thể sử dụng các phương pháp sau:
5.1. Sử Dụng Máy Đo pH Chuyên Dụng
Máy đo pH là thiết bị điện tử được thiết kế để đo độ pH của dung dịch một cách nhanh chóng và chính xác.
Các bước thực hiện:
- Chuẩn bị:
- Máy đo pH đã được hiệu chuẩn.
- Dung dịch HCL cần đo.
- Cốc đựng sạch.
- Nước cất để rửa điện cực.
- Hiệu chuẩn máy đo pH:
- Sử dụng các dung dịch chuẩn pH (ví dụ: pH 4.0, pH 7.0, pH 10.0) để hiệu chuẩn máy theo hướng dẫn của nhà sản xuất.
- Đo độ pH:
- Rửa sạch điện cực của máy đo pH bằng nước cất.
- Nhúng điện cực vào dung dịch HCL cần đo.
- Đợi cho đến khi số đọc trên máy ổn định.
- Ghi lại giá trị pH hiển thị trên máy.
- Vệ sinh:
- Rửa sạch điện cực bằng nước cất sau khi đo.
- Bảo quản điện cực theo hướng dẫn của nhà sản xuất.
Lưu ý:
- Đảm bảo máy đo pH được hiệu chuẩn đúng cách để có kết quả chính xác.
- Tránh làm nhiễm bẩn dung dịch HCL trong quá trình đo.
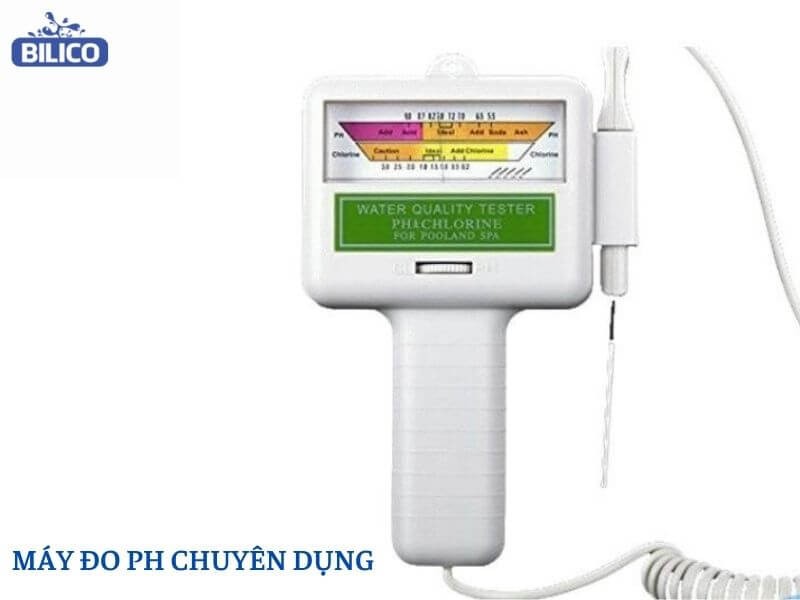 HCl-lam-quy-tim-chuyen-mau-gi-4
HCl-lam-quy-tim-chuyen-mau-gi-4
Sử dụng máy đo pH để đo độ pH của HCL
5.2. Sử Dụng Bộ Test Thử Nước (Chỉ Thị Màu)
Bộ test thử nước sử dụng các chất chỉ thị pH để xác định độ pH của dung dịch bằng cách so sánh màu sắc của dung dịch sau khi thêm chất chỉ thị với bảng màu chuẩn.
Các bước thực hiện:
- Chuẩn bị:
- Bộ test thử nước (bao gồm chất chỉ thị pH và bảng màu chuẩn).
- Dung dịch HCL cần đo.
- Ống nghiệm hoặc cốc đựng sạch.
- Thực hiện:
- Lấy một lượng nhỏ dung dịch HCL vào ống nghiệm hoặc cốc đựng.
- Thêm một vài giọt chất chỉ thị pH vào dung dịch HCL.
- Lắc nhẹ để trộn đều.
- So sánh màu sắc của dung dịch với bảng màu chuẩn đi kèm trong bộ test thử.
- Xác định giá trị pH tương ứng với màu sắc của dung dịch.
- Ghi lại kết quả.
Lưu ý:
- Chọn bộ test thử nước có dải đo pH phù hợp với độ pH dự kiến của dung dịch HCL.
- Đọc kỹ hướng dẫn sử dụng của bộ test thử nước để đảm bảo thực hiện đúng cách.
- Kết quả đo bằng bộ test thử nước thường không chính xác bằng máy đo pH chuyên dụng.
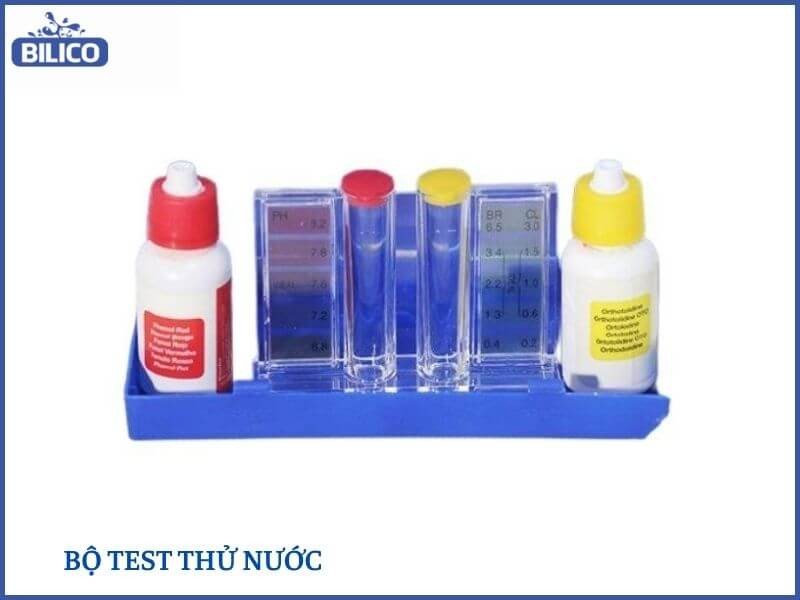 HCl-lam-quy-tim-chuyen-mau-gi-5
HCl-lam-quy-tim-chuyen-mau-gi-5
Sử dụng bộ test thử nước để đo độ pH của HCL
6. Tính Chất Vật Lý Của HCL: Các Đặc Điểm Cần Lưu Ý
Hiểu rõ tính chất vật lý của HCL là rất quan trọng để sử dụng và bảo quản hóa chất này một cách an toàn và hiệu quả. Dưới đây là một số tính chất vật lý quan trọng của HCL:
- Trạng thái: Chất lỏng không màu hoặc hơi vàng.
- Mùi: Mùi xốc, hắc khó chịu.
- Độ hòa tan: Hòa tan tốt trong nước.
- Tính ăn mòn: Ăn mòn mạnh các vật liệu kim loại, vải, da và nhiều vật liệu khác.
- Khối lượng mol: 36.46 g/mol.
- Điểm nóng chảy: -114 °C (159 K; -173 °F).
- Điểm sôi: 48 °C (321 K; 118 °F) (dung dịch 38%).
- Độ nhớt: 1.19 cP ở 25 °C.
Lưu ý:
- HCL bốc khói trong không khí ẩm do giải phóng khí HCl.
- Hít phải hơi HCL có thể gây kích ứng đường hô hấp, ho và khó thở.
- Tiếp xúc trực tiếp với HCL có thể gây bỏng da và tổn thương mắt nghiêm trọng.
7. Tính Chất Hóa Học Của HCL: Phản Ứng Và Ứng Dụng
HCL là một axit mạnh và có nhiều tính chất hóa học quan trọng, được ứng dụng rộng rãi trong nhiều lĩnh vực.
7.1. Tính Axit Mạnh
- Phản ứng với kim loại: HCL phản ứng với nhiều kim loại để tạo thành muối clorua và khí hidro.
- Ví dụ: Fe + 2HCl → FeCl₂ + H₂
- Phản ứng với oxit bazơ: HCL phản ứng với oxit bazơ để tạo thành muối và nước.
- Ví dụ: CuO + 2HCl → CuCl₂ + H₂O
- Phản ứng với bazơ: HCL phản ứng với bazơ để tạo thành muối và nước (phản ứng trung hòa).
- Ví dụ: NaOH + HCl → NaCl + H₂O
- Phản ứng với muối: HCL có thể phản ứng với một số muối để tạo thành muối mới và axit mới.
- Ví dụ: CaCO₃ + 2HCl → CaCl₂ + H₂O + CO₂
7.2. Tính Khử
HCL có thể hoạt động như một chất khử trong một số phản ứng, mặc dù tính chất này ít phổ biến hơn so với tính axit của nó.
7.3. Các Phản Ứng Đặc Trưng
| Phản ứng | Phương trình hóa học | Sản phẩm |
|---|---|---|
| Với kim loại | Zn + 2HCl → ZnCl₂ + H₂ | Muối clorua, khí hidro |
| Với oxit bazơ | MgO + 2HCl → MgCl₂ + H₂O | Muối clorua, nước |
| Với bazơ | KOH + HCl → KCl + H₂O | Muối clorua, nước |
| Với muối cacbonat | Na₂CO₃ + 2HCl → 2NaCl + H₂O + CO₂ | Muối clorua, nước, khí cacbonic |
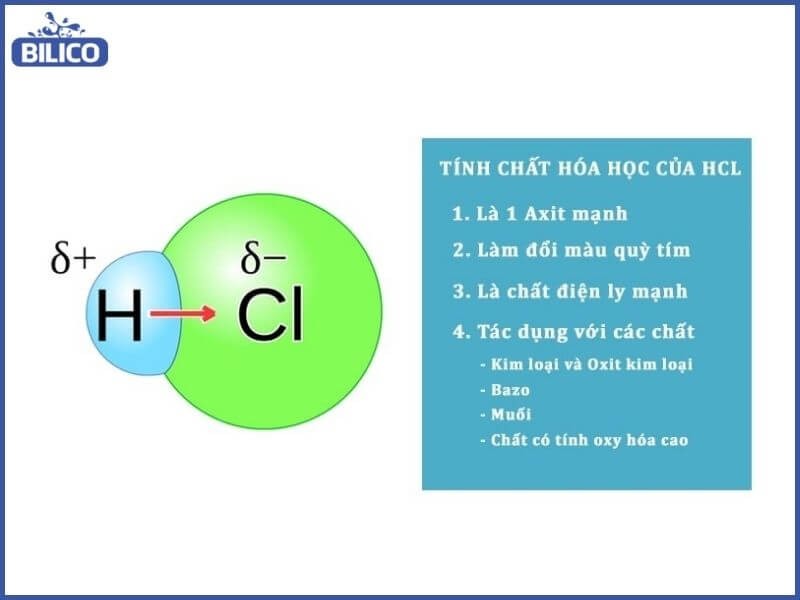 HCl-lam-quy-tim-chuyen-mau-gi-6
HCl-lam-quy-tim-chuyen-mau-gi-6
Các tính chất hóa học đặc trưng của HCL
8. HCL Không Tác Dụng Với Chất Nào? Lưu Ý Quan Trọng
Mặc dù HCL có nhiều phản ứng hóa học, nhưng nó không tác dụng với tất cả các chất. Dưới đây là một số chất mà HCL không phản ứng hoặc phản ứng rất chậm:
- Kim loại kém hoạt động: Các kim loại đứng sau hidro (H₂) trong dãy điện hóa như đồng (Cu), bạc (Ag), vàng (Au), platin (Pt) không phản ứng với HCL.
- Oxit axit: HCL không phản ứng với các oxit axit như SO₂, CO₂.
- Phi kim: HCL không phản ứng trực tiếp với các phi kim như lưu huỳnh (S), photpho (P).
- Hydrocacbon no: HCL không phản ứng với các hydrocacbon no như metan (CH₄), etan (C₂H₆) ở điều kiện thường.
- Một số muối không tan: Một số muối không tan như AgCl, BaSO₄ không phản ứng với HCL.
9. Ứng Dụng Của Axit HCL: Đa Dạng Trong Đời Sống Và Công Nghiệp
Axit HCL có rất nhiều ứng dụng quan trọng trong nhiều lĩnh vực khác nhau.
9.1. Trong Công Nghiệp
- Sản xuất hóa chất: HCL là nguyên liệu quan trọng để sản xuất nhiều hóa chất khác như vinyl clorua (để sản xuất PVC), polyuretan và các hợp chất hữu cơ khác. Theo thống kê của Bộ Công Thương, sản lượng PVC của Việt Nam năm 2023 đạt khoảng 800.000 tấn, cho thấy vai trò quan trọng của HCL trong ngành công nghiệp hóa chất.
- Tẩy rửa kim loại: HCL được sử dụng để loại bỏ rỉ sét và các tạp chất trên bề mặt kim loại trước khi gia công hoặc mạ.
- Điều chỉnh pH: HCL được sử dụng để điều chỉnh độ pH trong nhiều quy trình công nghiệp.
- Sản xuất thực phẩm: HCL được sử dụng trong sản xuất gelatin, protein thực vật thủy phân và các phụ gia thực phẩm khác.
- Xử lý nước: HCL được sử dụng để điều chỉnh độ pH trong quá trình xử lý nước thải công nghiệp.
9.2. Trong Phòng Thí Nghiệm
- Chất phản ứng: HCL được sử dụng làm chất phản ứng trong nhiều thí nghiệm hóa học.
- Chuẩn độ: HCL được sử dụng để chuẩn độ các dung dịch bazơ.
- Điều chế hóa chất: HCL được sử dụng để điều chế nhiều hóa chất khác.
9.3. Trong Đời Sống Hàng Ngày
- Vệ sinh nhà cửa: HCL pha loãng được sử dụng trong một số sản phẩm tẩy rửa nhà cửa để loại bỏ cặn bẩn và vết ố.
- Xử lý nước hồ bơi: HCL được sử dụng để điều chỉnh độ pH của nước hồ bơi, giúp duy trì môi trường nước sạch và an toàn.
Ví dụ cụ thể về ứng dụng trong đời sống:
- Tẩy rửa gỉ sét: Bạn có thể sử dụng dung dịch HCL loãng để tẩy rửa gỉ sét trên các dụng cụ kim loại.
- Vệ sinh nhà tắm: Một số sản phẩm vệ sinh nhà tắm chứa HCL giúp loại bỏ cặn canxi và các vết bẩn cứng đầu.
 HCl-lam-quy-tim-chuyen-mau-gi-7
HCl-lam-quy-tim-chuyen-mau-gi-7
Ứng dụng đa dạng của axit HCL trong đời sống và công nghiệp
10. An Toàn Khi Sử Dụng HCL: Biện Pháp Phòng Ngừa Cần Thiết
HCL là một hóa chất nguy hiểm và cần được sử dụng cẩn thận. Dưới đây là một số biện pháp an toàn cần tuân thủ khi sử dụng HCL:
- Đeo kính bảo hộ: Để bảo vệ mắt khỏi bị tổn thương do bắn hóa chất.
- Đeo găng tay bảo hộ: Để bảo vệ da tay khỏi bị ăn mòn.
- Mặc quần áo bảo hộ: Để bảo vệ cơ thể khỏi bị tiếp xúc với hóa chất.
- Sử dụng trong khu vực thông thoáng: Để tránh hít phải hơi HCL.
- Không pha loãng HCL bằng cách đổ nước vào axit: Luôn đổ từ từ axit vào nước và khuấy đều để tránh bắn hóa chất.
- Bảo quản HCL trong容器 kín, tránh xa tầm tay trẻ em và vật nuôi.
- Biết cách xử lý khi bị HCL bắn vào da hoặc mắt: Rửa ngay lập tức bằng nhiều nước sạch trong ít nhất 15 phút và tìm kiếm sự chăm sóc y tế.
Sơ cứu khi bị HCL tiếp xúc:
- Da: Rửa ngay lập tức bằng nhiều nước sạch trong ít nhất 15 phút. Cởi bỏ quần áo bị nhiễm hóa chất. Tìm kiếm sự chăm sóc y tế nếu có dấu hiệu bỏng.
- Mắt: Rửa ngay lập tức bằng nhiều nước sạch trong ít nhất 15 phút, giữ mí mắt mở. Tìm kiếm sự chăm sóc y tế ngay lập tức.
- Hít phải: Di chuyển nạn nhân đến nơi thoáng khí. Nếu nạn nhân không thở, thực hiện hô hấp nhân tạo. Tìm kiếm sự chăm sóc y tế ngay lập tức.
- Nuốt phải: Không gây nôn. Cho nạn nhân uống nhiều nước hoặc sữa. Tìm kiếm sự chăm sóc y tế ngay lập tức.
FAQ: Giải Đáp Các Câu Hỏi Thường Gặp Về HCL Quỳ Tím
- HCL có thể làm tan vàng không?
- Không, HCL không thể làm tan vàng. Vàng chỉ tan trong nước cường toan (hỗn hợp của axit nitric và axit clohidric).
- HCL có ăn mòn nhựa không?
- Có, HCL có thể ăn mòn một số loại nhựa, đặc biệt là nhựa không bền với axit.
- HCL có dẫn điện không?
- Dung dịch HCL dẫn điện do có các ion H+ và Cl- tự do.
- HCL có độc không?
- HCL là một chất độc hại. Hít phải hơi HCL có thể gây kích ứng đường hô hấp, tiếp xúc với da hoặc mắt có thể gây bỏng.
- HCL có thể dùng để tẩy trắng quần áo không?
- Không nên dùng HCL để tẩy trắng quần áo vì nó có thể làm hỏng vải và gây nguy hiểm cho sức khỏe.
- HCL có phản ứng với thủy tinh không?
- HCL không phản ứng với thủy tinh ở điều kiện thường. Tuy nhiên, HCL có thể ăn mòn thủy tinh ở nhiệt độ cao và nồng độ đặc.
- HCL có thể dùng để làm sạch bồn cầu không?
- Một số sản phẩm làm sạch bồn cầu có chứa HCL, nhưng cần sử dụng cẩn thận và tuân thủ hướng dẫn của nhà sản xuất.
- HCL có tác dụng với nước vôi trong không?
- Có, HCL tác dụng với nước vôi trong (Ca(OH)₂) tạo thành CaCl₂ và H₂O.
- HCL có ăn mòn thép không gỉ không?
- HCL có thể ăn mòn thép không gỉ, đặc biệt là ở nồng độ cao và nhiệt độ cao.
- Làm thế nào để pha loãng HCL an toàn?
- Luôn đổ từ từ HCL vào nước và khuấy đều. Không bao giờ đổ nước vào HCL. Sử dụng đồ bảo hộ khi pha loãng HCL.
Bạn muốn tìm hiểu thêm về xe tải và các vấn đề liên quan đến vận tải? Hãy truy cập XETAIMYDINH.EDU.VN ngay hôm nay để được tư vấn và giải đáp mọi thắc mắc! Đừng ngần ngại liên hệ với chúng tôi qua hotline 0247 309 9988 hoặc ghé thăm địa chỉ Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội để được hỗ trợ tốt nhất. Xe Tải Mỹ Đình luôn sẵn sàng đồng hành cùng bạn trên mọi nẻo đường!

