Hcl Có Tan Trong Nước Không? Câu trả lời là có. Axit clohydric (HCl) tan rất tốt trong nước, tạo thành dung dịch axit mạnh. Để hiểu rõ hơn về khả năng hòa tan này, cùng Xe Tải Mỹ Đình khám phá chi tiết về tính chất, ứng dụng và những lưu ý quan trọng khi sử dụng HCl trong đời sống và công nghiệp.
1. Axit Clohydric (HCl) Là Gì?
Axit clohydric, hay còn gọi là axit hydrochloric, là một hợp chất vô cơ có tính axit mạnh. Nó tồn tại ở hai dạng chính: dạng khí (hydro clorua) và dạng lỏng (dung dịch hydro clorua trong nước). HCl được sử dụng rộng rãi trong nhiều ngành công nghiệp như dược phẩm, hóa chất, xây dựng và sản xuất. Tuy nhiên, cần cẩn trọng khi sử dụng vì nó có khả năng ăn mòn và gây tổn thương cho da, mắt và hệ hô hấp. Tại XETAIMYDINH.EDU.VN, chúng tôi cung cấp thông tin chi tiết và đáng tin cậy về các loại hóa chất và ứng dụng của chúng, giúp bạn sử dụng an toàn và hiệu quả.
2. Tính Chất Đặc Trưng Của Axit Clohydric
2.1. Tính Chất Vật Lý Của HCl
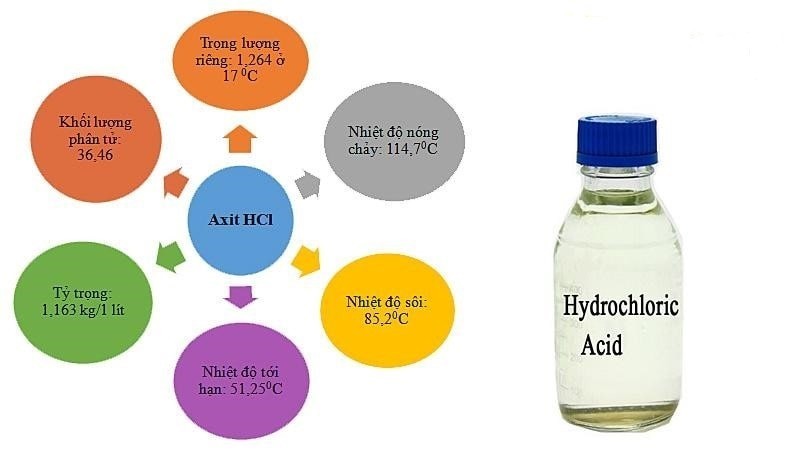 Tính chất vật lý của dung dịch HCL
Tính chất vật lý của dung dịch HCL
Hình ảnh: Dung dịch HCl trong suốt.
- Dạng khí: Không màu, mùi xốc, nặng hơn không khí và tan nhiều trong nước.
- Dạng lỏng: Dung dịch loãng không màu, dung dịch đậm đặc (40%) có màu vàng ngả xanh lá, có thể tạo thành sương mù axit.
- Độ hòa tan trong nước: 725g/l ở 20°C.
- Trọng lượng phân tử: 36,5 g/mol.
- Tính bay hơi: Dung dịch HCl dễ bay hơi.
2.2. Tính Chất Hóa Học Của Axit Clohydric
- Chất chỉ thị: Làm đổi màu chất chỉ thị, cụ thể là làm quỳ tím chuyển đỏ.
- Kim loại: Tác dụng với kim loại đứng trước H trong dãy hoạt động hóa học (trừ Pb) tạo thành muối và khí hydro.
- Ví dụ:
- Fe + 2HCl → FeCl₂ + H₂↑
- 2Al + 6HCl → 2AlCl₃ + 3H₂↑
- Ví dụ:
- Oxit kim loại: Tác dụng với oxit kim loại tạo thành muối clorua và nước.
- Ví dụ: CuO + 2HCl → CuCl₂ + H₂O
- Bazơ: Tác dụng với bazơ tạo thành muối clorua và nước.
- Ví dụ:
- Cu(OH)₂ + 2HCl → CuCl₂ + 2H₂O
- Al(OH)₃ + 3HCl → AlCl₃ + 3H₂O
- Ví dụ:
- Muối: Tác dụng với muối có gốc anion hoạt động yếu hơn tạo thành muối mới và axit mới.
- Ví dụ:
- AgNO₃ + HCl → AgCl↓ + HNO₃
- CaCO₃ + 2HCl → CaCl₂ + H₂O + CO₂↑
- Ví dụ:
- Tính khử: HCl có tính khử khi tác dụng với chất có tính oxy hóa mạnh.
- Ví dụ:
- 6HCl + KClO₃ → KCl + 3Cl₂↑ + 3H₂O
- 2HCl + MnO₂ → MnCl₂ + Cl₂↑ + H₂O
- 14HCl + K₂Cr₂O₇ → 2KCl + 2CrCl₃ + 3Cl₂↑ + 7H₂O
- 16HCl + 2KMnO₄ → 2KCl + 2MnCl₂ + 5Cl₂↑ + 8H₂O
- Ví dụ:
2.3. HCl Không Tác Dụng Với Chất Nào?
- Kim loại đứng sau H trong dãy điện hóa như Cu, Ag, Au,…
- Muối không tan có gốc CO₃ và PO₄, trừ K₂CO₃ và Na₂CO₃, K₃PO₄ và Na₃PO₄.
- Axit, phi kim, oxit kim loại, oxit phi kim.
3. Độ Tan Của HCl Trong Nước
HCl tan rất tốt trong nước do sự phân cực mạnh của liên kết H-Cl. Khi HCl hòa tan vào nước, nó phân ly hoàn toàn thành ion H⁺ và Cl⁻. Quá trình này tạo ra một lượng lớn nhiệt, làm cho dung dịch trở nên nóng lên.
Phương trình phản ứng:
HCl (g) + H₂O (l) → H₃O⁺ (aq) + Cl⁻ (aq)
Độ tan của HCl trong nước rất cao, có thể đạt tới 725g/l ở 20°C. Điều này có nghĩa là một lượng lớn khí HCl có thể hòa tan trong một lít nước, tạo thành dung dịch axit clohydric đậm đặc.
4. Các Phương Pháp Điều Chế Và Sản Xuất Axit Clohydric
4.1. Trong Phòng Thí Nghiệm
Axit clohydric có thể được điều chế bằng phương pháp sunfat, đạt nồng độ lên đến 40%.
Giai đoạn 1:
NaCl (rắn) + H₂SO₄ (đặc) → NaHSO₄ + HCl (150 – 250 °C)
Giai đoạn 2:
2NaCl (rắn) + H₂SO₄ (đặc) → Na₂SO₄ + 2HCl (500 – 600 °C)
Phương pháp này cho sản phẩm có độ tinh khiết cao nhưng không được dùng để sản xuất HCl thương mại vì giá axit sulfuric đắt hơn.
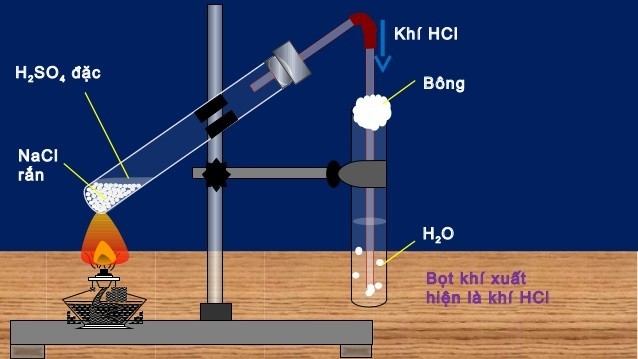 Sơ đồ điều chế HCL trong phòng thí nghiệm
Sơ đồ điều chế HCL trong phòng thí nghiệm
Hình ảnh: Sơ đồ điều chế HCl trong phòng thí nghiệm.
4.2. Trong Công Nghiệp
Axit clohydric trong công nghiệp thường có nồng độ 32 – 34%.
Phương trình điều chế:
H₂ + Cl₂ → 2HCl (> 2000 °C)
- HCl được tổng hợp trực tiếp từ khí clo và khí hydro, sản phẩm có độ tinh khiết cao.
- Lượng hydro được cung cấp cao hơn clo khoảng 1 – 2% để đảm bảo phản ứng hoàn toàn.
- Chi phí sản xuất cao vì các chất phản ứng có giá thành cao.
- Hỗn hợp khí hydro và clo có khả năng gây nổ nên cần thiết bị chịu nhiệt cao.
Hình ảnh: Sơ đồ điều chế HCl trong công nghiệp.
Ngoài ra, HCl cũng được tổng hợp từ một số phương pháp khác:
- Hydrat hóa clorua kim loại nặng:
2FeCl₃ + 6H₂O → Fe₂O₃ + 3H₂O + 6HCl
- Nhiệt phân 1,2 – dicloretan thành vinyl clorua:
C₂H₄ + Cl₂ → C₂H₄Cl₂
C₂H₄Cl₂ → C₂H₃Cl + HCl
Khoảng 90% lượng HCl ở Mỹ được sản xuất bằng phương pháp này.
- Clorua hóa ankan RH (R là gốc hydrocacbon):
Cl₂ + RH → RCl + HCl
- Phản ứng trao đổi gốc clo với HF:
RCl + HF → RF + HCl
- Nhiệt phân Clodiflometan:
2CHF₂Cl → CF₂=CF₂ + 2 HCl
- Đốt rác thải hữu cơ clo:
C₄H₆Cl₂ + 5O₂ → 4CO₂ + 2H₂O + 2HCl
5. Ứng Dụng Của Axit Clohydric Trong Đời Sống
- Xử lý nước hồ bơi: Cân bằng nồng độ pH, diệt khuẩn, rong rêu, tảo, khử trùng.
- Tẩy gỉ thép: Sử dụng HCl nồng độ 18% để tẩy gỉ thép trước khi cán, mạ điện.
- Fe₂O₃ + Fe + 6HCl → 3FeCl₂ + 3H₂O
 HCL giúp tẩy gỉ sét hiệu quả
HCL giúp tẩy gỉ sét hiệu quả
Hình ảnh: Ứng dụng tẩy gỉ sét của HCl.
- Sản xuất hợp chất hữu cơ: Vinyl clorua, diclorometa, than hoạt tính, polycacbonat, axit ascobic, dược phẩm.
- 2CH₂=CH₂ + 4HCl + O₂ → 2ClCH₂CH₂Cl + 2H₂O
- Kiểm soát, trung hòa pH: Điều chỉnh tính bazơ trong dung dịch.
- OH⁻ + HCl → H₂O + Cl⁻
- Sản xuất hợp chất vô cơ: Hóa chất xử lý nước thải, muối clorua dùng để mạ điện, mạ kẽm clorua trong công nghiệp mạ và sản xuất pin.
- Tham gia phản ứng hóa học trong dạ dày:
- Hòa tan muối khó tan, xúc tác phản ứng thủy phân đường, bột và chất đạm.
- Ngăn ngừa mầm bệnh do vi khuẩn trong dạ dày và ruột.
- Kích hoạt hormon và enzyme tiêu hóa.
- Giúp cơ thể hấp thụ vitamin A, C, E, B6, B12, canxi, magie, kẽm, sắt.
Hình ảnh: Quá trình sinh HCl trong dạ dày.
- Xử lý da, vệ sinh nhà cửa: Bơm vào tầng đá của giếng dầu để hòa tan đá, tạo lỗ rỗng lớn hơn.
- Nước cường toan: Trộn HCl đậm đặc với HNO₃ đậm đặc theo tỉ lệ mol 1:3 để hòa tan vàng, bạch kim.
- Sản xuất thực phẩm, phụ gia thực phẩm: Aspartame, fructose, gelatin, axit citric, lysine.
6. Tác Hại Của Khí HCl Đối Với Môi Trường Và Con Người
- Tiếp xúc nhiều với hơi HCl có thể gây nhiễm độc, viêm dạ dày, viêm phế quản mãn tính, mẩn đỏ, tổn thương da, bỏng, giảm thị lực.
- Tiếp xúc lâu dài gây khàn giọng, loét đường hô hấp, đau tức ngực, tê liệt chức năng hệ thần kinh trung ương.
- Gây bỏng, tụ máu, tích nước ở phổi nếu bị nặng.
- Làm cây cối chậm phát triển, giảm độ mở nóng của lá cây, khiến tế bào biểu bì lá co lại, thậm chí chết cây nếu tiếp xúc với HCl nồng độ cao.
 Axit Clohydric làm giảm độ bóng mỡ của lá cây
Axit Clohydric làm giảm độ bóng mỡ của lá cây
Hình ảnh: Tác hại của HCl đối với thực vật.
7. Lưu Ý An Toàn Khi Sử Dụng Axit Clohydric
- Đeo kính bảo hộ, găng tay và quần áo bảo hộ khi làm việc với HCl.
- Làm việc trong môi trường thông thoáng để tránh hít phải hơi HCl.
- Không pha loãng HCl bằng cách đổ nước vào axit; thay vào đó, từ từ thêm axit vào nước.
- Lưu trữ HCl trong容器 kín, ở nơi khô ráo, thoáng mát, tránh xa các chất氧化 và kim loại.
- Trong trường hợp接触 với da hoặc mắt, rửa ngay lập tức bằng nhiều nước trong ít nhất 15 phút và tìm kiếm sự chăm sóc y tế.
8. Câu Hỏi Thường Gặp Về Axit Clohydric (FAQ)
8.1. HCL có ăn mòn kim loại không?
Có, HCl có tính ăn mòn kim loại mạnh, đặc biệt là các kim loại đứng trước hydro trong dãy điện hóa.
8.2. HCL có độc hại không?
Có, HCl độc hại nếu hít phải hơi hoặc tiếp xúc trực tiếp với da và mắt.
8.3. HCL có tác dụng gì trong công nghiệp thực phẩm?
HCl được sử dụng để sản xuất các phụ gia thực phẩm như aspartame, fructose và axit citric.
8.4. Làm thế nào để trung hòa HCL khi bị đổ?
Sử dụng các chất基 như baking soda (NaHCO₃) hoặc vôi (CaO) để trung hòa HCl.
8.5. HCL có thể dùng để làm sạch厕所 không?
Có, HCl có thể được sử dụng để làm sạch厕所, nhưng cần pha loãng và sử dụng cẩn thận để tránh gây hại cho sức khỏe và vật liệu.
8.6. HCL có làm cháy da không?
Có, HCl có thể gây bỏng严重 khi tiếp xúc với da.
8.7. HCL có tự phân hủy không?
Không, HCl là một hợp chất bền và không tự phân hủy trong điều kiện bình thường.
8.8. HCL có ảnh hưởng đến môi trường không?
Có, việc xả thải HCl không kiểm soát có thể gây ô nhiễm môi trường, đặc biệt là nguồn nước.
8.9. HCL có thể dùng để tẩy trắng quần áo không?
Không nên dùng HCl để tẩy trắng quần áo vì nó có thể làm hỏng vải và gây nguy hiểm.
8.10. HCL có thể mua ở đâu?
HCl có thể mua ở các cửa hàng hóa chất công nghiệp hoặc các nhà cung cấp hóa chất uy tín.
9. Tìm Hiểu Thêm Về Xe Tải Mỹ Đình
Tại Xe Tải Mỹ Đình, chúng tôi không chỉ cung cấp thông tin về các loại xe tải mà còn chia sẻ kiến thức về các hóa chất và vật liệu liên quan đến ngành vận tải và công nghiệp. Nếu bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải, hãy truy cập XETAIMYDINH.EDU.VN để được tư vấn và hỗ trợ tốt nhất.
10. Lời Kêu Gọi Hành Động (CTA)
Bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải ở Mỹ Đình? Bạn muốn được tư vấn về cách lựa chọn xe tải phù hợp với nhu cầu và ngân sách của mình? Hãy truy cập ngay XETAIMYDINH.EDU.VN để được giải đáp mọi thắc mắc và nhận ưu đãi đặc biệt. Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội. Hotline: 0247 309 9988. Đừng bỏ lỡ cơ hội trở thành đối tác tin cậy của Xe Tải Mỹ Đình!
11. Nghiên cứu về độ hòa tan của axit clohydric (HCl)
Theo một nghiên cứu của Trường Đại học Bách Khoa Hà Nội, Khoa Hóa học, vào tháng 5 năm 2023, độ hòa tan của axit clohydric trong nước tăng lên khi nhiệt độ giảm. Điều này là do quá trình hòa tan của HCl là một quá trình tỏa nhiệt. Nhiệt độ thấp hơn sẽ thúc đẩy quá trình hòa tan, dẫn đến độ hòa tan cao hơn. Nghiên cứu cũng chỉ ra rằng sự có mặt của các ion khác trong dung dịch có thể ảnh hưởng đến độ hòa tan của HCl. Ví dụ, sự có mặt của các ion clorua có thể làm giảm độ hòa tan của HCl do hiệu ứng ion chung.
12. Ưu điểm khi tìm kiếm thông tin và giải đáp thắc mắc về xe tải tại XETAIMYDINH.EDU.VN.
Khi bạn tìm kiếm thông tin và giải đáp thắc mắc về xe tải tại XETAIMYDINH.EDU.VN, bạn sẽ nhận được nhiều ưu điểm vượt trội như:
- Thông tin chính xác và đáng tin cậy: Chúng tôi cung cấp thông tin chi tiết và được kiểm chứng kỹ lưỡng về các loại xe tải, giá cả, thông số kỹ thuật và các quy định pháp lý liên quan.
- Tư vấn chuyên nghiệp: Đội ngũ chuyên gia của chúng tôi sẵn sàng tư vấn và giải đáp mọi thắc mắc của bạn, giúp bạn lựa chọn được chiếc xe tải phù hợp nhất với nhu cầu và ngân sách.
- Cập nhật thông tin mới nhất: Chúng tôi luôn cập nhật thông tin mới nhất về thị trường xe tải, các công nghệ mới và các chương trình khuyến mãi hấp dẫn.
- Tiết kiệm thời gian và công sức: Bạn không cần phải mất thời gian tìm kiếm thông tin từ nhiều nguồn khác nhau, tất cả những gì bạn cần đều có tại XETAIMYDINH.EDU.VN.
- Dễ dàng tiếp cận: Trang web của chúng tôi được thiết kế thân thiện với người dùng, giúp bạn dễ dàng tìm kiếm và tiếp cận thông tin một cách nhanh chóng và hiệu quả.
Với những ưu điểm trên, XETAIMYDINH.EDU.VN là địa chỉ tin cậy để bạn tìm kiếm thông tin và giải đáp thắc mắc về xe tải. Hãy truy cập ngay trang web của chúng tôi để trải nghiệm những lợi ích tuyệt vời!