HCL, hay axit clohidric, chắc chắn sẽ làm đổi màu quỳ tím. Nó biến quỳ tím từ màu tím sang màu đỏ do tính chất axit mạnh của nó. Cùng Xe Tải Mỹ Đình tìm hiểu chi tiết về tác động này và những ứng dụng quan trọng của HCL trong đời sống và công nghiệp, giúp bạn hiểu rõ hơn về loại axit này.
1. Axit Clohidric (HCl) Là Gì?
Axit clohidric, hay còn gọi là HCl, là một axit vô cơ mạnh được tạo thành từ sự hòa tan của khí hidro clorua trong nước. Công thức hóa học của nó là HCl, cho thấy mỗi phân tử axit clohidric chứa một nguyên tử hydro (H) và một nguyên tử clo (Cl). Cả hidro clorua và axit clohidric đều có tính ăn mòn cao.
Công thức hóa học: H₂ + Cl₂ → 2HCl
 Axit Clohidric (HCl)
Axit Clohidric (HCl)
Ảnh minh họa Axit Clohidric (HCl)
2. HCL Có Làm Đổi Màu Quỳ Tím Không?
HCL chắc chắn làm đổi màu quỳ tím thành màu đỏ. Đây là một phản ứng hóa học cơ bản và dễ nhận biết, thường được sử dụng để xác định tính axit của một dung dịch. Sự đổi màu này xảy ra do HCL là một axit mạnh, có khả năng cung cấp ion H+ trong dung dịch, làm thay đổi cấu trúc phân tử của chất chỉ thị màu quỳ tím.
2.1. Cơ chế phản ứng
Dung dịch HCL có khả năng làm quỳ tím chuyển màu vì axit có khả năng cho ion H+. Axit clohidric là một axit mạnh và có khả năng cung cấp các ion Hydro. Theo nghiên cứu của PGS.TS Trần Thị Đà, Khoa Hóa học, Đại học Khoa học Tự nhiên Hà Nội, năm 2020, HCL phân ly hoàn toàn trong nước, giải phóng ion H+ mạnh mẽ, gây ra sự đổi màu quỳ tím.
2.2. Lưu ý quan trọng
Phản ứng đổi màu chỉ xảy ra ở dạng dung dịch. Khi HCL tồn tại ở dạng khí, nó không làm đổi màu quỳ tím. Điều này là do cần có nước để HCL phân ly thành ion H+ và Cl-, từ đó mới có thể tương tác với chất chỉ thị màu.
 Phản ứng đổi màu quỳ tím
Phản ứng đổi màu quỳ tím
Ảnh minh họa phản ứng đổi màu quỳ tím
3. HCL Là Axit Mạnh Hay Yếu?
HCL là một axit mạnh. Trong dung dịch nước, hợp chất này phân ly mạnh thành ion hydronium (H3O+) và ion clorua (Cl-). Theo nghiên cứu của Đại học Bách Khoa Hà Nội, khoa Hóa, năm 2023, trong dung dịch loãng, axit clohidric tan trong nước và phân li hoàn toàn, chứng minh tính chất axit mạnh của nó.
Phương trình hóa học: HCl + H₂O → H₃O+ + Cl-
4. Độ pH Của HCL Là Bao Nhiêu?
Độ pH của HCL phụ thuộc vào nồng độ của dung dịch. Để biết chính xác nồng độ pH, bạn cần sử dụng các dụng cụ đo chuyên dụng.
4.1. Sử dụng máy đo pH chuyên dụng
Máy đo pH giúp xác định chính xác độ pH của dung dịch HCL. Có nhiều loại máy đo pH trên thị trường, bạn có thể chọn loại phù hợp với nhu cầu sử dụng. Một trong những sản phẩm được quan tâm hiện nay là máy đo pH SPT.
Hướng dẫn sử dụng máy đo pH SPT:
- Cắm đầu đo vào máy sao cho khớp và xoay sang phải. Lấy đầu đo ra khỏi lọ bảo quản, vẩy nhẹ cho hết nước rồi cắm vào lọ pH 7.00.
- Mở nắp chứa pin để bật công tắc máy về ON.
- Dùng tuốc nơ vít nhỏ để vặn ốc bên trái nhằm điều chỉnh pH về 7.00, chờ 1 phút rồi tắt máy về OFF. Rửa đầu đo bằng nước cất và điều chỉnh đầu đo vào lọ pH 4.00, sau đó bật công tắc về ON.
- Dùng tuốc nơ vít để vặn ốc bên phải, sau đó điều chỉnh pH về đúng 4.00, chờ trong 1 phút để ổn định rồi tắt máy.
 Sử dụng máy đo pH
Sử dụng máy đo pH
Ảnh minh họa sử dụng máy đo pH
4.2. Sử dụng bộ test thử nước
Bộ test thử nước cũng là một cách để đo nồng độ pH của dung dịch HCL. Bộ test này thường có hai lọ dung dịch: phenol để đo pH và oto để đo clo dư.
Hướng dẫn sử dụng bộ test thử nước:
- Cho axit clohidric vào lọ chứa. Nhỏ 5 giọt phenol vào ống nghiệm và lắc nhẹ trong khoảng 1 phút.
- Quan sát màu của ống nghiệm so với bảng màu để xác định nồng độ pH của HCL.
 Sử dụng bộ test thử nước
Sử dụng bộ test thử nước
Ảnh minh họa sử dụng bộ test thử nước
5. Tính Chất Vật Lý Của HCL
Hiểu rõ tính chất vật lý của HCL giúp bạn sử dụng và bảo quản hóa chất này một cách an toàn và hiệu quả.
- HCL là hợp chất vô cơ, có tính axit mạnh.
- Axit tồn tại ở hai dạng chính: dạng lỏng và khí.
- Khi tồn tại ở dạng lỏng, hóa chất không màu, có mùi hắc khó chịu.
- HCL có khả năng hòa tan tốt trong nước, tạo thành dung dịch axit clohidric.
6. Tính Chất Hóa Học Của HCL
HCL là một axit mạnh, mang đầy đủ các tính chất hóa học của một axit.
6.1. Tác dụng với kim loại
H2 sẽ được giải phóng và muối Clorua sẽ được tạo thành. Hợp chất này có thể tác dụng với hầu hết các kim loại.
Phương trình hóa học:
- Na + 2HCl → NaCl + H₂
- Mg + HCl → MgCl₂ + H₂
- Fe + 2HCl → FeCl₂ + H₂
6.2. Tác dụng với oxit kim loại
Oxit kim loại là hợp chất chứa một kim loại và một hoặc nhiều nguyên tử O₂. Khi tham gia phản ứng với oxit kim loại, sản phẩm tạo thành sẽ là muối và nước.
Phương trình hóa học:
- Na₂O + 2HCl → 2NaCl + H₂O
- MgO + 2HCl → MgCl₂ + H₂O
- V₂O₅ + 10HCl → 2VCl + 4Cl₂ + 5H₂O
- AgO + 2HCl → AgCl₂ + H₂O
6.3. Tác dụng với oxit bazo
Kết quả của quá trình phản ứng này sẽ là muối và nước.
Phương trình hóa học:
- NaOH + HCl → NaCl + H₂O
- Ca(OH)₂ + 2HCl → 2H₂O + CaCl₂
- Cu(OH)₂ + 2HCl → CuCl₂ + H₂O
- Fe(OH)₃ + 3HCl → FeCl₃ + 3H₂O
- Ba(OH)₂ + 2HCl → BaCl₂ + 2H₂O
6.4. Tác dụng với muối
Muối là hợp chất mà khi tan trong nước có thể phân li thành cation kim loại (hoặc cation NH₄+) và anion gốc axit. Khi HCL tác dụng với nước sẽ tạo ra muối mới và axit mới. Sản phẩm tạo thành sẽ có chất khí bay lên hoặc kết tủa.
Phương trình hóa học:
- 2NaCl + 2HCl → 2NaCl₂ + H₂
- Na₂SO₄ + 2HCl → 2NaCl + H₂SO₄
- NaHCO₃ + HCl → NaCl + CO₂ + H₂O
- K₂SO₄ + 2HCl → 2KCl + H₂SO₄
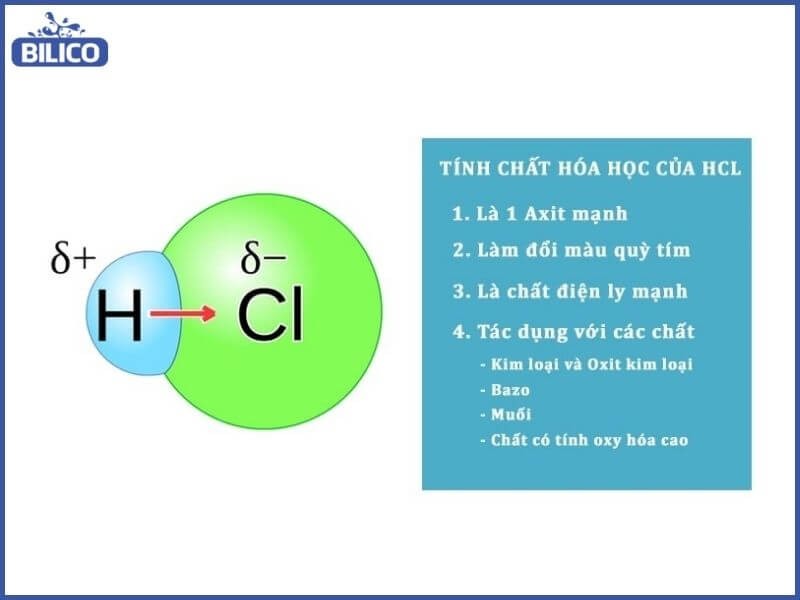 Tính chất hóa học của HCL
Tính chất hóa học của HCL
Ảnh minh họa tính chất hóa học của HCL
7. HCL Không Tác Dụng Với Chất Nào?
Mặc dù HCL có nhiều phản ứng hóa học, nhưng nó không tác dụng với tất cả các chất. Dưới đây là danh sách các chất mà HCL không tham gia phản ứng:
- Không tác dụng với một số kim loại đứng sau H₂ trong bảng tuần hoàn hóa học như Đồng (Cu), Thủy ngân (Hg), Bạc (Ag), Vàng (Au), Platin (Pt).
- Không tác dụng với các hợp chất muối không tan có gốc CO₃, PO₄ (Ngoại trừ K₂CO₃ và Na₂CO₃, K₃PO₄ và Na₃PO₄).
- Không tác dụng được với tất cả các axit.
- Không tác dụng với phi kim.
- Không tác dụng được với một số oxit kim loại.
- Không tác dụng với oxit phi kim.
 HCL không tác dụng với chất nào
HCL không tác dụng với chất nào
Ảnh minh họa HCL không tác dụng với chất nào
8. Ứng Dụng Của Axit HCL
HCL có tính ứng dụng cao trong đời sống và công nghiệp.
- Sản xuất Clorua, phân bón và thuốc nhuộm, mạ điện: HCL được sử dụng để sản xuất nhiều hợp chất quan trọng trong các ngành công nghiệp khác nhau.
- Công nghệ nhiếp ảnh, dệt may và cao su: Trong ngành dệt may, HCL được sử dụng trong quá trình xử lý vải và làm sạch. Trong ngành cao su, nó được sử dụng trong quá trình sản xuất và chế biến cao su.
- Trung hòa các tác nhân kiềm và chất tẩy trắng: HCL được sử dụng để trung hòa các chất kiềm trong nhiều quy trình công nghiệp và phòng thí nghiệm. Nó cũng được sử dụng như một chất tẩy trắng trong một số ứng dụng.
- Sản xuất chất tẩy rửa gia dụng: HCL là thành phần quan trọng trong nhiều sản phẩm tẩy rửa gia dụng, giúp loại bỏ các vết bẩn cứng đầu và làm sạch bề mặt.
- Chế biến thực phẩm: HCL được sử dụng trong ngành công nghiệp chế biến thực phẩm để sản xuất bánh quy giòn, ngũ cốc, nước sốt cà chua. Nó cũng được sử dụng như một chất axit hóa để tăng hương vị và giảm tình trạng hư hỏng trong nước sốt, nước ép rau củ.
- Sản xuất hóa chất khử trùng, chất diệt mối mọt: HCL được sử dụng để sản xuất các hóa chất khử trùng và diệt mối mọt, giúp bảo vệ các công trình xây dựng và đồ đạc khỏi sự phá hoại của mối mọt.
- Vệ sinh, khử trùng bể bơi: HCL được dùng để vệ sinh, khử trùng bể bơi và giúp cân bằng nồng độ hóa chất trong bể ở mức tiêu chuẩn, đảm bảo an toàn cho sức khỏe người bơi.
Thông tin liên hệ Xe Tải Mỹ Đình:
- Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội
- Hotline: 0247 309 9988
- Trang web: XETAIMYDINH.EDU.VN
9. Những Lưu Ý Quan Trọng Khi Sử Dụng HCL
Axit clohidric (HCL) là một hóa chất mạnh và có thể gây nguy hiểm nếu không được sử dụng đúng cách. Để đảm bảo an toàn, hãy luôn tuân thủ các biện pháp phòng ngừa sau:
- Đeo kính bảo hộ: Để bảo vệ mắt khỏi bị tổn thương do bắn hoặc tiếp xúc với hơi axit.
- Sử dụng găng tay bảo hộ: Để bảo vệ da tay khỏi bị ăn mòn hoặc kích ứng.
- Mặc quần áo bảo hộ: Để bảo vệ da khỏi tiếp xúc trực tiếp với axit.
- Làm việc trong khu vực thông gió tốt: Để tránh hít phải hơi axit, gây kích ứng đường hô hấp.
- Luôn thêm axit vào nước, không làm ngược lại: Để tránh phản ứng tỏa nhiệt mạnh có thể gây bắn axit.
- Không trộn HCL với các hóa chất khác, đặc biệt là chất oxy hóa mạnh: Để tránh tạo ra các phản ứng nguy hiểm, gây cháy nổ hoặc tạo ra khí độc.
- Bảo quản HCL trong容器chuyên dụng, kín đáo và tránh xa tầm tay trẻ em: Để ngăn ngừa tai nạn và đảm bảo an toàn.
- Đọc kỹ hướng dẫn sử dụng và tuân thủ các quy định an toàn của nhà sản xuất: Để sử dụng HCL một cách an toàn và hiệu quả.
- Trong trường hợp bị axit bắn vào da hoặc mắt, rửa ngay lập tức bằng nhiều nước sạch và tìm kiếm sự trợ giúp y tế: Để giảm thiểu tổn thương và ngăn ngừa biến chứng.
10. Câu Hỏi Thường Gặp Về HCL (FAQ)
10.1. HCL có ăn mòn kim loại không?
Có, HCL là một axit mạnh và có khả năng ăn mòn nhiều loại kim loại, đặc biệt là các kim loại hoạt động hóa học mạnh.
10.2. HCL có độc hại không?
Có, HCL có thể gây kích ứng và ăn mòn da, mắt và hệ hô hấp. Hít phải hơi HCL có thể gây tổn thương phổi.
10.3. HCL được sử dụng để làm gì trong công nghiệp?
HCL được sử dụng rộng rãi trong nhiều ngành công nghiệp, bao gồm sản xuất hóa chất, xử lý kim loại, chế biến thực phẩm và sản xuất dược phẩm.
10.4. Làm thế nào để pha loãng HCL an toàn?
Luôn thêm HCL vào nước từ từ và khuấy đều. Không bao giờ đổ nước vào HCL vì có thể gây ra phản ứng tỏa nhiệt mạnh và bắn axit.
10.5. HCL có thể được lưu trữ trong容器nào?
HCL nên được lưu trữ trong các容器làm từ vật liệu chịu axit như polyethylene (PE) hoặc polypropylene (PP).
10.6. HCL có tác dụng với nhựa không?
HCL có thể làm hỏng hoặc ăn mòn một số loại nhựa. Nên sử dụng các loại nhựa chịu axit để chứa HCL.
10.7. HCL có thể dùng để tẩy rửa gỉ sét không?
Có, HCL có thể được sử dụng để tẩy rửa gỉ sét trên kim loại, nhưng cần pha loãng và sử dụng cẩn thận để tránh ăn mòn kim loại.
10.8. HCL có ảnh hưởng đến môi trường không?
Nếu không được xử lý đúng cách, HCL có thể gây ô nhiễm môi trường, đặc biệt là ô nhiễm nguồn nước.
10.9. HCL có thể dùng trong thực phẩm không?
Có, HCL được sử dụng trong một số quy trình chế biến thực phẩm với vai trò là chất điều chỉnh độ axit hoặc chất xúc tác. Tuy nhiên, nồng độ và cách sử dụng phải tuân thủ các quy định an toàn thực phẩm.
10.10. HCL có phải là axit cloric không?
Không, HCL là axit clohidric (hydrochloric acid), còn axit cloric có công thức là HClO3. Đây là hai loại axit khác nhau với tính chất và ứng dụng khác nhau.
Nếu bạn còn thắc mắc hoặc cần tư vấn chi tiết hơn về các loại xe tải và dịch vụ liên quan, đừng ngần ngại liên hệ với Xe Tải Mỹ Đình qua hotline 0247 309 9988 hoặc truy cập website XETAIMYDINH.EDU.VN để được hỗ trợ tận tình! Chúng tôi luôn sẵn sàng giải đáp mọi thắc mắc của bạn và giúp bạn tìm được chiếc xe tải ưng ý nhất!

