H2co3 Là Gì? Đây là câu hỏi mà nhiều người thắc mắc. Axit cacbonic (H2CO3) là một hợp chất hóa học quan trọng, đóng vai trò thiết yếu trong nhiều quá trình tự nhiên và ứng dụng công nghiệp. Tại XETAIMYDINH.EDU.VN, chúng tôi sẽ cung cấp cho bạn một cái nhìn toàn diện về axit cacbonic, từ định nghĩa, tính chất, ứng dụng đến những điều thú vị liên quan. Hãy cùng khám phá mọi khía cạnh của hợp chất này để hiểu rõ hơn về vai trò và tầm quan trọng của nó trong cuộc sống.
1. H2CO3 Là Gì? Khái Niệm Cơ Bản Về Axit Cacbonic
Axit cacbonic (H2CO3) là một axit yếu được hình thành khi carbon dioxide (CO2) hòa tan trong nước (H2O). Công thức hóa học của nó là H2CO3. Mặc dù axit cacbonic tồn tại ở nồng độ thấp trong dung dịch, nó đóng vai trò quan trọng trong nhiều quá trình hóa học và sinh học.
Công thức hóa học: H2CO3
Khối lượng phân tử: 62.03 g/mol
2. Lịch Sử Phát Hiện Và Nghiên Cứu Về Axit Cacbonic
Axit cacbonic được các nhà khoa học biết đến lần đầu tiên trong nước khoáng do vị chua đặc trưng. Năm 1597, Andreas Libavius đã công bố về axit cacbonic trong luận án của mình. Johan Baptista van Helmont cũng mô tả chi tiết quá trình lên men và tác dụng của axit khoáng sản trên đá cacbon.
3. Trạng Thái Tự Nhiên Và Tính Chất Vật Lý Của Axit Cacbonic
3.1. Sự Tồn Tại Trong Tự Nhiên
Axit cacbonic có mặt ở khắp nơi trong tự nhiên, từ đá và hang động đến than đá, thiên thạch, núi lửa, mưa axit, nước ngầm, đại dương, biển, hồ, sông và thực vật.
 Axit cacbonic hình thành trong tự nhiên qua nhiều quá trình
Axit cacbonic hình thành trong tự nhiên qua nhiều quá trình
Alt: Axit cacbonic được tạo thành trong tự nhiên thông qua quá trình hòa tan CO2 trong nước mưa.
H2CO3 cũng tồn tại trong cơ thể con người. Khí CO2 trong máu kết hợp với nước tạo thành axit cacbonic, sau đó được thở ra qua phổi. Ngày nay, axit cacbonic còn được sử dụng trong nhiều loại nước giải khát, như cola.
3.2. Tính Chất Vật Lý
- Tính tan: Khí CO2 hòa tan trong nước mưa và nước tự nhiên (khoảng 90 cm3 CO2 hòa tan trong 1000 cm3 nước).
- Trạng thái: Axit cacbonic chỉ tồn tại trong dung dịch nước và không thể cô lập thành hợp chất tinh khiết.
4. Tính Chất Hóa Học Của Axit Cacbonic
4.1. Tính Axit Yếu
Axit cacbonic (H2CO3) có tính axit nhưng rất yếu, làm quỳ tím chuyển màu đỏ nhạt. Điều này cho thấy khả năng phân ly ion H+ của H2CO3 rất hạn chế.
4.2. Tính Không Bền
H2CO3 là một axit không bền, khó tồn tại trong không khí. Trong điều kiện thường, axit cacbonic tạo thành trong các phản ứng hóa học lập tức bị phân hủy thành CO2 và nước theo phương trình:
H2CO3 → CO2 + H2O
4.3. Khả Năng Tạo Muối
Là một axit lưỡng cực, axit cacbonic có thể tạo thành hai loại muối: cacbonat và bicacbonat.
- Bổ sung bazơ vào một lượng dư axit cacbonic sẽ tạo ra muối bicarbonate.
- Bổ sung bazơ dư thừa vào axit cacbonic sẽ tạo ra muối cacbonat.
4.4. Độ An Toàn
Axit cacbonic không được coi là độc hại hoặc nguy hiểm. Tuy nhiên, tiếp xúc với nồng độ cao có thể gây kích ứng mắt và đường hô hấp.
5. Điều Chế Axit Cacbonic Như Thế Nào?
Axit cacbonic là một axit rất yếu và gần như không tồn tại được lâu. Người ta điều chế axit cacbonic bằng cách cho CO2 phản ứng với nước theo phương trình sau:
H2O + CO2 → H2CO3
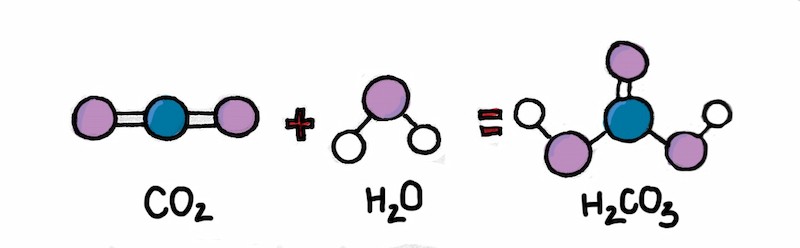 Quá trình điều chế axit cacbonic trong phòng thí nghiệm
Quá trình điều chế axit cacbonic trong phòng thí nghiệm
Alt: Phương trình hóa học minh họa quá trình điều chế axit cacbonic từ CO2 và nước.
Phản ứng này diễn ra chậm và thuận nghịch, do đó nồng độ H2CO3 trong dung dịch thường rất thấp.
6. Ứng Dụng Của Axit Cacbonic Trong Tự Nhiên Và Đời Sống
6.1. Trong Tự Nhiên
H2CO3 có thể hòa tan đá vôi, dẫn đến sự hình thành của canxi bicacbonat Ca(HCO3)2. Đây chính là lý do tạo nên nhiều đặc điểm của đá vôi như măng đá và nhũ đá. Theo nghiên cứu của Trường Đại học Khoa học Tự nhiên Hà Nội, quá trình hòa tan đá vôi bởi axit cacbonic đóng vai trò quan trọng trong việc hình thành các hệ thống hang động karst ở Việt Nam (Trường Đại học Khoa học Tự nhiên Hà Nội, 2018).
6.2. Trong Đời Sống
- Axit cacbonic (H2CO3) được sử dụng trong nhiều loại nước giải khát có gas như cola, soda, bia.
- Axit cacbonic còn được tìm thấy trong thực phẩm lên men dưới dạng chất thải được tạo ra bởi vi khuẩn ăn thức ăn (Theo Michelle McGuire trong Khoa học dinh dưỡng). Ví dụ về các loại thực phẩm lên men thường ăn là nước tương, súp miso, dưa cải, kim chi và sữa chua.
- Axit cacbonic đóng vai trò trong tính axit cao của soda, nhưng hàm lượng đường tinh luyện và axit photphoric là nguyên nhân chính gây ra tính axit nói trên.
- H2CO3 cũng được sử dụng trong nhiều lĩnh vực khác như dược phẩm, mỹ phẩm, phân bón, chế biến thực phẩm, thuốc gây mê, v.v.
7. Vai Trò Của Axit Cacbonic Trong Các Hệ Sinh Thái
7.1. Điều Hòa pH Của Nước
Axit cacbonic và các muối cacbonat/bicacbonat đóng vai trò quan trọng trong việc duy trì sự ổn định pH của nước tự nhiên, giúp bảo vệ các sinh vật sống trong môi trường nước. Theo báo cáo của Bộ Tài nguyên và Môi trường, hệ đệm cacbonat là một trong những hệ đệm quan trọng nhất trong các hệ sinh thái nước ở Việt Nam (Bộ Tài nguyên và Môi trường, 2020).
7.2. Chu Trình Cacbon
Axit cacbonic là một mắt xích quan trọng trong chu trình cacbon toàn cầu. Nó giúp vận chuyển cacbon từ khí quyển vào đại dương và ngược lại, ảnh hưởng đến khí hậu và thời tiết trên Trái Đất.
8. Ảnh Hưởng Của Axit Cacbonic Đến Sức Khỏe Con Người
8.1. Tác Động Tích Cực
- Hỗ trợ tiêu hóa: Axit cacbonic trong nước giải khát có gas có thể kích thích tiêu hóa và giảm cảm giác đầy bụng.
- Cung cấp khoáng chất: Nước khoáng chứa axit cacbonic có thể cung cấp một số khoáng chất cần thiết cho cơ thể.
8.2. Tác Động Tiêu Cực
- Ăn mòn men răng: Tiêu thụ quá nhiều đồ uống có gas chứa axit cacbonic có thể gây ăn mòn men răng, dẫn đến sâu răng.
- Gây khó chịu cho dạ dày: Một số người có thể cảm thấy khó chịu hoặc ợ hơi sau khi uống đồ uống có gas.
9. So Sánh Axit Cacbonic Với Các Axit Khác
9.1. So Sánh Với Axit Clohydric (HCl)
| Đặc Điểm | Axit Cacbonic (H2CO3) | Axit Clohydric (HCl) |
|---|---|---|
| Độ mạnh | Yếu | Mạnh |
| Tính bền | Không bền | Bền |
| Ứng dụng | Nước giải khát, tự nhiên | Công nghiệp, phòng thí nghiệm |
| Khả năng phân ly | Kém | Hoàn toàn |
9.2. So Sánh Với Axit Acetic (CH3COOH)
| Đặc Điểm | Axit Cacbonic (H2CO3) | Axit Acetic (CH3COOH) |
|---|---|---|
| Độ mạnh | Yếu | Yếu |
| Tính bền | Không bền | Bền |
| Ứng dụng | Nước giải khát, tự nhiên | Thực phẩm, công nghiệp |
| Nguồn gốc | Vô cơ | Hữu cơ |
10. Các Nghiên Cứu Khoa Học Mới Nhất Về Axit Cacbonic
10.1. Ứng Dụng Trong Lưu Trữ Năng Lượng
Các nhà khoa học đang nghiên cứu sử dụng axit cacbonic để phát triển các phương pháp lưu trữ năng lượng mới, thân thiện với môi trường. Theo một nghiên cứu được công bố trên tạp chí “Nature”, axit cacbonic có thể được chuyển đổi thành nhiên liệu lỏng bằng cách sử dụng năng lượng tái tạo (Nature, 2022).
10.2. Vai Trò Trong Biến Đổi Khí Hậu
Các nghiên cứu gần đây chỉ ra rằng sự gia tăng nồng độ CO2 trong khí quyển dẫn đến sự gia tăng axit cacbonic trong đại dương, gây ra hiện tượng axit hóa đại dương, đe dọa đến các hệ sinh thái biển. Báo cáo của Liên Hợp Quốc nhấn mạnh rằng axit hóa đại dương là một trong những thách thức lớn nhất đối với các đại dương trên thế giới (Liên Hợp Quốc, 2021).
11. Câu Hỏi Thường Gặp Về Axit Cacbonic (FAQ)
11.1. Axit cacbonic có độc hại không?
Axit cacbonic không độc hại ở nồng độ thấp. Tuy nhiên, tiếp xúc với nồng độ cao có thể gây kích ứng mắt và đường hô hấp.
11.2. Tại sao nước giải khát có gas lại có vị chua?
Vị chua của nước giải khát có gas là do sự hiện diện của axit cacbonic.
11.3. Axit cacbonic có ảnh hưởng đến môi trường không?
Sự gia tăng axit cacbonic trong đại dương do hấp thụ CO2 từ khí quyển gây ra hiện tượng axit hóa đại dương, đe dọa đến các hệ sinh thái biển.
11.4. Làm thế nào để giảm tác động của axit cacbonic đến răng?
Để giảm tác động của axit cacbonic đến răng, nên hạn chế tiêu thụ đồ uống có gas và đánh răng sau khi uống.
11.5. Axit cacbonic có vai trò gì trong cơ thể con người?
Axit cacbonic tham gia vào quá trình vận chuyển CO2 từ các tế bào đến phổi để thải ra ngoài.
11.6. Axit cacbonic được tạo ra như thế nào trong tự nhiên?
Axit cacbonic được tạo ra khi CO2 hòa tan trong nước, chẳng hạn như trong nước mưa hoặc đại dương.
11.7. Axit cacbonic có ứng dụng gì trong công nghiệp?
Axit cacbonic được sử dụng trong sản xuất nước giải khát có gas, sản xuất ure, và trong một số quy trình hóa học khác.
11.8. Axit cacbonic có phải là một axit mạnh không?
Không, axit cacbonic là một axit yếu.
11.9. Tại sao axit cacbonic lại không bền?
Axit cacbonic không bền vì nó dễ dàng phân hủy thành CO2 và nước.
11.10. Axit cacbonic có ảnh hưởng đến sự hình thành hang động không?
Có, axit cacbonic đóng vai trò quan trọng trong việc hòa tan đá vôi, dẫn đến sự hình thành hang động.
Kết Luận
Axit cacbonic (H2CO3) là một hợp chất hóa học quan trọng với nhiều vai trò trong tự nhiên và đời sống. Từ việc điều hòa pH của nước đến tham gia vào chu trình cacbon và ứng dụng trong công nghiệp, axit cacbonic đóng góp vào nhiều quá trình quan trọng. Hiểu rõ về axit cacbonic giúp chúng ta nhận thức rõ hơn về thế giới xung quanh và tác động của chúng ta đến môi trường.
Nếu bạn muốn tìm hiểu thêm về các loại xe tải phù hợp với nhu cầu vận chuyển hàng hóa của mình, hãy truy cập XETAIMYDINH.EDU.VN ngay hôm nay. Chúng tôi cung cấp thông tin chi tiết và cập nhật về các loại xe tải có sẵn ở Mỹ Đình, Hà Nội, so sánh giá cả và thông số kỹ thuật giữa các dòng xe, tư vấn lựa chọn xe phù hợp với nhu cầu và ngân sách, giải đáp các thắc mắc liên quan đến thủ tục mua bán, đăng ký và bảo dưỡng xe tải, và cung cấp thông tin về các dịch vụ sửa chữa xe tải uy tín trong khu vực.
Liên hệ ngay với Xe Tải Mỹ Đình để được tư vấn và giải đáp mọi thắc mắc!
- Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội
- Hotline: 0247 309 9988
- Trang web: XETAIMYDINH.EDU.VN
Hãy để Xe Tải Mỹ Đình đồng hành cùng bạn trên mọi nẻo đường!
