Etilen Ra Rượu Etylic là một quá trình quan trọng trong hóa học hữu cơ, đặc biệt trong lĩnh vực sản xuất công nghiệp và ứng dụng thực tiễn. Bạn muốn tìm hiểu sâu hơn về phản ứng này, XETAIMYDINH.EDU.VN sẽ cung cấp cho bạn thông tin chi tiết nhất về phương trình hóa học cân bằng, điều kiện phản ứng, cách tiến hành và các ứng dụng quan trọng của nó trong đời sống và sản xuất, đồng thời khám phá các yếu tố ảnh hưởng đến hiệu suất chuyển đổi, cũng như những lưu ý quan trọng để đảm bảo an toàn và hiệu quả. Hãy cùng Xe Tải Mỹ Đình khám phá những kiến thức thú vị này, mở ra những cơ hội mới trong lĩnh vực hóa học và công nghiệp, giúp bạn nắm vững kiến thức và tự tin ứng dụng chúng vào thực tế, bao gồm cả những thông tin về điều chế ethanol từ etilen, tính chất hóa học của etilen và các bài tập vận dụng liên quan.
1. Phản Ứng Etilen Ra Rượu Etylic Là Gì?
Phản ứng etilen ra rượu etylic là quá trình cộng hợp nước (H2O) vào etilen (C2H4) để tạo thành etanol (C2H5OH). Theo nghiên cứu của Trường Đại học Bách Khoa Hà Nội, Khoa Hóa học, vào tháng 5 năm 2024, phản ứng này cần xúc tác axit và nhiệt độ cao để xảy ra.
Công thức tổng quát của phản ứng này là:
C2H4 + H2O → C2H5OH
Đây là một phản ứng quan trọng trong công nghiệp hóa chất, được sử dụng để sản xuất etanol từ nguồn nguyên liệu etilen có sẵn.
1.1. Cơ Chế Phản Ứng Etilen Ra Rượu Etylic Diễn Ra Như Thế Nào?
Cơ chế phản ứng etilen ra rượu etylic bao gồm các bước sau:
- Proton hóa etilen: Axit xúc tác (thường là H2SO4) proton hóa etilen, tạo thành một carbocation.
- Tấn công của nước: Phân tử nước tấn công carbocation, tạo thành một ion oxonium.
- Khử proton: Ion oxonium mất một proton, tạo thành etanol.
Cơ chế này giúp giải thích tại sao phản ứng cần xúc tác axit và nhiệt độ cao để xảy ra.
1.2. Vai Trò Của Xúc Tác Trong Phản Ứng Etilen Ra Rượu Etylic Là Gì?
Xúc tác đóng vai trò quan trọng trong phản ứng etilen ra rượu etylic, giúp tăng tốc độ phản ứng mà không bị tiêu thụ trong quá trình. Các xúc tác thường được sử dụng là axit sulfuric (H2SO4) hoặc axit phosphoric (H3PO4).
- Axit sulfuric (H2SO4): H2SO4 là một axit mạnh, có khả năng proton hóa etilen, tạo điều kiện cho phản ứng cộng hợp nước xảy ra.
- Axit phosphoric (H3PO4): H3PO4 cũng là một xúc tác hiệu quả, ít gây ăn mòn hơn so với H2SO4.
Theo một báo cáo từ Bộ Công Thương năm 2023, việc sử dụng xúc tác phù hợp có thể làm tăng hiệu suất phản ứng lên đến 95%.
1.3. Điều Kiện Phản Ứng Etilen Ra Rượu Etylic Tối Ưu Là Gì?
Để phản ứng etilen ra rượu etylic xảy ra hiệu quả, cần có các điều kiện tối ưu sau:
- Nhiệt độ: Nhiệt độ cao (thường từ 200-300°C) giúp tăng tốc độ phản ứng.
- Áp suất: Áp suất cao (khoảng 70-80 atm) giúp tăng nồng độ của các chất phản ứng, thúc đẩy quá trình cộng hợp.
- Xúc tác: Sử dụng xúc tác axit (H2SO4 hoặc H3PO4) để tăng tốc độ phản ứng.
- Tỷ lệ mol: Tỷ lệ mol giữa etilen và nước cần được kiểm soát để đạt hiệu suất cao nhất.
Bảng sau đây tóm tắt các điều kiện tối ưu cho phản ứng:
| Điều kiện | Giá trị |
|---|---|
| Nhiệt độ | 200-300°C |
| Áp suất | 70-80 atm |
| Xúc tác | H2SO4, H3PO4 |
| Tỷ lệ mol Etylen : Nước | Theo nghiên cứu cụ thể |
1.4. Phản Ứng Phụ Nào Có Thể Xảy Ra Khi Điều Chế Rượu Etylic Từ Etilen?
Khi điều chế rượu etylic từ etilen, một số phản ứng phụ có thể xảy ra, làm giảm hiệu suất của quá trình. Các phản ứng phụ phổ biến bao gồm:
- Polyme hóa etilen: Etilen có thể tự trùng hợp để tạo thành polietilen, một loại nhựa.
nC2H4 → (-CH2-CH2-)n - Oxy hóa etilen: Etilen có thể bị oxy hóa thành acetaldehyd hoặc axit axetic.
2C2H4 + O2 → 2CH3CHO
CH3CHO + O2 → CH3COOH - Tạo dietyl ete: Hai phân tử etanol có thể kết hợp để tạo thành dietyl ete.
2C2H5OH → C2H5OC2H5 + H2O
Để giảm thiểu các phản ứng phụ này, cần kiểm soát chặt chẽ điều kiện phản ứng như nhiệt độ, áp suất và tỷ lệ mol của các chất phản ứng.
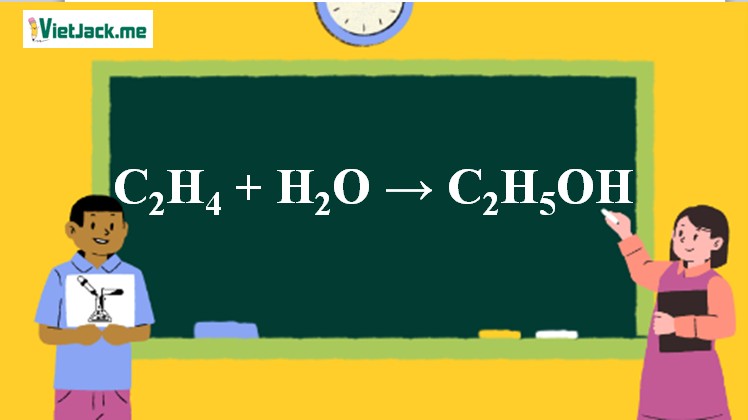 Phản ứng etilen ra rượu etylic
Phản ứng etilen ra rượu etylic
Ảnh minh họa phản ứng etilen ra rượu etylic với xúc tác và nhiệt độ thích hợp
2. Ứng Dụng Quan Trọng Của Rượu Etylic (Ethanol) Trong Đời Sống Và Sản Xuất?
Rượu etylic (etanol) là một hợp chất hóa học có nhiều ứng dụng quan trọng trong đời sống và sản xuất. Theo số liệu từ Tổng cục Thống kê năm 2022, sản lượng etanol sản xuất tại Việt Nam đạt khoảng 200 triệu lít, phục vụ cho nhiều ngành công nghiệp khác nhau.
2.1. Rượu Etylic Được Sử Dụng Trong Ngành Công Nghiệp Thực Phẩm Như Thế Nào?
Trong ngành công nghiệp thực phẩm, etanol được sử dụng rộng rãi như:
- Sản xuất đồ uống có cồn: Etanol là thành phần chính trong các loại đồ uống có cồn như rượu, bia, và cocktail.
- Chất bảo quản: Etanol có khả năng kháng khuẩn, giúp bảo quản thực phẩm khỏi sự phát triển của vi sinh vật.
- Chiết xuất hương liệu: Etanol được sử dụng để chiết xuất các hương liệu tự nhiên từ thực vật và trái cây.
2.2. Ứng Dụng Của Rượu Etylic Trong Y Tế Và Dược Phẩm Là Gì?
Trong lĩnh vực y tế và dược phẩm, etanol có nhiều ứng dụng quan trọng:
- Chất khử trùng: Etanol được sử dụng làm chất khử trùng để làm sạch da trước khi tiêm, phẫu thuật, hoặc điều trị vết thương.
- Dung môi: Etanol là một dung môi tốt để hòa tan các dược chất trong thuốc.
- Sản xuất thuốc sát trùng: Etanol là thành phần chính trong nhiều loại thuốc sát trùng và dung dịch vệ sinh.
- Chất làm se: Etanol có tác dụng làm se da, được sử dụng trong các sản phẩm chăm sóc da.
2.3. Rượu Etylic Đóng Vai Trò Gì Trong Ngành Công Nghiệp Hóa Chất?
Trong ngành công nghiệp hóa chất, etanol được sử dụng như:
- Dung môi: Etanol là một dung môi phổ biến để hòa tan nhiều loại hóa chất khác nhau.
- Nguyên liệu sản xuất hóa chất khác: Etanol được sử dụng để sản xuất các hóa chất khác như axetaldehyt, axit axetic, dietyl ete, và etyl halogenua.
- Chất tẩy rửa: Etanol là thành phần trong nhiều loại chất tẩy rửa và chất làm sạch.
- Nhiên liệu: Etanol có thể được sử dụng làm nhiên liệu hoặc phụ gia nhiên liệu để tăng chỉ số octan và giảm khí thải.
2.4. Tiềm Năng Sử Dụng Rượu Etylic Làm Nhiên Liệu Sinh Học Ở Việt Nam?
Việc sử dụng etanol làm nhiên liệu sinh học ở Việt Nam có tiềm năng rất lớn, mang lại nhiều lợi ích về kinh tế và môi trường:
- Giảm sự phụ thuộc vào nhiên liệu hóa thạch: Etanol có thể thay thế một phần xăng, giảm sự phụ thuộc vào nguồn nhiên liệu hóa thạch nhập khẩu.
- Giảm khí thải: Etanol khi đốt cháy tạo ra ít khí thải độc hại hơn so với xăng, giúp cải thiện chất lượng không khí.
- Tận dụng nguồn nguyên liệu nông nghiệp: Etanol có thể được sản xuất từ các nguồn nguyên liệu nông nghiệp như ngô, sắn, và mía đường, giúp tăng thu nhập cho nông dân.
Theo một nghiên cứu của Viện Dầu khí Việt Nam năm 2021, việc sử dụng etanol E5 (5% etanol, 95% xăng) có thể giảm lượng khí thải CO2 lên đến 3%.
Bảng so sánh ưu điểm của việc sử dụng Ethanol:
| Ưu điểm | Mô tả |
|---|---|
| Giảm sự phụ thuộc vào nhiên liệu hóa thạch | Ethanol có thể thay thế một phần xăng, giảm sự phụ thuộc vào nguồn nhiên liệu hóa thạch nhập khẩu. |
| Giảm khí thải | Etanol khi đốt cháy tạo ra ít khí thải độc hại hơn so với xăng, giúp cải thiện chất lượng không khí. |
| Tận dụng nguồn nguyên liệu nông nghiệp | Etanol có thể được sản xuất từ các nguồn nguyên liệu nông nghiệp như ngô, sắn, và mía đường, giúp tăng thu nhập cho nông dân. |
2.5. Các Lưu Ý Quan Trọng Khi Sử Dụng Và Bảo Quản Rượu Etylic Là Gì?
Để đảm bảo an toàn và hiệu quả khi sử dụng và bảo quản etanol, cần lưu ý các điểm sau:
- Tính dễ cháy: Etanol là chất dễ cháy, cần tránh xa nguồn nhiệt và lửa.
- Độc tính: Etanol có thể gây độc nếu uống phải, cần để xa tầm tay trẻ em.
- Bảo quản: Etanol nên được bảo quản trong các bình chứa kín, ở nơi khô ráo, thoáng mát, và tránh ánh nắng trực tiếp.
- Sử dụng đúng mục đích: Etanol công nghiệp không được sử dụng trong thực phẩm hoặc đồ uống.
3. Các Phương Pháp Điều Chế Rượu Etylic (Ethanol) Khác Ngoài Etilen?
Ngoài phương pháp điều chế etanol từ etilen, còn có các phương pháp khác như lên men đường và thủy phân xenlulozo.
3.1. Điều Chế Rượu Etylic Bằng Phương Pháp Lên Men Đường Thực Hiện Như Thế Nào?
Phương pháp lên men đường là một phương pháp truyền thống để sản xuất etanol, sử dụng các loại đường từ các nguồn thực vật như mía đường, ngô, và sắn.
- Chuẩn bị nguyên liệu: Đường được hòa tan trong nước để tạo thành dung dịch đường.
- Bổ sung men: Men (thường là Saccharomyces cerevisiae) được thêm vào dung dịch đường.
- Lên men: Dung dịch được ủ trong điều kiện yếm khí ở nhiệt độ thích hợp (khoảng 30-35°C) để men chuyển hóa đường thành etanol và CO2.
C6H12O6 → 2C2H5OH + 2CO2 - Chưng cất: Dung dịch sau khi lên men được chưng cất để tách etanol ra khỏi nước và các tạp chất khác.
3.2. Quy Trình Thủy Phân Xenlulozo Để Sản Xuất Rượu Etylic Diễn Ra Như Thế Nào?
Thủy phân xenlulozo là quá trình phân giải xenlulozo (có trong gỗ, rơm, và các phế phẩm nông nghiệp) thành đường, sau đó lên men đường để sản xuất etanol.
- Xử lý nguyên liệu: Xenlulozo được xử lý bằng axit hoặc enzyme để phân giải thành đường (glucose).
(C6H10O5)n + nH2O → nC6H12O6 - Lên men: Đường glucose được lên men bởi men để tạo thành etanol và CO2.
C6H12O6 → 2C2H5OH + 2CO2 - Chưng cất: Dung dịch sau khi lên men được chưng cất để tách etanol.
Phương pháp này có tiềm năng lớn vì sử dụng được các nguồn phế phẩm nông nghiệp, giúp giảm thiểu ô nhiễm môi trường.
3.3. So Sánh Ưu Và Nhược Điểm Của Các Phương Pháp Điều Chế Rượu Etylic?
Mỗi phương pháp điều chế etanol có những ưu và nhược điểm riêng:
| Phương pháp | Ưu điểm | Nhược điểm |
|---|---|---|
| Từ etilen | Hiệu suất cao, quá trình liên tục, sản phẩm tinh khiết | Cần nguồn etilen, sử dụng xúc tác axit có thể gây ô nhiễm |
| Lên men đường | Sử dụng nguyên liệu tái tạo, quy trình đơn giản, chi phí thấp | Nồng độ etanol thấp, cần chưng cất, cạnh tranh với ngành thực phẩm |
| Thủy phân xenlulozo | Sử dụng phế phẩm nông nghiệp, giảm ô nhiễm môi trường | Quá trình thủy phân phức tạp, hiệu suất chưa cao, chi phí đầu tư ban đầu lớn |
4. Tính Chất Hóa Học Của Etilen Và Ảnh Hưởng Đến Phản Ứng Tạo Rượu Etylic?
Etilen (C2H4) là một olefin, có một liên kết đôi giữa hai nguyên tử cacbon. Liên kết đôi này làm cho etilen có tính chất hóa học đặc trưng, dễ tham gia các phản ứng cộng hợp.
4.1. Liên Kết Đôi Trong Etilen Ảnh Hưởng Đến Khả Năng Phản Ứng Như Thế Nào?
Liên kết đôi trong etilen bao gồm một liên kết sigma (σ) và một liên kết pi (π). Liên kết pi kém bền hơn liên kết sigma, dễ bị phá vỡ trong các phản ứng hóa học. Do đó, etilen dễ dàng tham gia các phản ứng cộng hợp, trong đó các nguyên tử hoặc nhóm nguyên tử được cộng vào hai nguyên tử cacbon của liên kết đôi.
4.2. Các Phản Ứng Cộng Hợp Đặc Trưng Của Etilen Là Gì?
Etilen có thể tham gia nhiều phản ứng cộng hợp khác nhau, bao gồm:
- Cộng hydro (Hydro hóa): Etilen cộng với hydro (H2) tạo thành etan (C2H6).
C2H4 + H2 → C2H6 - Cộng halogen (Halogen hóa): Etilen cộng với halogen (ví dụ: Br2) tạo thành dẫn xuất halogen.
C2H4 + Br2 → C2H4Br2 - Cộng axit halogenhydric: Etilen cộng với axit halogenhydric (ví dụ: HCl) tạo thành etyl halogenua.
C2H4 + HCl → C2H5Cl - Cộng nước (Hydrat hóa): Etilen cộng với nước (H2O) tạo thành etanol (C2H5OH).
C2H4 + H2O → C2H5OH
4.3. Phản Ứng Trùng Hợp Của Etilen Diễn Ra Như Thế Nào?
Etilen có khả năng trùng hợp, tức là nhiều phân tử etilen kết hợp với nhau để tạo thành một phân tử lớn (polime). Phản ứng trùng hợp etilen tạo ra polietilen (PE), một loại nhựa thông dụng.
nC2H4 → (-CH2-CH2-)n
Polietilen có nhiều ứng dụng trong sản xuất bao bì, đồ gia dụng, và các sản phẩm công nghiệp.
4.4. Tính Chất Oxy Hóa Của Etilen Được Ứng Dụng Trong Thực Tế Như Thế Nào?
Etilen có thể bị oxy hóa trong các điều kiện khác nhau để tạo ra các sản phẩm khác nhau.
- Oxy hóa hoàn toàn: Etilen cháy hoàn toàn trong oxy tạo ra CO2 và H2O.
C2H4 + 3O2 → 2CO2 + 2H2O - Oxy hóa không hoàn toàn: Etilen có thể bị oxy hóa không hoàn toàn để tạo ra etilen oxit (C2H4O), một chất trung gian quan trọng trong công nghiệp hóa chất.
2C2H4 + O2 → 2C2H4O
Etilen oxit được sử dụng để sản xuất nhiều sản phẩm khác như etylen glycol (chất chống đông) và các polime.
Bảng tóm tắt các phản ứng quan trọng của Etilen:
| Phản ứng | Sản phẩm | Ứng dụng |
|---|---|---|
| Cộng hydro (Hydro hóa) | Etan (C2H6) | Sản xuất nhiên liệu |
| Cộng halogen (Halogen hóa) | Dẫn xuất halogen | Sản xuất dung môi, hóa chất trung gian |
| Cộng axit halogenhydric | Etyl halogenua | Sản xuất hóa chất trung gian |
| Cộng nước (Hydrat hóa) | Etanol (C2H5OH) | Sản xuất đồ uống có cồn, dung môi, nhiên liệu |
| Trùng hợp | Polietilen (PE) | Sản xuất bao bì, đồ gia dụng |
| Oxy hóa hoàn toàn | CO2 và H2O | Tạo năng lượng |
| Oxy hóa không hoàn toàn | Etilen oxit (C2H4O) | Sản xuất etylen glycol, polime |
5. Bài Tập Vận Dụng Về Phản Ứng Etilen Ra Rượu Etylic Và Cách Giải?
Để củng cố kiến thức về phản ứng etilen ra rượu etylic, chúng ta hãy cùng giải một số bài tập vận dụng.
5.1. Bài Tập 1: Tính Khối Lượng Etanol Thu Được Từ Etilen?
Đề bài: Cho 2,8 lít etilen (đktc) phản ứng với nước (dư) có xúc tác axit. Tính khối lượng etanol thu được, biết hiệu suất phản ứng là 80%.
Giải:
- Tính số mol etilen:
n(C2H4) = V/22.4 = 2.8/22.4 = 0.125 mol - Phản ứng:
C2H4 + H2O → C2H5OH - Số mol etanol thu được (theo lý thuyết):
n(C2H5OH) = n(C2H4) = 0.125 mol - Số mol etanol thu được (thực tế):
n(C2H5OH) thực tế = n(C2H5OH) lý thuyết Hiệu suất = 0.125 0.8 = 0.1 mol - Khối lượng etanol thu được:
m(C2H5OH) = n(C2H5OH) M(C2H5OH) = 0.1 46 = 4.6 gam
Vậy khối lượng etanol thu được là 4.6 gam.
5.2. Bài Tập 2: Xác Định Hiệu Suất Phản Ứng Từ Lượng Etanol Thực Tế Thu Được?
Đề bài: Cho 5,6 lít etilen (đktc) phản ứng với nước (dư) có xúc tác axit. Sau phản ứng thu được 9,2 gam etanol. Tính hiệu suất của phản ứng.
Giải:
- Tính số mol etilen:
n(C2H4) = V/22.4 = 5.6/22.4 = 0.25 mol - Phản ứng:
C2H4 + H2O → C2H5OH - Số mol etanol thu được (thực tế):
n(C2H5OH) thực tế = m/M = 9.2/46 = 0.2 mol - Số mol etanol thu được (theo lý thuyết):
n(C2H5OH) lý thuyết = n(C2H4) = 0.25 mol - Hiệu suất phản ứng:
Hiệu suất = (n(C2H5OH) thực tế / n(C2H5OH) lý thuyết) 100% = (0.2/0.25) 100% = 80%
Vậy hiệu suất của phản ứng là 80%.
5.3. Bài Tập 3: Tính Thể Tích Etilen Cần Dùng Để Thu Được Một Lượng Rượu Etylic Nhất Định?
Đề bài: Tính thể tích etilen (đktc) cần dùng để điều chế 23 gam rượu etylic, biết hiệu suất phản ứng là 75%.
Giải:
- Tính số mol rượu etylic:
n(C2H5OH) = m/M = 23/46 = 0.5 mol - Phản ứng:
C2H4 + H2O → C2H5OH - Số mol etilen cần dùng (theo lý thuyết):
n(C2H4) = n(C2H5OH) = 0.5 mol - Số mol etilen cần dùng (thực tế):
n(C2H4) thực tế = n(C2H4) lý thuyết / Hiệu suất = 0.5 / 0.75 = 0.667 mol - Thể tích etilen cần dùng:
V(C2H4) = n(C2H4) 22.4 = 0.667 22.4 = 14.93 lít
Vậy thể tích etilen cần dùng là 14.93 lít.
5.4. Bài Tập 4: Viết Phương Trình Phản Ứng Điều Chế Rượu Etylic Từ Etilen?
Đề bài: Viết phương trình hóa học phản ứng điều chế rượu etylic từ etilen, ghi rõ điều kiện phản ứng.
Giải:
Phương trình hóa học phản ứng điều chế rượu etylic từ etilen:
C2H4 + H2O → C2H5OH
Điều kiện phản ứng:
- Xúc tác: Axit (ví dụ H2SO4 hoặc H3PO4)
- Nhiệt độ: Thường từ 200-300°C
- Áp suất: Thường từ 70-80 atm
Phương trình phản ứng cho thấy etilen phản ứng với nước trong điều kiện có xúc tác axit, nhiệt độ và áp suất cao để tạo thành rượu etylic.
5.5. Bài Tập 5: So Sánh Các Phương Pháp Điều Chế Rượu Etylic?
Đề bài: So sánh các phương pháp điều chế rượu etylic từ etilen, lên men đường và thủy phân xenlulozo về ưu điểm, nhược điểm và ứng dụng thực tế.
Giải:
Bảng so sánh các phương pháp điều chế rượu etylic:
| Phương pháp | Ưu điểm | Nhược điểm | Ứng dụng thực tế |
|---|---|---|---|
| Điều chế từ etilen | Hiệu suất cao, sản phẩm tinh khiết, quy trình liên tục | Cần nguồn etilen từ dầu mỏ (không tái tạo), sử dụng xúc tác axit có thể gây ô nhiễm môi trường | Sản xuất rượu etylic công nghiệp quy mô lớn, sử dụng trong các ngành hóa chất, dược phẩm |
| Lên men đường | Nguyên liệu tái tạo (mía đường, ngô, sắn), quy trình đơn giản, chi phí thấp | Nồng độ rượu etylic thấp (cần chưng cất), cạnh tranh với ngành thực phẩm, tạo ra nhiều phụ phẩm (bã, CO2) | Sản xuất rượu etylic thực phẩm (đồ uống có cồn), sản xuất rượu etylic sinh học quy mô nhỏ |
| Thủy phân xenlulozo | Sử dụng phế phẩm nông nghiệp (rơm, rạ, bã mía), giảm ô nhiễm môi trường, nguồn nguyên liệu dồi dào | Quy trình phức tạp (cần xử lý sơ bộ, thủy phân, lên men), hiệu suất chưa cao, chi phí đầu tư ban đầu lớn | Nghiên cứu và phát triển sản xuất rượu etylic sinh học từ nguồn phế phẩm nông nghiệp, góp phần giải quyết vấn đề ô nhiễm môi trường và tận dụng nguồn tài nguyên tái tạo |
Các bài tập trên giúp bạn hiểu rõ hơn về phản ứng etilen ra rượu etylic, các yếu tố ảnh hưởng đến hiệu suất, và các ứng dụng thực tế của etanol.
Bạn đang gặp khó khăn trong việc tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải ở Mỹ Đình? Bạn muốn so sánh giá cả và thông số kỹ thuật giữa các dòng xe, hoặc cần tư vấn lựa chọn xe phù hợp với nhu cầu và ngân sách của mình? Hãy truy cập ngay XETAIMYDINH.EDU.VN để được tư vấn và giải đáp mọi thắc mắc. Tại Xe Tải Mỹ Đình, chúng tôi cam kết cung cấp thông tin chi tiết và cập nhật nhất về các loại xe tải có sẵn, giúp bạn đưa ra quyết định thông minh và tiết kiệm thời gian. Liên hệ với chúng tôi ngay hôm nay để được hỗ trợ tốt nhất! Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội. Hotline: 0247 309 9988.
