Dung Dịch H2so4, hay axit sunfuric, là một hóa chất công nghiệp thiết yếu với nhiều ứng dụng quan trọng trong đời sống và sản xuất. Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN) cung cấp thông tin chi tiết về hóa chất này, giúp bạn hiểu rõ hơn về đặc tính và cách sử dụng an toàn. Bài viết này sẽ cung cấp thông tin chuyên sâu về axit sulfuric, từ tính chất vật lý, hóa học đến ứng dụng thực tế và những lưu ý quan trọng khi sử dụng. Cùng Xe Tải Mỹ Đình khám phá về chất điện ly, chất ăn mòn và hóa chất nguy hiểm này nhé.
1. Dung Dịch H2SO4 Là Gì? Định Nghĩa Chi Tiết
Dung dịch H2SO4, hay còn gọi là axit sunfuric, là một hợp chất hóa học vô cơ mạnh, có công thức hóa học là H2SO4, bao gồm các nguyên tố lưu huỳnh, oxy và hydro. Dung dịch H2SO4 là một chất lỏng không màu, sánh như dầu, không mùi và hòa tan hoàn toàn trong nước, tạo ra một phản ứng tỏa nhiệt mạnh. Vậy, dung dịch H2SO4 nguy hiểm như thế nào và có những ứng dụng gì quan trọng trong công nghiệp và đời sống? Hãy cùng Xe Tải Mỹ Đình tìm hiểu chi tiết.
1.1. Cấu Tạo Phân Tử H2SO4
Cấu tạo phân tử của dung dịch H2SO4 bao gồm:
- Công thức phân tử: H2SO4.
- Công thức cấu tạo: Công thức cấu tạo của H2SO4 thể hiện sự liên kết giữa các nguyên tử hydro, lưu huỳnh và oxy.
 công thức cấu tạo H2SO4
công thức cấu tạo H2SO4
- Mô hình phân tử: Mô hình phân tử H2SO4 cho thấy hình dạng ba chiều của phân tử, giúp hình dung rõ hơn về cấu trúc của nó.
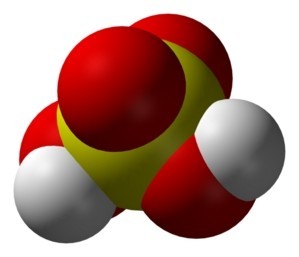 Mô hình phân tử H2SO4
Mô hình phân tử H2SO4
1.2. Tính Chất Vật Lý Của Dung Dịch Axit Sunfuric H2SO4
Dung dịch axit sunfuric H2SO4 có những tính chất vật lý đặc trưng sau:
- Trạng thái: Chất lỏng, sánh và nặng hơn nước.
- Độ nhớt: Hơi nhớt, tương tự như dầu.
- Độ bay hơi: Khó bay hơi.
- Độ hòa tan: Tan vô hạn trong nước.
- Khả năng hút ẩm: Hút mạnh nước và tỏa nhiều nhiệt khi hòa tan, vì vậy cần pha loãng cẩn thận để tránh gây bỏng.
- Khả năng than hóa: Có khả năng làm than hóa các hợp chất hữu cơ.
1.3. Tính Chất Hóa Học Của Dung Dịch Axit Sunfuric H2SO4
Tính chất hóa học của dung dịch axit sunfuric H2SO4 rất đa dạng và phụ thuộc vào nồng độ của nó. Dưới đây là các tính chất hóa học quan trọng:
1.3.1. Axit Sunfuric Loãng
Axit sunfuric loãng thể hiện đầy đủ các tính chất hóa học chung của một axit mạnh:
-
Tính axit: Làm quỳ tím chuyển sang màu đỏ.
-
Tác dụng với kim loại: Tác dụng với các kim loại đứng trước hydro (H) trong dãy điện hóa (trừ chì Pb) tạo thành muối sunfat và giải phóng khí hydro (H2).
Fe + H2SO4 → FeSO4 + H2 -
Tác dụng với oxit bazơ: Tác dụng với oxit bazơ tạo thành muối và nước.
FeO + H2SO4 → FeSO4 + H2O -
Tác dụng với bazơ: Tác dụng với bazơ tạo thành muối và nước (phản ứng trung hòa).
H2SO4 + NaOH → NaHSO4 + H2O H2SO4 + 2NaOH → Na2SO4 + 2H2O -
Tác dụng với muối: Tác dụng với muối tạo thành muối mới và axit mới.
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2 H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2
1.3.2. Axit Sunfuric Đặc
Axit sunfuric đặc có tính axit mạnh và tính oxi hóa mạnh, thể hiện qua các phản ứng sau:
-
Tác dụng với kim loại: Tác dụng với nhiều kim loại (kể cả các kim loại đứng sau hydro như đồng Cu) tạo thành muối sunfat, khí SO2 và nước.
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O -
Tác dụng với phi kim: Tác dụng với các phi kim như cacbon (C) và photpho (P) tạo thành oxit phi kim, SO2 và nước.
C + 2H2SO4 → CO2 + 2H2O + 2SO2 (nhiệt độ) 2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O -
Tác dụng với các chất khử khác:
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O -
Tính háo nước: Axit sunfuric đặc có tính háo nước mạnh, có thể hút nước từ các hợp chất hữu cơ, gây ra hiện tượng than hóa.
C12H22O11 + H2SO4 → 12C + H2SO4.11H2O
1.4. Điều Chế Dung Dịch Axit Sunfuric (H2SO4)
Trong công nghiệp, dung dịch H2SO4 thường được điều chế bằng phương pháp tiếp xúc, bao gồm các giai đoạn chính sau:
- Đốt cháy nguyên liệu chứa lưu huỳnh: Quặng pirit sắt (FeS2) hoặc lưu huỳnh (S) được đốt cháy để tạo ra khí lưu huỳnh đioxit (SO2).
- Oxi hóa SO2 thành SO3: Khí SO2 được oxi hóa thành lưu huỳnh trioxit (SO3) bằng oxi (O2) với xúc tác vanadi(V) oxit (V2O5) ở nhiệt độ 400-500°C.
- Hấp thụ SO3 bằng H2SO4 đặc: SO3 được hấp thụ vào dung dịch H2SO4 đặc để tạo thành oleum (H2S2O7).
- Pha loãng oleum thành H2SO4: Oleum được pha loãng với nước để tạo ra dung dịch H2SO4 với nồng độ mong muốn.
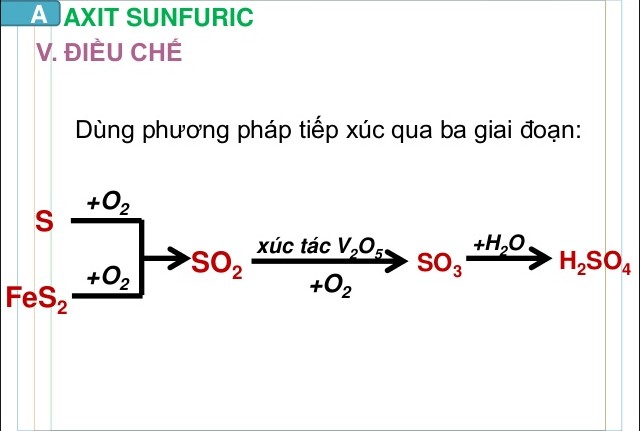 Cách điều chế axit sunfuric
Cách điều chế axit sunfuric
1.5. Các Dạng Dung Dịch Axit Sunfuric H2SO4
Dung dịch axit sunfuric H2SO4 có nhiều nồng độ khác nhau, mỗi nồng độ được sử dụng cho các mục đích riêng biệt:
- Axit sunfuric loãng (10%): Thường được sử dụng trong phòng thí nghiệm.
- Axit sunfuric (33.5%): Được dùng trong ắc quy.
- Axit sunfuric (62.18%): Dùng để sản xuất phân bón.
- Axit sunfuric (77.67%): Dùng trong tháp sản xuất axit Glover.
- Axit sunfuric đậm đặc (98%): Là dạng axit đậm đặc phổ biến.
Theo một nghiên cứu của Trường Đại học Bách Khoa Hà Nội, Khoa Hóa học, vào tháng 5 năm 2023, việc sử dụng đúng nồng độ axit sunfuric giúp tối ưu hóa hiệu quả trong các ứng dụng khác nhau, từ sản xuất đến nghiên cứu.
1.6. Tính Dẫn Điện Và Tính Phân Cực Của H2SO4
Axit sunfuric khan là một chất lỏng phân cực mạnh, với hằng số điện môi khoảng 100. Điều này là do khả năng tự proton hóa, tức là tự phân ly thành các ion:
2 H2SO4 ⇌ H3SO4+ + HSO4-Tính chất này làm cho axit sunfuric trở thành một chất điện ly mạnh, có khả năng dẫn điện tốt.
2. Ứng Dụng Của Hóa Chất Axit Sunfuric H2SO4 Trong Đời Sống
Dung dịch axit sunfuric là một trong những hóa chất quan trọng nhất trong công nghiệp, được sử dụng rộng rãi như một nguyên liệu chính hoặc chất xúc tác trong nhiều quy trình sản xuất. Các ứng dụng chính của axit sunfuric bao gồm:
 Ứng dụng của axit sunfuric
Ứng dụng của axit sunfuric
2.1. Trong Sản Xuất Phân Bón
Axit sunfuric được sử dụng chủ yếu để sản xuất axit photphoric (H3PO4), một nguyên liệu không thể thiếu trong sản xuất các loại phân lân. Nó cũng được dùng để sản xuất amoni sunfat ((NH4)2SO4), một loại phân đạm phổ biến. Theo số liệu từ Tổng cục Thống kê năm 2022, ngành sản xuất phân bón tiêu thụ khoảng 60% tổng lượng axit sunfuric sản xuất ra.
2.2. Trong Sản Xuất Công Nghiệp
H2SO4 được sử dụng rộng rãi trong sản xuất kim loại như đồng (Cu), kẽm (Zn), và để làm sạch bề mặt thép, tẩy gỉ. Axit sunfuric còn được dùng để sản xuất nhôm sunfat (phèn chua), các loại muối sunfat, chế tạo thuốc nổ, thuốc nhuộm, chất dẻo, tẩy rửa kim loại trước khi mạ và sản xuất dược phẩm. Hỗn hợp H2SO4 với nước được dùng làm chất điện giải trong các loại ắc quy axit-chì.
Ước tính mỗi năm có khoảng 160 triệu tấn H2SO4 được sử dụng trên toàn thế giới, với các ngành công nghiệp tiêu thụ lớn nhất là:
- Phân bón: 30%
- Chất tẩy rửa: 14%
- Giấy, sợi: 8%
- Chất dẻo: 5%
- Luyện kim: 2%
- Phẩm nhuộm: 2%
2.3. Trong Xử Lý Nước Thải
Axit sunfuric được sử dụng để sản xuất nhôm hydroxit (Al(OH)3), chất này được dùng trong các nhà máy xử lý nước để lọc tạp chất, cải thiện mùi vị của nước, trung hòa độ pH, loại bỏ các ion Ca2+, Mg2+ có trong nước thải.
Lưu ý quan trọng: Axit sunfuric là một hóa chất nguy hiểm, có thể gây ăn mòn và bỏng da nghiêm trọng. Khi sử dụng, cần trang bị đầy đủ các dụng cụ bảo hộ chuyên dụng như mặt nạ phòng độc cá nhân, khẩu trang, tủ hút khí để pha chế.
2.4. Trong Phòng Thí Nghiệm
Axit sunfuric đậm đặc được dùng để điều chế các axit khác yếu hơn như HNO3, HCl trong các thí nghiệm. Nó cũng là một hóa chất không thể thiếu trong các phản ứng hóa học để đưa ra những kết quả và ứng dụng trong các lĩnh vực khác của cuộc sống.
3. Những Lưu Ý Khi Sử Dụng Và Cách Bảo Quản H2SO4
3.1. Lưu Ý Khi Sử Dụng H2SO4
Khi sử dụng dung dịch H2SO4, cần tuân thủ các biện pháp an toàn sau:
- Pha loãng đúng cách: Luôn thêm từ từ axit vào nước, không làm ngược lại. Khuấy đều trong quá trình pha loãng.
- Sử dụng đồ bảo hộ: Đeo găng tay và kính bảo hộ khi tiếp xúc với H2SO4 loãng. Khi tiếp xúc với axit đậm đặc, cần có tấm bảo vệ mặt và tạp dề PVC để đảm bảo an toàn tối đa.
- Tránh tiếp xúc trực tiếp: Không để axit tiếp xúc với da, mắt hoặc quần áo. Nếu xảy ra tiếp xúc, rửa ngay lập tức bằng nhiều nước và tìm kiếm sự chăm sóc y tế.
3.2. Lưu Ý Khi Bảo Quản Dung Dịch H2SO4
Để bảo quản dung dịch H2SO4 an toàn, cần tuân thủ các nguyên tắc sau:
- Tránh xa bazơ và chất khử: Vì là một axit mạnh, H2SO4 cần được bảo quản tránh xa bazơ và các chất khử.
- Chất liệu chứa đựng: Sử dụng các vật liệu chứa đựng phù hợp, chịu được tính ăn mòn của axit như nhựa polyethylene (PE) hoặc thép không gỉ.
- Nơi khô ráo, thoáng mát: Bảo quản H2SO4 ở nơi khô ráo, thoáng mát, tránh ánh nắng trực tiếp và nhiệt độ cao.
- Đậy kín: Đảm bảo đậy kín các thùng chứa để tránh axit hấp thụ hơi ẩm từ không khí.
4. Địa Chỉ Mua Hóa Chất Sunfuric Chất Lượng?
Bạn đang tìm kiếm địa chỉ mua dung dịch axit sunfuric chất lượng? Hãy đến với XETAIMYDINH.EDU.VN, nơi cung cấp các loại hóa chất công nghiệp uy tín, bao gồm cả axit sunfuric. Sản phẩm của chúng tôi được ứng dụng rộng rãi trong nhiều lĩnh vực như trung hòa pH trong xử lý nước thải, loại bỏ các ion Mg2+, Ca2+ trong nước thải, sản xuất phân bón, chế biến quặng, tổng hợp hóa học, tinh chế dầu mỏ.
Khi mua hàng tại XETAIMYDINH.EDU.VN, bạn sẽ nhận được:
- Sản phẩm chất lượng: Axit sunfuric đảm bảo tiêu chuẩn, nguồn gốc rõ ràng.
- Tư vấn tận tình: Đội ngũ chuyên viên giàu kinh nghiệm sẵn sàng tư vấn, hỗ trợ bạn lựa chọn sản phẩm phù hợp.
- Dịch vụ giao hàng nhanh chóng: Giao hàng tận nơi, đảm bảo an toàn và đúng hẹn.
- Giá cả cạnh tranh: Mức giá tốt nhất trên thị trường, đi kèm nhiều ưu đãi hấp dẫn.
Đừng chần chừ, hãy liên hệ ngay với XETAIMYDINH.EDU.VN qua hotline 0247 309 9988 hoặc truy cập trang web XETAIMYDINH.EDU.VN để được tư vấn và đặt hàng nhanh nhất. Địa chỉ của chúng tôi là Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội, rất hân hạnh được phục vụ quý khách.
5. FAQ – Câu Hỏi Thường Gặp Về Dung Dịch H2SO4
5.1. Dung Dịch H2SO4 Có Ăn Mòn Không?
Có, dung dịch H2SO4 là một chất ăn mòn mạnh, đặc biệt là ở nồng độ cao. Nó có thể gây tổn thương nghiêm trọng cho da, mắt và các vật liệu khác.
5.2. Làm Thế Nào Để Pha Loãng Dung Dịch H2SO4 An Toàn?
Để pha loãng H2SO4 an toàn, luôn thêm từ từ axit vào nước, không bao giờ làm ngược lại. Sử dụng thiết bị bảo hộ như găng tay và kính bảo hộ.
5.3. Dung Dịch H2SO4 Được Sử Dụng Để Làm Gì Trong Xử Lý Nước Thải?
H2SO4 được sử dụng để điều chỉnh độ pH của nước thải, loại bỏ các ion kim loại nặng và hỗ trợ quá trình keo tụ để loại bỏ các chất rắn lơ lửng.
5.4. Dung Dịch H2SO4 Có Tác Dụng Gì Trong Sản Xuất Phân Bón?
H2SO4 là một nguyên liệu quan trọng trong sản xuất phân lân và phân đạm, giúp chuyển đổi các khoáng chất thành dạng mà cây trồng có thể hấp thụ.
5.5. Dung Dịch H2SO4 Có Thể Lưu Trữ Trong Loại Vật Liệu Nào?
H2SO4 có thể được lưu trữ trong các thùng chứa làm từ polyethylene (PE), polypropylene (PP) hoặc thép không gỉ, tùy thuộc vào nồng độ và nhiệt độ.
5.6. Điều Gì Xảy Ra Nếu Dung Dịch H2SO4 Tiếp Xúc Với Da?
Nếu H2SO4 tiếp xúc với da, ngay lập tức rửa khu vực bị ảnh hưởng bằng nhiều nước trong ít nhất 15-20 phút và tìm kiếm sự chăm sóc y tế.
5.7. Tại Sao Dung Dịch H2SO4 Lại Được Sử Dụng Trong Ắc Quy?
Dung dịch H2SO4 được sử dụng làm chất điện ly trong ắc quy axit-chì, giúp tạo ra dòng điện thông qua các phản ứng hóa học.
5.8. Dung Dịch H2SO4 Có Gây Nguy Hiểm Cho Môi Trường Không?
Có, nếu không được xử lý đúng cách, H2SO4 có thể gây ô nhiễm môi trường, đặc biệt là ô nhiễm nguồn nước và đất.
5.9. Làm Thế Nào Để Trung Hòa Dung Dịch H2SO4 Bị Đổ?
Để trung hòa H2SO4 bị đổ, sử dụng các chất kiềm như baking soda (NaHCO3) hoặc vôi (Ca(OH)2) để trung hòa axit trước khi làm sạch.
5.10. Dung Dịch H2SO4 Có Mùi Gì Không?
Dung dịch H2SO4 nguyên chất không có mùi. Tuy nhiên, khi phản ứng với các chất khác, nó có thể tạo ra các khí có mùi khó chịu.
Bạn có bất kỳ thắc mắc nào khác về xe tải hoặc cần tư vấn về các dịch vụ của Xe Tải Mỹ Đình? Hãy liên hệ với chúng tôi ngay hôm nay để được hỗ trợ tốt nhất.
Hy vọng bài viết này đã cung cấp cho bạn cái nhìn tổng quan và chi tiết về dung dịch H2SO4. Nếu bạn có bất kỳ câu hỏi nào hoặc cần thêm thông tin, đừng ngần ngại liên hệ với XETAIMYDINH.EDU.VN để được tư vấn và hỗ trợ. Chúng tôi luôn sẵn lòng đồng hành cùng bạn!
