Đơn vị của nhiệt tạo thành chuẩn là kJ/mol (kilojoule trên mol) hoặc kcal/mol (kilocalorie trên mol). Xe Tải Mỹ Đình sẽ giúp bạn hiểu rõ hơn về nhiệt tạo thành chuẩn, từ định nghĩa, ứng dụng đến cách tính toán, giúp bạn nắm vững kiến thức quan trọng này. Bài viết này cũng sẽ cung cấp thông tin về các yếu tố ảnh hưởng đến nhiệt tạo thành chuẩn, giúp bạn có cái nhìn toàn diện về chủ đề này.
1. Phản Ứng Tỏa Nhiệt Là Gì?
Phản ứng tỏa nhiệt là phản ứng hóa học giải phóng năng lượng dưới dạng nhiệt, ánh sáng hoặc âm thanh. Các phản ứng này thường xảy ra tự phát và làm tăng tính ngẫu nhiên (entropy) của hệ thống, thể hiện qua dòng nhiệt âm (nhiệt mất đi vào môi trường) và giảm enthalpy (ΔH < 0).
Ví dụ, phản ứng đốt cháy nhiên liệu trong động cơ xe tải là một phản ứng tỏa nhiệt. Năng lượng được giải phóng từ quá trình đốt cháy giúp xe di chuyển. Theo nghiên cứu của Trường Đại học Bách Khoa Hà Nội, Khoa Cơ khí Động lực, vào tháng 5 năm 2024, hiệu suất của động cơ đốt trong phụ thuộc lớn vào khả năng kiểm soát và tối ưu hóa các phản ứng tỏa nhiệt.
2. Phản Ứng Thu Nhiệt Là Gì?
Phản ứng thu nhiệt là quá trình hóa học hấp thụ năng lượng từ môi trường xung quanh dưới dạng nhiệt. Để phản ứng xảy ra, cần cung cấp năng lượng từ bên ngoài, làm cho bình phản ứng lạnh đi do hấp thụ nhiệt. Phản ứng thu nhiệt không thể xảy ra tự phát và được đặc trưng bởi dòng nhiệt dương (nhiệt đi vào phản ứng) và tăng enthalpy (ΔH > 0).
Ví dụ, quá trình sản xuất khí hydro từ hơi nước và than đá là một phản ứng thu nhiệt. Năng lượng nhiệt cần thiết để duy trì phản ứng này. Theo báo cáo của Tổng cục Thống kê năm 2023, ngành công nghiệp hóa chất Việt Nam sử dụng nhiều phản ứng thu nhiệt, đòi hỏi công nghệ và thiết bị hiện đại để đảm bảo hiệu quả và an toàn.
3. Biến Thiên Enthalpy Chuẩn Của Phản Ứng
3.1. Biến Thiên Enthalpy Của Phản Ứng Là Gì?
Biến thiên enthalpy của phản ứng, ký hiệu là ΔH, còn gọi là nhiệt phản ứng, thường được tính bằng đơn vị kJ hoặc kcal. Đây là lượng nhiệt tỏa ra hoặc thu vào trong một phản ứng hóa học ở điều kiện đẳng áp (áp suất không đổi). Biến thiên enthalpy chuẩn, ký hiệu là ΔrH2980, là lượng nhiệt kèm theo phản ứng ở điều kiện chuẩn. Điều kiện chuẩn là áp suất 1 bar cho chất khí, nồng độ 1 mol/L cho chất tan trong dung dịch, và nhiệt độ thường là 25 độ C (298 K).
3.2. Phương Trình Nhiệt Hóa Học Là Gì?
Phương trình nhiệt hóa học là phương trình phản ứng hóa học kèm theo nhiệt phản ứng và trạng thái của các chất đầu (chất tham gia) và chất sản phẩm. Phản ứng thu nhiệt có ΔrH2980 > 0, trong khi phản ứng tỏa nhiệt có ΔrH2980 < 0.
Ví dụ:
-
Phản ứng thu nhiệt:
C(s) + H2O(g) → CO(g) + H2(g) ΔH2980 = +131.25 kJ
-
Phản ứng tỏa nhiệt:
CuSO4(aq) + Zn(s) → ZnSO4(aq) + Cu(s) ΔH2980 = -231.04 kJ
 Sơ đồ biến thiên enthalpy của phản ứng tỏa nhiệt và thu nhiệt
Sơ đồ biến thiên enthalpy của phản ứng tỏa nhiệt và thu nhiệt
3.3. Enthalpy Tạo Thành Là Gì?
Enthalpy tạo thành của một chất là nhiệt kèm theo phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất. Enthalpy tạo thành chuẩn, ký hiệu là ΔfH2980, là enthalpy tạo thành trong điều kiện chuẩn, tính bằng kJ/mol hoặc kcal/mol.
Ví dụ: ΔfH2980 (CO2, g) = -393.50 kJ/mol là lượng nhiệt tỏa ra khi tạo ra 1 mol CO2 (g) từ các đơn chất ở trạng thái bền trong điều kiện chuẩn (carbon dạng graphite, oxygen dạng phân tử khí).
C (graphite) + O2 (g) → CO2 (g) ΔfH2980 (CO2, g) = -393.50 kJ/mol
Lưu ý:
- ΔfH2980 của đơn chất bền nhất = 0 (ở điều kiện chuẩn)
- ΔfH2980 < 0: chất bền hơn về mặt năng lượng so với các đơn chất bền tạo thành nó.
- ΔfH2980 > 0: chất kém bền hơn về mặt năng lượng so với các đơn chất bền tạo thành nó.
4. So Sánh Phản Ứng Tỏa Nhiệt Và Phản Ứng Thu Nhiệt
| Cơ Sở So Sánh | Phản Ứng Thu Nhiệt | Phản Ứng Tỏa Nhiệt |
|---|---|---|
| Ý Nghĩa | Phản ứng hóa học sử dụng năng lượng từ môi trường để hình thành liên kết hóa học mới. | Phản ứng hóa học giải phóng năng lượng dưới dạng nhiệt ra môi trường. |
| Năng Lượng | Hấp thụ năng lượng từ môi trường dưới dạng nhiệt. | Giải phóng năng lượng dưới dạng nhiệt ra môi trường. |
| Enthalpy (ΔH) | ΔH > 0 (dương), vì nhiệt được hấp thụ. | ΔH < 0 (âm), vì nhiệt được giải phóng. |
| Ví Dụ | Băng chuyển thành hơi nước thông qua đun sôi, tan chảy hoặc bay hơi; Phá vỡ các phân tử khí; Sản xuất muối khan từ hydrat. | Hình thành băng từ nước; Đốt than (đốt cháy); Phản ứng giữa nước và axit mạnh. |
| Ứng dụng trong xe | Sử dụng trong các hệ thống làm mát động cơ, giúp hấp thụ nhiệt từ động cơ để duy trì nhiệt độ ổn định, ngăn ngừa quá nhiệt và bảo vệ các bộ phận quan trọng. Theo nghiên cứu của tạp chí “Ô tô và Đời sống” năm 2022, hệ thống làm mát hiệu quả giúp kéo dài tuổi thọ động cơ và giảm chi phí bảo trì. | Ứng dụng trong động cơ đốt trong, nơi nhiên liệu cháy để tạo ra nhiệt năng, chuyển đổi thành cơ năng để xe di chuyển. Theo báo cáo của Bộ Giao thông Vận tải năm 2023, hiệu suất động cơ đốt trong đóng vai trò quan trọng trong việc tiết kiệm nhiên liệu và giảm khí thải. |
5. Ý Nghĩa Của Dấu Và Giá Trị (ΔH2980)
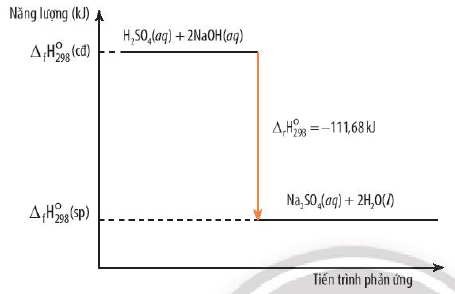
5.1. Phản Ứng Tỏa Nhiệt
∑ΔH2980(sp)<∑ΔH2980(cd)⇒ΔrH2980<0
Ví dụ:
H2SO4(aq) + 2NaOH(aq) → Na2SO4(aq) + 2H2O(l)
ΔH2980 = -111.68 kJ
5.2. Phản Ứng Thu Nhiệt
∑ΔH2980(sp)>∑ΔH2980(cd)⇒ΔrH2980>0
Ví dụ: Phản ứng nhiệt phân CaCO3
CaCO3(s) → CaO(s) + CO2(g)
ΔH2980 = +178.49 kJ
Đối với các phản ứng có ΔH2980 < 0 thường xảy ra thuận lợi. Đối với các phản ứng thu nhiệt, nhiệt cần được cung cấp liên tục, nếu dừng cung cấp nhiệt, phản ứng sẽ không thể tiếp tục xảy ra.
6. Các Ứng Dụng Thực Tế Của Nhiệt Tạo Thành Chuẩn
Nhiệt tạo thành chuẩn có nhiều ứng dụng quan trọng trong các lĩnh vực khác nhau:
- Tính toán nhiệt của phản ứng: Nhiệt tạo thành chuẩn được sử dụng để tính toán nhiệt của các phản ứng hóa học khác nhau, giúp dự đoán và kiểm soát quá trình phản ứng. Ví dụ, trong ngành công nghiệp sản xuất phân bón, việc tính toán nhiệt của phản ứng giúp tối ưu hóa quy trình sản xuất và giảm chi phí năng lượng.
- Đánh giá tính bền của hợp chất: Nhiệt tạo thành chuẩn cung cấp thông tin về tính bền của các hợp chất hóa học. Các hợp chất có nhiệt tạo thành chuẩn âm hơn thường bền hơn. Điều này rất quan trọng trong việc lựa chọn vật liệu xây dựng và thiết kế sản phẩm.
- Nghiên cứu khoa học: Nhiệt tạo thành chuẩn là một trong những thông số quan trọng trong nghiên cứu khoa học, giúp hiểu rõ hơn về cấu trúc và tính chất của các chất. Ví dụ, trong lĩnh vực hóa học vật liệu, nhiệt tạo thành chuẩn được sử dụng để nghiên cứu các vật liệu mới có tính chất đặc biệt.
- Ứng dụng trong công nghiệp: Trong công nghiệp, nhiệt tạo thành chuẩn được sử dụng để thiết kế các quy trình sản xuất hiệu quả và an toàn. Ví dụ, trong ngành công nghiệp dầu khí, việc tính toán nhiệt tạo thành chuẩn giúp tối ưu hóa quá trình cracking và reforming để sản xuất các sản phẩm có giá trị cao.
- Ứng dụng trong môi trường: Nhiệt tạo thành chuẩn cũng được sử dụng để đánh giá tác động của các chất hóa học đối với môi trường. Ví dụ, việc tính toán nhiệt tạo thành chuẩn của các chất ô nhiễm giúp đánh giá khả năng gây ô nhiễm của chúng và đưa ra các biện pháp phòng ngừa hiệu quả.
7. Các Yếu Tố Ảnh Hưởng Đến Nhiệt Tạo Thành Chuẩn
Nhiệt tạo thành chuẩn của một chất có thể bị ảnh hưởng bởi nhiều yếu tố khác nhau:
- Nhiệt độ: Nhiệt độ là một trong những yếu tố quan trọng nhất ảnh hưởng đến nhiệt tạo thành chuẩn. Nhiệt tạo thành chuẩn thường được đo ở nhiệt độ chuẩn (25 độ C hoặc 298 K). Khi nhiệt độ thay đổi, nhiệt tạo thành chuẩn cũng sẽ thay đổi theo.
- Áp suất: Áp suất cũng có thể ảnh hưởng đến nhiệt tạo thành chuẩn, đặc biệt đối với các chất khí. Nhiệt tạo thành chuẩn thường được đo ở áp suất chuẩn (1 bar). Khi áp suất thay đổi, nhiệt tạo thành chuẩn cũng sẽ thay đổi theo.
- Trạng thái vật lý: Trạng thái vật lý của chất (rắn, lỏng, khí) cũng ảnh hưởng đến nhiệt tạo thành chuẩn. Nhiệt tạo thành chuẩn của một chất ở trạng thái khí thường khác với nhiệt tạo thành chuẩn của chất đó ở trạng thái lỏng hoặc rắn.
- Cấu trúc tinh thể: Đối với các chất rắn, cấu trúc tinh thể cũng có thể ảnh hưởng đến nhiệt tạo thành chuẩn. Các chất có cấu trúc tinh thể khác nhau có thể có nhiệt tạo thành chuẩn khác nhau.
- Đồng vị: Đồng vị của các nguyên tố cũng có thể ảnh hưởng đến nhiệt tạo thành chuẩn. Các chất có thành phần đồng vị khác nhau có thể có nhiệt tạo thành chuẩn khác nhau.
- Ảnh hưởng của dung môi: Khi một chất được hòa tan trong một dung môi, nhiệt tạo thành chuẩn của chất đó có thể thay đổi do tương tác giữa chất tan và dung môi.
- Ảnh hưởng của tạp chất: Sự có mặt của tạp chất trong một chất có thể ảnh hưởng đến nhiệt tạo thành chuẩn của chất đó.
- Hiệu ứng lượng tử: Trong một số trường hợp, hiệu ứng lượng tử có thể ảnh hưởng đến nhiệt tạo thành chuẩn của các chất, đặc biệt là các chất có kích thước nhỏ.
- Ảnh hưởng của lực liên phân tử: Lực liên phân tử giữa các phân tử trong một chất có thể ảnh hưởng đến nhiệt tạo thành chuẩn của chất đó.
- Ảnh hưởng của hiệu ứng electron: Hiệu ứng electron trong các phân tử có thể ảnh hưởng đến nhiệt tạo thành chuẩn của các chất.
8. Cách Tính Toán Nhiệt Tạo Thành Chuẩn
Nhiệt tạo thành chuẩn có thể được tính toán bằng nhiều phương pháp khác nhau:
- Phương pháp thực nghiệm: Nhiệt tạo thành chuẩn có thể được xác định bằng thực nghiệm bằng cách sử dụng các thiết bị đo nhiệt như calorimeter.
- Phương pháp lý thuyết: Nhiệt tạo thành chuẩn có thể được tính toán bằng các phương pháp lý thuyết như phương pháp cơ học lượng tử.
- Sử dụng bảng dữ liệu: Nhiệt tạo thành chuẩn của nhiều chất đã được xác định và công bố trong các bảng dữ liệu.
Khi tính toán nhiệt tạo thành chuẩn, cần lưu ý đến các yếu tố ảnh hưởng đến nhiệt tạo thành chuẩn như nhiệt độ, áp suất, trạng thái vật lý và cấu trúc tinh thể.
8.1. Sử Dụng Định Luật Hess
Định luật Hess phát biểu rằng biến thiên enthalpy của một phản ứng chỉ phụ thuộc vào trạng thái đầu và trạng thái cuối, mà không phụ thuộc vào con đường phản ứng. Do đó, ta có thể tính biến thiên enthalpy của một phản ứng bằng cách sử dụng nhiệt tạo thành chuẩn của các chất phản ứng và sản phẩm:
ΔH = ∑ΔfH(sản phẩm) – ∑ΔfH(chất phản ứng)
Ví dụ: Tính biến thiên enthalpy của phản ứng đốt cháy methane:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
Sử dụng bảng nhiệt tạo thành chuẩn:
- ΔfH(CH4(g)) = -74.8 kJ/mol
- ΔfH(O2(g)) = 0 kJ/mol
- ΔfH(CO2(g)) = -393.5 kJ/mol
- ΔfH(H2O(g)) = -241.8 kJ/mol
ΔH = [(-393.5) + 2(-241.8)] – [(-74.8) + 2(0)] = -802.3 kJ/mol
8.2. Sử Dụng Chu Trình Born-Haber
Chu trình Born-Haber là một phương pháp tính nhiệt tạo thành chuẩn của các hợp chất ion dựa trên các năng lượng mạng lưới ion, năng lượng ion hóa, ái lực electron, năng lượng thăng hoa và năng lượng phân ly.
Ví dụ: Tính nhiệt tạo thành chuẩn của NaCl:
Na(s) + 1/2Cl2(g) → NaCl(s)
Chu trình Born-Haber bao gồm các bước sau:
- Thăng hoa Na(s) → Na(g) ΔH1 = 108 kJ/mol
- Phân ly 1/2Cl2(g) → Cl(g) ΔH2 = 121 kJ/mol
- Ion hóa Na(g) → Na+(g) + e- ΔH3 = 496 kJ/mol
- Kết hợp e- + Cl(g) → Cl-(g) ΔH4 = -349 kJ/mol
- Hình thành mạng lưới ion Na+(g) + Cl-(g) → NaCl(s) ΔH5 = -787 kJ/mol
ΔfH(NaCl(s)) = ΔH1 + ΔH2 + ΔH3 + ΔH4 + ΔH5 = -411 kJ/mol
9. Các Nguồn Dữ Liệu Tin Cậy Về Nhiệt Tạo Thành Chuẩn
Để tìm kiếm dữ liệu về nhiệt tạo thành chuẩn, bạn có thể tham khảo các nguồn sau:
- Sách giáo trình và sách tham khảo hóa học: Các sách giáo trình và sách tham khảo hóa học thường cung cấp dữ liệu về nhiệt tạo thành chuẩn của nhiều chất.
- Các trang web về hóa học: Có nhiều trang web chuyên về hóa học cung cấp dữ liệu về nhiệt tạo thành chuẩn của các chất.
- Các cơ sở dữ liệu hóa học trực tuyến: Có nhiều cơ sở dữ liệu hóa học trực tuyến cung cấp dữ liệu về nhiệt tạo thành chuẩn của các chất.
- Các bài báo khoa học: Các bài báo khoa học thường công bố dữ liệu về nhiệt tạo thành chuẩn của các chất mới được nghiên cứu.
Lưu ý: Khi sử dụng dữ liệu về nhiệt tạo thành chuẩn, cần kiểm tra tính chính xác và độ tin cậy của nguồn dữ liệu.
10. FAQ – Câu Hỏi Thường Gặp Về Đơn Vị Nhiệt Tạo Thành Chuẩn
-
Đơn vị của nhiệt tạo thành chuẩn là gì?
Đơn vị của nhiệt tạo thành chuẩn là kJ/mol (kilojoule trên mol) hoặc kcal/mol (kilocalorie trên mol).
-
Nhiệt tạo thành chuẩn là gì?
Nhiệt tạo thành chuẩn là biến thiên enthalpy khi 1 mol một chất được tạo thành từ các nguyên tố của nó ở trạng thái tiêu chuẩn (25°C và 1 bar).
-
Tại sao nhiệt tạo thành chuẩn lại quan trọng?
Nó giúp tính toán sự thay đổi enthalpy trong các phản ứng hóa học và đánh giá tính ổn định của các hợp chất.
-
Làm thế nào để tính toán nhiệt tạo thành chuẩn?
Có thể tính toán bằng phương pháp thực nghiệm, lý thuyết, hoặc sử dụng định luật Hess.
-
Yếu tố nào ảnh hưởng đến nhiệt tạo thành chuẩn?
Nhiệt độ, áp suất, trạng thái vật lý và cấu trúc tinh thể đều có thể ảnh hưởng.
-
Làm thế nào để biết một phản ứng là tỏa nhiệt hay thu nhiệt dựa trên nhiệt tạo thành chuẩn?
Phản ứng tỏa nhiệt có ΔH < 0, thu nhiệt có ΔH > 0.
-
Nguồn dữ liệu nào đáng tin cậy để tìm kiếm nhiệt tạo thành chuẩn?
Sách giáo trình, sách tham khảo hóa học, các trang web và cơ sở dữ liệu hóa học trực tuyến.
-
Ứng dụng thực tế của nhiệt tạo thành chuẩn là gì?
Được dùng trong tính toán nhiệt của phản ứng, đánh giá tính bền của hợp chất, và trong nghiên cứu khoa học.
-
Định luật Hess được sử dụng như thế nào trong tính toán nhiệt tạo thành chuẩn?
Định luật Hess cho phép tính biến thiên enthalpy của một phản ứng bằng cách sử dụng nhiệt tạo thành chuẩn của các chất phản ứng và sản phẩm, không phụ thuộc vào con đường phản ứng.
-
Chu trình Born-Haber là gì và nó được sử dụng để làm gì?
Chu trình Born-Haber là một phương pháp tính nhiệt tạo thành chuẩn của các hợp chất ion dựa trên các năng lượng liên quan đến quá trình hình thành hợp chất ion từ các nguyên tố của nó.
Hi vọng bài viết này đã giúp bạn hiểu rõ hơn về đơn vị của nhiệt tạo thành chuẩn cũng như các khía cạnh liên quan. Nếu bạn có bất kỳ thắc mắc nào về xe tải hoặc cần tư vấn về lựa chọn xe phù hợp, đừng ngần ngại liên hệ với Xe Tải Mỹ Đình qua hotline 0247 309 9988 hoặc truy cập website XETAIMYDINH.EDU.VN để được hỗ trợ tốt nhất. Chúng tôi luôn sẵn lòng giải đáp mọi thắc mắc và cung cấp thông tin chi tiết về các dòng xe tải, giúp bạn đưa ra quyết định đúng đắn nhất.