Phản ứng tỏa nhiệt là quá trình hóa học giải phóng năng lượng dưới dạng nhiệt. Bạn muốn biết điều kiện để phản ứng này xảy ra? Xe Tải Mỹ Đình sẽ cung cấp thông tin chi tiết nhất về các yếu tố ảnh hưởng đến phản ứng tỏa nhiệt, giúp bạn hiểu rõ hơn về bản chất và ứng dụng của chúng. Khám phá ngay các yếu tố then chốt, từ năng lượng hoạt hóa đến điều kiện môi trường, và tìm hiểu thêm về ứng dụng thực tế của phản ứng tỏa nhiệt trong đời sống và công nghiệp!
1. Phản Ứng Tỏa Nhiệt Là Gì?
Phản ứng tỏa nhiệt là một quá trình hóa học, trong đó năng lượng được giải phóng ra môi trường xung quanh dưới dạng nhiệt, ánh sáng hoặc âm thanh. Điểm đặc trưng của phản ứng tỏa nhiệt là sự giảm enthalpy (ΔH < 0), cho thấy hệ thống mất năng lượng vào môi trường. Các phản ứng này thường xảy ra tự phát và dẫn đến sự gia tăng entropy (độ hỗn loạn) của hệ thống (S > 0).
Ví dụ kinh điển về phản ứng tỏa nhiệt bao gồm:
- Đốt cháy nhiên liệu (gỗ, than, gas…)
- Phản ứng trung hòa giữa axit và bazơ
- Sự hình thành nước từ hydro và oxy
2. Điều Kiện Cần Thiết Để Phản Ứng Tỏa Nhiệt Xảy Ra
Vậy, điều Kiện để Xảy Ra Phản ứng Tỏa Nhiệt là gì? Có nhiều yếu tố ảnh hưởng đến khả năng xảy ra và tốc độ của một phản ứng tỏa nhiệt. Dưới đây là các điều kiện chính:
2.1. Năng Lượng Hoạt Hóa Đủ Lớn
Năng lượng hoạt hóa (Ea) là năng lượng tối thiểu cần thiết để bắt đầu một phản ứng hóa học. Ngay cả đối với phản ứng tỏa nhiệt, vẫn cần một lượng năng lượng ban đầu để phá vỡ các liên kết cũ và tạo điều kiện cho việc hình thành liên kết mới.
- Khái niệm: Năng lượng hoạt hóa được ví như “cú huých” ban đầu để “khởi động” phản ứng.
- Ảnh hưởng: Nếu năng lượng hoạt hóa quá cao, phản ứng sẽ khó xảy ra hoặc diễn ra rất chậm, ngay cả khi nó là phản ứng tỏa nhiệt.
- Ví dụ: Để đốt cháy một khúc gỗ, bạn cần mồi lửa (cung cấp năng lượng hoạt hóa) để bắt đầu quá trình cháy.
2.2. Nhiệt Độ Thích Hợp
Nhiệt độ có vai trò quan trọng trong việc cung cấp năng lượng hoạt hóa cho các phân tử.
- Ảnh hưởng: Nhiệt độ cao hơn làm tăng động năng của các phân tử, giúp chúng va chạm mạnh hơn và dễ dàng vượt qua rào cản năng lượng hoạt hóa.
- Lưu ý: Mỗi phản ứng tỏa nhiệt có một khoảng nhiệt độ tối ưu. Nhiệt độ quá cao có thể gây ra các phản ứng phụ không mong muốn hoặc phân hủy các chất tham gia.
- Ví dụ: Phản ứng đốt cháy methane (CH4) cần một nhiệt độ đủ cao để bắt đầu, nhưng nếu nhiệt độ quá cao có thể tạo ra các sản phẩm phụ như carbon monoxide (CO), một chất khí độc hại.
2.3. Áp Suất Phù Hợp (Đối Với Phản Ứng Có Chất Khí)
Đối với các phản ứng có sự tham gia của chất khí, áp suất có thể ảnh hưởng đáng kể đến tốc độ phản ứng.
- Ảnh hưởng: Áp suất cao hơn làm tăng nồng độ của các chất khí, dẫn đến tăng tần suất va chạm giữa các phân tử và làm tăng tốc độ phản ứng.
- Nguyên lý: Theo nguyên lý Le Chatelier, việc tăng áp suất sẽ làm dịch chuyển cân bằng theo hướng giảm số mol khí, từ đó thúc đẩy phản ứng tỏa nhiệt nếu nó tạo ra ít mol khí hơn.
- Ví dụ: Trong quá trình sản xuất ammonia (NH3) từ nitrogen (N2) và hydrogen (H2), áp suất cao được sử dụng để tăng hiệu suất phản ứng.
2.4. Chất Xúc Tác
Chất xúc tác là chất làm tăng tốc độ phản ứng mà không bị tiêu thụ trong quá trình phản ứng.
- Cơ chế: Chất xúc tác hoạt động bằng cách giảm năng lượng hoạt hóa của phản ứng, tạo ra một con đường phản ứng khác với năng lượng hoạt hóa thấp hơn.
- Phân loại: Chất xúc tác có thể là chất đồng thể (cùng pha với chất phản ứng) hoặc chất dị thể (khác pha với chất phản ứng).
- Ví dụ: Trong công nghiệp sản xuất sulfuric acid (H2SO4), vanadium pentoxide (V2O5) được sử dụng làm chất xúc tác để tăng tốc độ phản ứng oxy hóa sulfur dioxide (SO2) thành sulfur trioxide (SO3).
2.5. Nồng Độ Chất Phản Ứng
Nồng độ của các chất phản ứng ảnh hưởng trực tiếp đến tốc độ phản ứng.
- Ảnh hưởng: Nồng độ cao hơn có nghĩa là có nhiều phân tử phản ứng hơn trong một đơn vị thể tích, dẫn đến tăng tần suất va chạm và làm tăng tốc độ phản ứng.
- Nguyên lý: Theo định luật tốc độ phản ứng, tốc độ phản ứng thường tỉ lệ thuận với nồng độ của các chất phản ứng (hoặc lũy thừa của nồng độ).
- Ví dụ: Khi bạn tăng lượng xăng (chất phản ứng) trong động cơ đốt trong, lượng nhiệt và năng lượng sinh ra cũng tăng lên, làm cho động cơ hoạt động mạnh mẽ hơn.
2.6. Diện Tích Bề Mặt Tiếp Xúc (Đối Với Phản Ứng Dị Thể)
Đối với các phản ứng dị thể (phản ứng xảy ra giữa các chất ở các pha khác nhau), diện tích bề mặt tiếp xúc giữa các chất phản ứng là một yếu tố quan trọng.
- Ảnh hưởng: Diện tích bề mặt lớn hơn tạo điều kiện cho nhiều phân tử phản ứng tiếp xúc với nhau hơn, làm tăng tốc độ phản ứng.
- Ví dụ: Gỗ vụn sẽ cháy nhanh hơn một khúc gỗ lớn vì gỗ vụn có diện tích bề mặt tiếp xúc với oxy lớn hơn.
2.7. Điều Kiện Môi Trường
Môi trường xung quanh có thể ảnh hưởng đến phản ứng tỏa nhiệt thông qua nhiều yếu tố.
- Ví dụ: Độ ẩm, ánh sáng, và sự có mặt của các chất ức chế có thể làm chậm hoặc ngăn chặn phản ứng.
- Ứng dụng: Trong công nghiệp, các nhà máy thường kiểm soát chặt chẽ các yếu tố môi trường để đảm bảo phản ứng diễn ra hiệu quả và an toàn.
 Phản ứng tỏa nhiệt và thu nhiệt
Phản ứng tỏa nhiệt và thu nhiệt
3. Các Loại Phản Ứng Tỏa Nhiệt Phổ Biến
Phản ứng tỏa nhiệt có mặt ở khắp mọi nơi trong đời sống và công nghiệp. Dưới đây là một số loại phản ứng tỏa nhiệt phổ biến:
3.1. Phản Ứng Đốt Cháy
Đốt cháy là phản ứng hóa học giữa một chất và chất oxy hóa, thường là oxy, tạo ra nhiệt và ánh sáng.
- Ứng dụng: Cung cấp năng lượng cho các động cơ, nhà máy điện, hệ thống sưởi ấm, và nhiều ứng dụng khác.
- Ví dụ: Đốt cháy nhiên liệu như gỗ, than, dầu, và gas.
3.2. Phản Ứng Trung Hòa
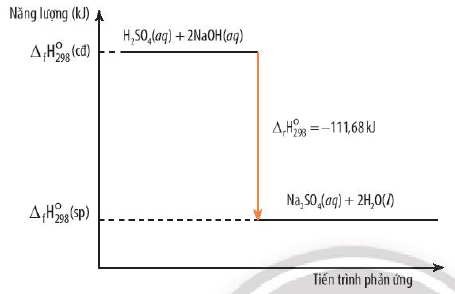
Phản ứng trung hòa là phản ứng giữa axit và bazơ, tạo ra muối và nước, đồng thời giải phóng nhiệt.
- Ứng dụng: Sử dụng trong xử lý nước thải, sản xuất phân bón, và nhiều quy trình công nghiệp khác.
- Ví dụ: Phản ứng giữa hydrochloric acid (HCl) và sodium hydroxide (NaOH).
3.3. Phản Ứng Hạt Nhân
Phản ứng hạt nhân là quá trình biến đổi hạt nhân nguyên tử, giải phóng một lượng năng lượng khổng lồ.
- Ứng dụng: Sản xuất điện trong các nhà máy điện hạt nhân, nghiên cứu khoa học, và trong một số loại vũ khí.
- Ví dụ: Phản ứng phân hạch uranium trong lò phản ứng hạt nhân.
3.4. Sự Đông Đặc và Kết Tinh
Sự đông đặc (chuyển từ lỏng sang rắn) và kết tinh (tạo thành tinh thể từ dung dịch) cũng là các quá trình tỏa nhiệt.
- Ứng dụng: Sản xuất các vật liệu rắn, làm lạnh, và trong nhiều quy trình công nghiệp khác.
- Ví dụ: Sự đông đặc của nước thành đá.
3.5. Phản Ứng Oxy Hóa – Khử
Phản ứng oxy hóa – khử (redox) là phản ứng trong đó có sự chuyển giao electron giữa các chất phản ứng. Nhiều phản ứng oxy hóa – khử là phản ứng tỏa nhiệt.
- Ứng dụng: Sản xuất điện trong pin và ắc quy, xử lý bề mặt kim loại, và trong nhiều quy trình công nghiệp khác.
- Ví dụ: Phản ứng giữa kẽm (Zn) và đồng(II) sulfate (CuSO4).
4. Ứng Dụng Của Phản Ứng Tỏa Nhiệt Trong Đời Sống Và Công Nghiệp
Phản ứng tỏa nhiệt đóng vai trò quan trọng trong nhiều lĩnh vực của đời sống và công nghiệp.
4.1. Sản Xuất Năng Lượng
Phản ứng đốt cháy được sử dụng rộng rãi để sản xuất năng lượng.
- Nhà máy điện: Than, dầu, và khí đốt được đốt cháy để tạo ra hơi nước, làm quay turbine và sản xuất điện.
- Động cơ đốt trong: Xăng và dầu diesel được đốt cháy trong động cơ để cung cấp năng lượng cho xe cộ và máy móc.
- Hệ thống sưởi ấm: Gas và dầu được đốt cháy để sưởi ấm nhà cửa và các tòa nhà.
4.2. Sản Xuất Vật Liệu
Nhiều vật liệu được sản xuất thông qua các phản ứng tỏa nhiệt.
- Sản xuất thép: Phản ứng giữa sắt oxit và carbon trong lò cao là một phản ứng tỏa nhiệt quan trọng trong sản xuất thép. Theo Tổng cục Thống kê, sản lượng thép thô của Việt Nam năm 2023 đạt 22 triệu tấn, phần lớn được sản xuất từ quy trình này.
- Sản xuất xi măng: Phản ứng giữa đá vôi và đất sét trong lò nung là một phản ứng tỏa nhiệt quan trọng trong sản xuất xi măng.
- Sản xuất phân bón: Phản ứng giữa ammonia và axit sulfuric là một phản ứng tỏa nhiệt quan trọng trong sản xuất phân bón.
4.3. Tổng Hợp Hóa Học
Nhiều hợp chất hóa học được tổng hợp thông qua các phản ứng tỏa nhiệt.
- Sản xuất sulfuric acid: Phản ứng oxy hóa sulfur dioxide là một phản ứng tỏa nhiệt quan trọng trong sản xuất sulfuric acid.
- Sản xuất ammonia: Phản ứng giữa nitrogen và hydrogen là một phản ứng tỏa nhiệt quan trọng trong sản xuất ammonia.
4.4. Các Ứng Dụng Khác
- Sưởi ấm: Túi sưởi hóa học sử dụng phản ứng tỏa nhiệt để tạo nhiệt.
- Hàn kim loại: Phản ứng nhiệt nhôm (thermite) được sử dụng để hàn đường ray và các cấu trúc kim loại lớn.
- Pháo hoa: Phản ứng đốt cháy các hợp chất hóa học tạo ra ánh sáng và âm thanh trong pháo hoa.
5. Yếu Tố Ảnh Hưởng Đến Tốc Độ Phản Ứng Tỏa Nhiệt
Tốc độ của phản ứng tỏa nhiệt không chỉ phụ thuộc vào các điều kiện cần thiết để phản ứng xảy ra, mà còn bị ảnh hưởng bởi nhiều yếu tố khác.
5.1. Bản Chất Của Các Chất Phản Ứng
- Tính chất hóa học: Các chất phản ứng có tính chất hóa học khác nhau sẽ có tốc độ phản ứng khác nhau. Ví dụ, các kim loại kiềm thường phản ứng mạnh mẽ hơn các kim loại chuyển tiếp.
- Cấu trúc phân tử: Cấu trúc phân tử phức tạp có thể làm chậm tốc độ phản ứng do cản trở sự va chạm giữa các phân tử.
5.2. Ánh Sáng
- Ảnh hưởng: Ánh sáng có thể cung cấp năng lượng hoạt hóa cho phản ứng, đặc biệt là các phản ứng quang hóa.
- Ví dụ: Phản ứng quang hợp ở cây xanh sử dụng ánh sáng mặt trời để chuyển đổi carbon dioxide và nước thành glucose và oxy.
5.3. Chất Ức Chế
- Khái niệm: Chất ức chế là chất làm chậm hoặc ngăn chặn phản ứng hóa học.
- Cơ chế: Chất ức chế có thể tác động bằng cách làm giảm nồng độ chất phản ứng, tăng năng lượng hoạt hóa, hoặc phá hủy chất xúc tác.
- Ví dụ: Các chất bảo quản thực phẩm thường là chất ức chế, giúp làm chậm quá trình oxy hóa và phân hủy của thực phẩm.
6. So Sánh Phản Ứng Tỏa Nhiệt và Phản Ứng Thu Nhiệt
Để hiểu rõ hơn về phản ứng tỏa nhiệt, chúng ta cùng so sánh nó với phản ứng thu nhiệt:
| Đặc Điểm | Phản Ứng Tỏa Nhiệt | Phản Ứng Thu Nhiệt |
|---|---|---|
| Năng lượng | Giải phóng năng lượng ra môi trường | Hấp thụ năng lượng từ môi trường |
| Enthalpy (ΔH) | ΔH < 0 (giá trị âm) | ΔH > 0 (giá trị dương) |
| Nhiệt độ môi trường | Tăng | Giảm |
| Tính tự phát | Thường tự phát | Không tự phát, cần cung cấp năng lượng |
| Ví dụ | Đốt cháy, trung hòa axit-bazơ | Quang hợp, nhiệt phân |
7. Các Biện Pháp An Toàn Khi Thực Hiện Phản Ứng Tỏa Nhiệt
Do tính chất giải phóng nhiệt mạnh mẽ, việc thực hiện phản ứng tỏa nhiệt cần tuân thủ các biện pháp an toàn nghiêm ngặt.
7.1. Kiểm Soát Nhiệt Độ
- Sử dụng hệ thống làm mát: Đảm bảo hệ thống làm mát hoạt động hiệu quả để ngăn chặn nhiệt độ tăng quá cao.
- Theo dõi nhiệt độ: Sử dụng nhiệt kế hoặc các thiết bị đo nhiệt độ để theo dõi liên tục nhiệt độ của phản ứng.
7.2. Sử Dụng Thiết Bị Bảo Hộ Cá Nhân
- Kính bảo hộ: Đeo kính bảo hộ để bảo vệ mắt khỏi hóa chất bắn vào.
- Găng tay: Sử dụng găng tay chống hóa chất để bảo vệ da tay.
- Áo choàng: Mặc áo choàng để bảo vệ cơ thể khỏi hóa chất văng bắn.
7.3. Thực Hiện Trong Môi Trường Thông Thoáng
- Đảm bảo thông gió: Thực hiện phản ứng trong môi trường thông thoáng hoặc sử dụng tủ hút để loại bỏ các khí độc hại.
7.4. Xử Lý Sự Cố
- Chuẩn bị sẵn sàng: Chuẩn bị sẵn sàng các biện pháp xử lý sự cố như bình chữa cháy, chất hấp thụ hóa chất, và bộ sơ cứu.
- Tuân thủ quy trình: Tuân thủ nghiêm ngặt các quy trình an toàn và hướng dẫn sử dụng hóa chất.
8. Các Nghiên Cứu Mới Về Phản Ứng Tỏa Nhiệt
Các nhà khoa học liên tục nghiên cứu để tìm ra các ứng dụng mới của phản ứng tỏa nhiệt và cải thiện hiệu quả của các quy trình hiện có.
- Nghiên cứu về vật liệu mới: Các vật liệu mới có khả năng chịu nhiệt cao và dẫn nhiệt tốt đang được phát triển để sử dụng trong các phản ứng tỏa nhiệt ở nhiệt độ cao.
- Nghiên cứu về chất xúc tác mới: Các chất xúc tác mới với hiệu quả cao hơn và chi phí thấp hơn đang được nghiên cứu để tăng tốc độ phản ứng và giảm năng lượng tiêu thụ.
- Nghiên cứu về các quy trình mới: Các quy trình mới sử dụng phản ứng tỏa nhiệt để sản xuất năng lượng sạch và xử lý chất thải đang được phát triển.
9. FAQ – Các Câu Hỏi Thường Gặp Về Phản Ứng Tỏa Nhiệt
-
Phản ứng tỏa nhiệt có luôn xảy ra tự phát không?
Không, phản ứng tỏa nhiệt không phải lúc nào cũng xảy ra tự phát. Mặc dù chúng có xu hướng tự xảy ra do giải phóng năng lượng (ΔH < 0), nhưng vẫn cần một lượng năng lượng hoạt hóa (Ea) ban đầu để “khởi động” phản ứng.
-
Tại sao phản ứng đốt cháy là phản ứng tỏa nhiệt?
Phản ứng đốt cháy là phản ứng giữa một chất và chất oxy hóa (thường là oxy), tạo ra nhiệt và ánh sáng. Quá trình này giải phóng năng lượng lớn hơn năng lượng cần thiết để phá vỡ các liên kết ban đầu, do đó nó là phản ứng tỏa nhiệt.
-
Làm thế nào để tăng tốc độ của phản ứng tỏa nhiệt?
Bạn có thể tăng tốc độ của phản ứng tỏa nhiệt bằng cách tăng nhiệt độ, tăng nồng độ chất phản ứng, sử dụng chất xúc tác, hoặc tăng diện tích bề mặt tiếp xúc (đối với phản ứng dị thể).
-
Phản ứng tỏa nhiệt có gây nguy hiểm không?
Có, phản ứng tỏa nhiệt có thể gây nguy hiểm nếu không được kiểm soát. Nhiệt lượng lớn có thể gây cháy nổ, bỏng, hoặc làm hỏng thiết bị.
-
Phản ứng trung hòa có phải luôn là phản ứng tỏa nhiệt không?
Có, phản ứng trung hòa giữa axit và bazơ luôn là phản ứng tỏa nhiệt.
-
Phản ứng hạt nhân là phản ứng tỏa nhiệt hay thu nhiệt?
Phần lớn các phản ứng hạt nhân là phản ứng tỏa nhiệt, giải phóng một lượng năng lượng khổng lồ.
-
Tại sao cần kiểm soát nhiệt độ trong phản ứng tỏa nhiệt?
Kiểm soát nhiệt độ giúp ngăn chặn nhiệt độ tăng quá cao, gây ra các phản ứng phụ không mong muốn, cháy nổ, hoặc làm hỏng thiết bị.
-
Chất xúc tác ảnh hưởng đến phản ứng tỏa nhiệt như thế nào?
Chất xúc tác làm giảm năng lượng hoạt hóa của phản ứng, giúp phản ứng xảy ra nhanh hơn mà không bị tiêu thụ trong quá trình phản ứng.
-
Phản ứng tỏa nhiệt có ứng dụng gì trong đời sống hàng ngày?
Phản ứng tỏa nhiệt được sử dụng trong nhiều ứng dụng hàng ngày như đốt cháy nhiên liệu để nấu ăn, sưởi ấm, và sản xuất điện; sử dụng túi sưởi hóa học để giữ ấm; và sử dụng pháo hoa trong các dịp lễ hội.
-
Làm thế nào để nhận biết một phản ứng là tỏa nhiệt?
Bạn có thể nhận biết một phản ứng là tỏa nhiệt bằng cách đo nhiệt độ của môi trường xung quanh. Nếu nhiệt độ tăng lên, phản ứng đó là tỏa nhiệt. Ngoài ra, bạn có thể dựa vào giá trị enthalpy (ΔH). Nếu ΔH < 0, phản ứng đó là tỏa nhiệt.
10. Xe Tải Mỹ Đình: Địa Chỉ Tin Cậy Cho Mọi Thông Tin Về Xe Tải
Bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về các loại xe tải, giá cả, địa điểm mua bán uy tín, và dịch vụ sửa chữa chất lượng tại khu vực Mỹ Đình? Xe Tải Mỹ Đình là lựa chọn hoàn hảo dành cho bạn.
Chúng tôi cung cấp:
- Thông tin chi tiết và cập nhật: Về các loại xe tải có sẵn ở Mỹ Đình, Hà Nội.
- So sánh giá cả và thông số kỹ thuật: Giúp bạn dễ dàng lựa chọn xe phù hợp với nhu cầu và ngân sách.
- Tư vấn chuyên nghiệp: Từ đội ngũ chuyên gia giàu kinh nghiệm, giúp bạn giải đáp mọi thắc mắc liên quan đến thủ tục mua bán, đăng ký và bảo dưỡng xe tải.
- Dịch vụ sửa chữa uy tín: Cung cấp thông tin về các dịch vụ sửa chữa xe tải uy tín trong khu vực.
Đừng ngần ngại liên hệ với Xe Tải Mỹ Đình ngay hôm nay để được tư vấn và giải đáp mọi thắc mắc!
- Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội
- Hotline: 0247 309 9988
- Trang web: XETAIMYDINH.EDU.VN
Xe Tải Mỹ Đình luôn sẵn sàng đồng hành cùng bạn trên mọi nẻo đường!