Công Thức Phân Tử Chung Của Anken là gì và nó có ý nghĩa như thế nào trong hóa học hữu cơ? Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN) sẽ cung cấp cho bạn cái nhìn sâu sắc về anken, từ định nghĩa cơ bản đến ứng dụng thực tế, giúp bạn hiểu rõ hơn về loại hợp chất này.
1. Định Nghĩa Anken Là Gì?
Anken là hydrocarbon không no, mạch hở, trong phân tử chứa một liên kết đôi C=C. Điều này có nghĩa là anken có ít nguyên tử hydro hơn so với ankan tương ứng có cùng số lượng nguyên tử carbon.
2. Công Thức Phân Tử Chung Của Anken Là Gì?
Công thức phân tử chung của anken là CₙH₂ₙ (với n ≥ 2). Trong đó, n là số nguyên tử carbon trong phân tử.
2.1. Giải Thích Công Thức CₙH₂ₙ
Công thức CₙH₂ₙ cho thấy rằng số lượng nguyên tử hydro trong một anken luôn gấp đôi số lượng nguyên tử carbon. Điều này xuất phát từ việc anken chứa một liên kết đôi giữa hai nguyên tử carbon, làm giảm số lượng hydro tối đa mà phân tử có thể chứa so với ankan (CₙH₂ₙ₊₂).
2.2. Ví Dụ Minh Họa
Dưới đây là một vài ví dụ về anken và công thức phân tử tương ứng:
| Tên Anken | Số Nguyên Tử Carbon (n) | Công Thức Phân Tử |
|---|---|---|
| Ethen (ethylene) | 2 | C₂H₄ |
| Propen (propylene) | 3 | C₃H₆ |
| Buten | 4 | C₄H₈ |
| Penten | 5 | C₅H₁₀ |
2.3. So Sánh Với Ankan và Ankin
Để hiểu rõ hơn về công thức phân tử của anken, hãy so sánh nó với ankan và ankin:
- Ankan: CₙH₂ₙ₊₂ (chỉ chứa liên kết đơn)
- Anken: CₙH₂ₙ (chứa một liên kết đôi)
- Ankin: CₙH₂ₙ₋₂ (chứa một liên kết ba)
Sự khác biệt trong công thức phân tử phản ánh số lượng liên kết không no (liên kết đôi hoặc ba) trong phân tử.
3. Đặc Điểm Cấu Tạo Của Anken
3.1. Liên Kết Đôi C=C
Liên kết đôi C=C là trung tâm phản ứng của anken. Nó bao gồm một liên kết sigma (σ) và một liên kết pi (π). Liên kết pi yếu hơn liên kết sigma, do đó dễ bị phá vỡ trong các phản ứng hóa học, làm cho anken hoạt động hơn so với ankan.
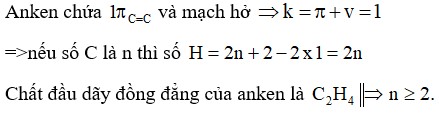 Liên kết đôi C=C trong Ethen (ethylene)
Liên kết đôi C=C trong Ethen (ethylene)
3.2. Cấu Trúc Phẳng
Sáu nguyên tử (hai carbon của liên kết đôi và bốn nguyên tử hoặc nhóm nguyên tử liên kết trực tiếp với chúng) nằm trên cùng một mặt phẳng. Góc liên kết xung quanh mỗi nguyên tử carbon của liên kết đôi khoảng 120°.
3.3. Đồng Phân Cấu Tạo và Đồng Phân Hình Học
- Đồng phân cấu tạo: Anken có thể có đồng phân cấu tạo khác nhau do vị trí của liên kết đôi hoặc do mạch carbon khác nhau. Ví dụ, buten (C₄H₈) có thể là but-1-en hoặc but-2-en.
- Đồng phân hình học (cis-trans): Nếu mỗi nguyên tử carbon của liên kết đôi liên kết với hai nhóm thế khác nhau, anken có thể tồn tại ở dạng đồng phân hình học cis và trans. Đồng phân cis có hai nhóm thế giống nhau nằm cùng một phía của liên kết đôi, trong khi đồng phân trans có hai nhóm thế giống nhau nằm ở hai phía đối diện của liên kết đôi.
4. Tính Chất Vật Lý Của Anken
4.1. Trạng Thái Tập Hợp
Ở điều kiện thường, các anken từ C₂H₄ đến C₄H₈ là chất khí, từ C₅H₁₀ trở lên là chất lỏng hoặc chất rắn.
4.2. Nhiệt Độ Sôi và Nhiệt Độ Nóng Chảy
Nhiệt độ sôi và nhiệt độ nóng chảy của anken tăng khi số lượng nguyên tử carbon trong phân tử tăng lên. Các anken có cấu trúc phân nhánh thường có nhiệt độ sôi thấp hơn so với các anken mạch thẳng tương ứng.
4.3. Độ Tan
Anken là các hydrocarbon, do đó chúng không tan trong nước nhưng tan tốt trong các dung môi hữu cơ.
5. Tính Chất Hóa Học Của Anken
Anken là các hợp chất hoạt động hóa học, tham gia vào nhiều phản ứng quan trọng, chủ yếu là các phản ứng cộng.
5.1. Phản Ứng Cộng
Phản ứng cộng là phản ứng đặc trưng của anken, trong đó các phân tử nhỏ cộng hợp vào liên kết đôi C=C.
-
Cộng Hydro (Hydro hóa):
Anken cộng với hydro (H₂) tạo thành ankan, thường cần xúc tác kim loại như niken (Ni), platin (Pt), hoặc palladium (Pd).
Ví dụ:
CH₂=CH₂ + H₂ → CH₃-CH₃ (xúc tác Ni, Pt hoặc Pd) -
Cộng Halogen (Halogen hóa):
Anken cộng với halogen (ví dụ: clo Cl₂, brom Br₂) tạo thành dẫn xuất halogen no. Phản ứng này thường được sử dụng để nhận biết anken vì nó làm mất màu dung dịch brom.
Ví dụ:
CH₂=CH₂ + Br₂ → CH₂Br-CH₂Br -
Cộng Hydro Halogen (Hydrohalogen hóa):
Anken cộng với hydro halogenua (ví dụ: HCl, HBr) tạo thành dẫn xuất halogen. Phản ứng tuân theo quy tắc Markovnikov: nguyên tử hydro ưu tiên cộng vào nguyên tử carbon của liên kết đôi có nhiều hydro hơn, còn nguyên tử halogen cộng vào nguyên tử carbon có ít hydro hơn.
Ví dụ:
CH₃-CH=CH₂ + HBr → CH₃-CHBr-CH₃ (sản phẩm chính) -
Cộng Nước (Hydrat hóa):
Anken cộng với nước (H₂O) tạo thành alcohol, thường cần xúc tác acid (ví dụ: H₂SO₄). Phản ứng cũng tuân theo quy tắc Markovnikov.
Ví dụ:
CH₂=CH₂ + H₂O → CH₃-CH₂OH (xúc tác H₂SO₄)
5.2. Phản Ứng Trùng Hợp
Nhiều phân tử anken có thể kết hợp với nhau tạo thành polymer mạch dài trong phản ứng trùng hợp. Quá trình này rất quan trọng trong công nghiệp sản xuất nhựa và các vật liệu polymer khác.
Ví dụ: Trùng hợp ethen tạo thành polyetylen (PE):
n CH₂=CH₂ → (-CH₂-CH₂-)ₙ5.3. Phản Ứng Oxi Hóa
-
Oxi hóa hoàn toàn (đốt cháy):
Anken cháy trong oxy tạo ra carbon dioxide (CO₂) và nước (H₂O), tỏa nhiệt.
Ví dụ:
CₙH₂ₙ + (3n/2) O₂ → n CO₂ + n H₂O -
Oxi hóa không hoàn toàn:
Anken có thể bị oxi hóa bởi các chất oxi hóa mạnh như KMnO₄, tạo ra các sản phẩm khác nhau tùy thuộc vào điều kiện phản ứng. Ví dụ, ethen có thể bị oxi hóa thành ethylene glycol (HOCH₂CH₂OH).
6. Điều Chế Anken
6.1. Cracking Ankan
Cracking là quá trình bẻ gãy các phân tử ankan mạch dài thành các phân tử nhỏ hơn, bao gồm anken và ankan. Quá trình này thường được thực hiện ở nhiệt độ cao và có xúc tác.
6.2. Dehydro hóa Ankan
Dehydro hóa là quá trình loại bỏ hydro từ ankan để tạo thành anken. Quá trình này cũng cần nhiệt độ cao và xúc tác.
6.3. Dehalogen hóa Dẫn Xuất Halogen
Dehalogen hóa là quá trình loại bỏ halogen từ dẫn xuất halogen no bằng cách sử dụng kim loại (ví dụ: Zn) hoặc dung dịch kiềm.
6.4. Tách Nước Từ Alcohol (Dehydration)
Alcohol có thể bị tách nước để tạo thành anken, thường cần xúc tác acid (ví dụ: H₂SO₄) và nhiệt độ cao.
7. Ứng Dụng Của Anken
Anken có nhiều ứng dụng quan trọng trong công nghiệp và đời sống.
7.1. Sản Xuất Polymer
Ethen (ethylene) và propen (propylene) là nguyên liệu chính để sản xuất các polymer như polyetylen (PE), polypropylen (PP), polyvinyl clorua (PVC), và polystyren (PS). Các polymer này được sử dụng rộng rãi trong sản xuất đồ gia dụng, vật liệu xây dựng, bao bì, và nhiều ứng dụng khác.
7.2. Sản Xuất Hóa Chất
Anken là nguyên liệu để sản xuất nhiều hóa chất quan trọng như alcohol, aldehyde, acid carboxylic, và các hợp chất hữu cơ khác.
7.3. Ứng Dụng Trong Nông Nghiệp
Ethen (ethylene) được sử dụng để kích thích quá trình chín của trái cây và rau quả.
7.4. Ứng Dụng Trong Y Học
Một số anken được sử dụng trong sản xuất dược phẩm và các sản phẩm y tế.
8. Ảnh Hưởng Của Anken Đến Môi Trường
Mặc dù anken có nhiều ứng dụng quan trọng, việc sản xuất và sử dụng chúng cũng có thể gây ra các vấn đề môi trường.
8.1. Khí Thải
Quá trình sản xuất anken có thể tạo ra khí thải gây ô nhiễm không khí, bao gồm các hydrocarbon không cháy hết và các chất ô nhiễm khác.
8.2. Rác Thải Nhựa
Việc sử dụng rộng rãi các polymer được sản xuất từ anken dẫn đến lượng rác thải nhựa ngày càng tăng, gây ô nhiễm môi trường đất và nước.
8.3. Giải Pháp
Để giảm thiểu tác động tiêu cực đến môi trường, cần phát triển các quy trình sản xuất sạch hơn, tăng cường tái chế và sử dụng các vật liệu thân thiện với môi trường hơn.
9. Các Loại Anken Thường Gặp
9.1. Ethen (Ethylene) – C₂H₄
- Tính chất: Chất khí không màu, có mùi nhẹ.
- Ứng dụng: Sản xuất polyetylen (PE), ethylene oxide, ethylene glycol, và nhiều hóa chất khác.
9.2. Propen (Propylene) – C₃H₆
- Tính chất: Chất khí không màu.
- Ứng dụng: Sản xuất polypropylen (PP), acrylonitrile, và nhiều hóa chất khác.
9.3. Buten – C₄H₈
- Tính chất: Chất khí không màu.
- Ứng dụng: Sản xuất butadien (sản xuất cao su tổng hợp), isobuten (sản xuất xăng).
10. Tổng Kết
Công thức phân tử chung của anken là CₙH₂ₙ, phản ánh đặc điểm cấu trúc chứa một liên kết đôi C=C. Anken là các hợp chất quan trọng trong hóa học hữu cơ và có nhiều ứng dụng trong công nghiệp, nông nghiệp, và y học. Tuy nhiên, việc sản xuất và sử dụng anken cũng cần được quản lý để giảm thiểu tác động tiêu cực đến môi trường.
FAQ Về Công Thức Phân Tử Chung Của Anken
1. Tại sao anken lại có công thức CₙH₂ₙ?
Anken có công thức CₙH₂ₙ vì chúng chứa một liên kết đôi C=C, làm giảm số lượng hydro tối đa mà phân tử có thể chứa so với ankan (CₙH₂ₙ₊₂).
2. Anken có những loại đồng phân nào?
Anken có thể có đồng phân cấu tạo (do vị trí liên kết đôi hoặc mạch carbon khác nhau) và đồng phân hình học (cis-trans).
3. Phản ứng đặc trưng của anken là gì?
Phản ứng đặc trưng của anken là phản ứng cộng, trong đó các phân tử nhỏ cộng hợp vào liên kết đôi C=C.
4. Anken được điều chế bằng những phương pháp nào?
Anken có thể được điều chế bằng cracking ankan, dehydro hóa ankan, dehalogen hóa dẫn xuất halogen, và tách nước từ alcohol.
5. Ethen (ethylene) có những ứng dụng gì quan trọng?
Ethen được sử dụng để sản xuất polyetylen (PE), ethylene oxide, ethylene glycol, và nhiều hóa chất khác.
6. Propen (propylene) có những ứng dụng gì quan trọng?
Propen được sử dụng để sản xuất polypropylen (PP), acrylonitrile, và nhiều hóa chất khác.
7. Anken có gây ô nhiễm môi trường không?
Việc sản xuất và sử dụng anken có thể gây ô nhiễm không khí và tạo ra rác thải nhựa, gây ô nhiễm môi trường đất và nước.
8. Làm thế nào để giảm thiểu tác động tiêu cực của anken đến môi trường?
Để giảm thiểu tác động tiêu cực, cần phát triển các quy trình sản xuất sạch hơn, tăng cường tái chế và sử dụng các vật liệu thân thiện với môi trường hơn.
9. Quy tắc Markovnikov là gì và nó áp dụng cho phản ứng nào của anken?
Quy tắc Markovnikov nói rằng trong phản ứng cộng hydro halogenua hoặc nước vào anken, nguyên tử hydro ưu tiên cộng vào nguyên tử carbon của liên kết đôi có nhiều hydro hơn, còn nguyên tử halogen hoặc nhóm hydroxyl cộng vào nguyên tử carbon có ít hydro hơn.
10. Liên kết pi (π) trong anken có vai trò gì?
Liên kết pi (π) yếu hơn liên kết sigma (σ), do đó dễ bị phá vỡ trong các phản ứng hóa học, làm cho anken hoạt động hơn so với ankan.
Bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải ở Mỹ Đình? Hãy truy cập XETAIMYDINH.EDU.VN ngay hôm nay để được tư vấn và giải đáp mọi thắc mắc! Chúng tôi cam kết cung cấp những thông tin mới nhất và chính xác nhất để giúp bạn đưa ra quyết định tốt nhất.
Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội
Hotline: 0247 309 9988
Trang web: XETAIMYDINH.EDU.VN