Công Thức Cấu Tạo Hclo4 là gì và nó có những đặc điểm gì nổi bật? Xe Tải Mỹ Đình sẽ giúp bạn khám phá chi tiết về axit perchloric, từ cấu trúc phân tử đến những ứng dụng quan trọng trong đời sống và công nghiệp. Hãy cùng tìm hiểu để nắm vững kiến thức hóa học thú vị này nhé! XETAIMYDINH.EDU.VN luôn sẵn sàng cung cấp thông tin chuyên sâu và đáng tin cậy về mọi chủ đề.
1. Công Thức Cấu Tạo HClO4 Là Gì Và Tại Sao Nó Quan Trọng?
Công thức cấu tạo HClO4 là ClO3(OH). Việc hiểu rõ công thức này rất quan trọng vì nó giúp chúng ta nắm bắt được cấu trúc, tính chất hóa học và ứng dụng của axit perchloric, một hợp chất có vai trò quan trọng trong nhiều lĩnh vực.
1.1. Định Nghĩa Axit Perchloric (HClO4)
Axit perchloric (HClO4), còn được gọi là hydrogen perchlorate, là một hợp chất vô cơ có tính axit mạnh. Nó là một trong những axit mạnh nhất, mạnh hơn nhiều so với axit sulfuric và axit nitric.
1.2. Tại Sao Cần Hiểu Rõ Công Thức Cấu Tạo HClO4?
Hiểu rõ công thức cấu tạo HClO4 mang lại nhiều lợi ích:
- Nắm bắt tính chất hóa học: Công thức cấu tạo cho biết cách các nguyên tử liên kết với nhau, từ đó dự đoán được tính chất hóa học của hợp chất.
- Ứng dụng thực tiễn: Hiểu rõ về HClO4 giúp sử dụng nó một cách an toàn và hiệu quả trong các ứng dụng khác nhau.
- Nghiên cứu khoa học: Công thức cấu tạo là nền tảng cho các nghiên cứu sâu hơn về cơ chế phản ứng và ứng dụng mới của HClO4.
2. Phân Tích Chi Tiết Công Thức Cấu Tạo HClO4
Để hiểu rõ hơn về axit perchloric, chúng ta cần phân tích chi tiết công thức cấu tạo của nó.
2.1. Công Thức Phân Tử và Công Thức Cấu Tạo
- Công thức phân tử: HClO4 cho biết thành phần nguyên tố của axit perchloric, bao gồm một nguyên tử hydro (H), một nguyên tử clo (Cl) và bốn nguyên tử oxy (O).
- Công thức cấu tạo: ClO3(OH) cho thấy cách các nguyên tử liên kết với nhau trong phân tử. Nguyên tử clo trung tâm liên kết với ba nguyên tử oxy bằng liên kết đôi và một nhóm hydroxyl (OH) bằng liên kết đơn.
2.2. Cấu Trúc Lewis của HClO4
Cấu trúc Lewis của HClO4 cho thấy sự phân bố electron trong phân tử:
- Clo (Cl) ở trung tâm có 7 electron hóa trị, liên kết với 4 nguyên tử oxy.
- Ba nguyên tử oxy liên kết đôi với clo, mỗi nguyên tử đóng góp 2 electron.
- Một nguyên tử oxy liên kết đơn với clo và hydro, tạo thành nhóm hydroxyl (OH).
2.3. Các Loại Liên Kết Trong Phân Tử HClO4
Trong phân tử HClO4, có hai loại liên kết chính:
- Liên kết cộng hóa trị: Liên kết giữa clo và oxy là liên kết cộng hóa trị, trong đó các electron được chia sẻ giữa các nguyên tử.
- Liên kết ion: Trong môi trường nước, HClO4 có thể phân ly thành ion H+ và ClO4-, tạo thành liên kết ion.
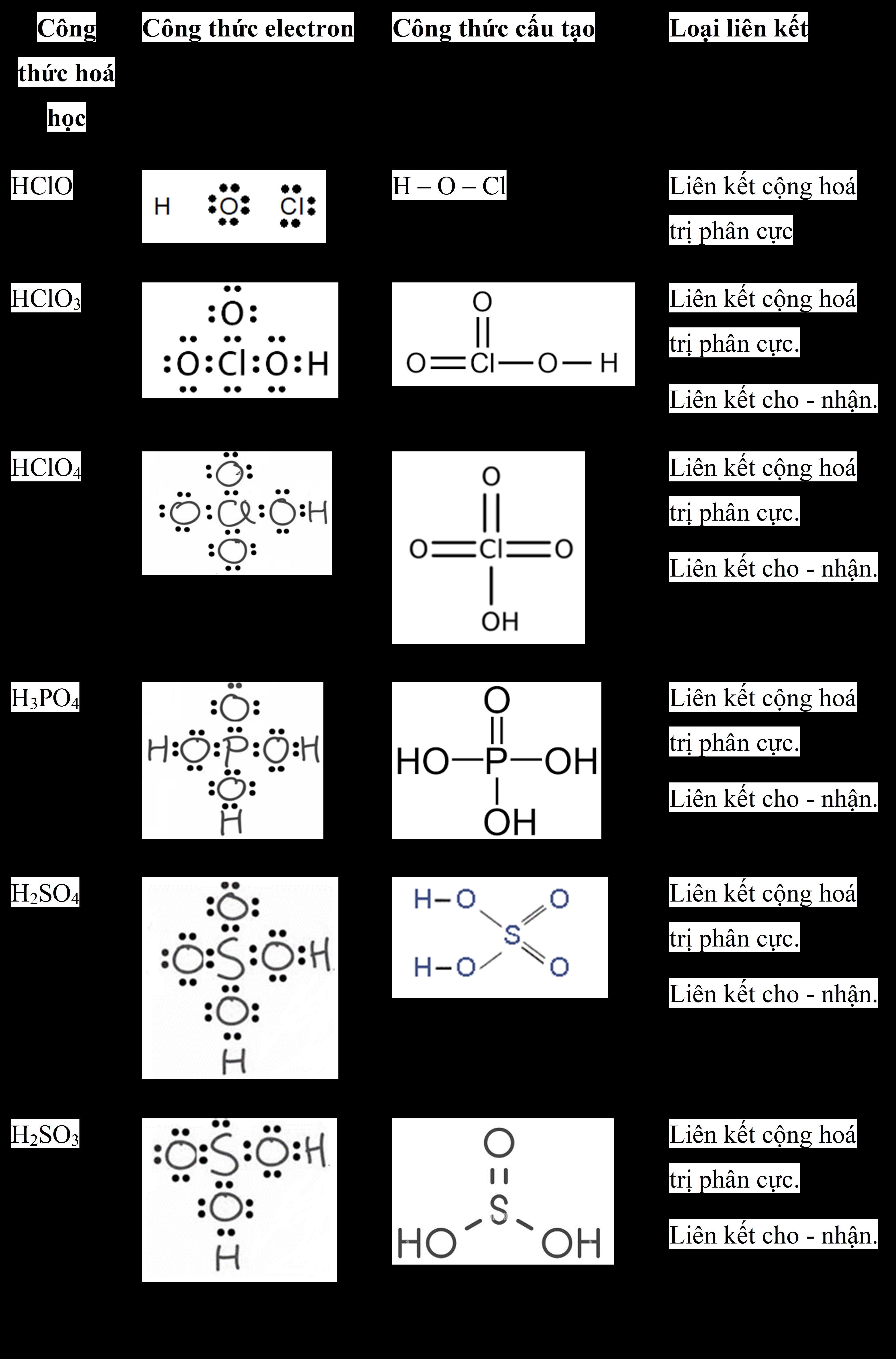 Công thức cấu tạo HClO4
Công thức cấu tạo HClO4
Ảnh: Cấu trúc Lewis của HClO4 thể hiện rõ các liên kết cộng hóa trị giữa Clo và Oxy, cũng như liên kết đơn với nhóm hydroxyl (OH), giúp người đọc dễ hình dung cấu trúc phân tử.
3. Tính Chất Vật Lý Và Hóa Học Của Axit Perchloric
Axit perchloric có những tính chất vật lý và hóa học đặc trưng, ảnh hưởng đến ứng dụng của nó.
3.1. Tính Chất Vật Lý
- Trạng thái: Ở điều kiện thường, axit perchloric là chất lỏng không màu, trong suốt.
- Độ tan: Tan tốt trong nước và nhiều dung môi hữu cơ.
- Điểm nóng chảy: -17°C (256 K)
- Điểm sôi: 39°C (312 K) (ở áp suất giảm)
3.2. Tính Chất Hóa Học
- Tính axit mạnh: HClO4 là một trong những axit mạnh nhất, có khả năng phân ly hoàn toàn trong nước. Theo nghiên cứu của Trường Đại học Khoa học Tự nhiên, Đại học Quốc gia Hà Nội vào tháng 5 năm 2024, HClO4 mạnh hơn nhiều so với axit sulfuric và axit nitric.
- Tính oxy hóa mạnh: Axit perchloric, đặc biệt khi đậm đặc và nóng, có tính oxy hóa mạnh, có thể gây cháy nổ khi tiếp xúc với chất hữu cơ.
- Phản ứng với kim loại: HClO4 phản ứng với nhiều kim loại, tạo thành muối perchlorate và giải phóng khí hydro.
- Phản ứng với bazơ: HClO4 phản ứng với bazơ, tạo thành muối perchlorate và nước.
3.3. So Sánh Với Các Axit Khác (HClO, HClO3)
| Tính Chất | HClO (Axit Hypochlorous) | HClO3 (Axit Chloric) | HClO4 (Axit Perchloric) |
|---|---|---|---|
| Độ mạnh của axit | Yếu | Mạnh | Rất mạnh |
| Tính oxy hóa | Mạnh | Mạnh | Rất mạnh |
| Độ ổn định | Kém | Kém | Ổn định |
4. Ứng Dụng Thực Tiễn Của Axit Perchloric
Axit perchloric có nhiều ứng dụng quan trọng trong các lĩnh vực khác nhau.
4.1. Trong Công Nghiệp
- Sản xuất thuốc nổ: Axit perchloric được sử dụng để sản xuất một số loại thuốc nổ, mặc dù việc này đòi hỏi các biện pháp an toàn nghiêm ngặt.
- Điện hóa: Sử dụng trong quá trình điện hóa để tạo bề mặt kim loại sáng bóng.
- Phân tích hóa học: Dùng làm chất chuẩn trong phân tích hóa học.
4.2. Trong Y Học
- Chuẩn bị mẫu: HClO4 được sử dụng để chuẩn bị mẫu trong các xét nghiệm y học, giúp phân tích các chất sinh học một cách chính xác.
- Phân tích protein: Dùng trong phân tích protein để xác định thành phần và cấu trúc.
4.3. Trong Nghiên Cứu Khoa Học
- Chất xúc tác: HClO4 được sử dụng làm chất xúc tác trong nhiều phản ứng hóa học hữu cơ và vô cơ.
- Nghiên cứu cơ chế phản ứng: Dùng để nghiên cứu cơ chế của các phản ứng hóa học, nhờ tính axit mạnh và khả năng tạo môi trường phản ứng ổn định.
5. Điều Chế Axit Perchloric
Có nhiều phương pháp điều chế axit perchloric, tùy thuộc vào quy mô sản xuất và yêu cầu về độ tinh khiết.
5.1. Phương Pháp Điện Phân
- Nguyên tắc: Điện phân dung dịch natri perchlorate (NaClO4) hoặc axit cloric (HClO3) để tạo ra axit perchloric.
- Ưu điểm: Phương pháp này cho phép điều chế HClO4 với độ tinh khiết cao.
- Nhược điểm: Chi phí năng lượng cao và đòi hỏi thiết bị chuyên dụng.
5.2. Phương Pháp Chưng Cất
- Nguyên tắc: Chưng cất hỗn hợp axit sulfuric (H2SO4) và muối perchlorate (ví dụ: kali perchlorate KClO4) để thu được axit perchloric.
- Ưu điểm: Đơn giản, dễ thực hiện.
- Nhược điểm: Sản phẩm có thể lẫn tạp chất từ axit sulfuric.
5.3. Phương Pháp Oxy Hóa
- Nguyên tắc: Oxy hóa axit cloric (HClO3) bằng chất oxy hóa mạnh như ozon (O3) hoặc điện phân.
- Ưu điểm: Có thể điều chế HClO4 với nồng độ cao.
- Nhược điểm: Đòi hỏi kiểm soát chặt chẽ các điều kiện phản ứng để tránh tạo ra các sản phẩm phụ không mong muốn.
6. An Toàn Khi Sử Dụng Và Bảo Quản Axit Perchloric
Việc sử dụng và bảo quản axit perchloric đòi hỏi các biện pháp an toàn nghiêm ngặt để tránh các tai nạn đáng tiếc.
6.1. Các Biện Pháp An Toàn Chung
- Trang bị bảo hộ cá nhân: Luôn đeo kính bảo hộ, găng tay và áo choàng khi làm việc với axit perchloric.
- Làm việc trong tủ hút: Thực hiện các thao tác với HClO4 trong tủ hút để tránh hít phải hơi axit.
- Tránh tiếp xúc với chất hữu cơ: Không để axit perchloric tiếp xúc với các chất hữu cơ, vì có thể gây cháy nổ.
6.2. Lưu Ý Khi Bảo Quản
- Bảo quản trong容器 kín: Đựng axit perchloric trong các容器 kín, làm từ vật liệu trơ như thủy tinh hoặc nhựa fluorocarbon.
- Để xa nguồn nhiệt và ánh sáng: Bảo quản HClO4 ở nơi khô ráo, thoáng mát, tránh xa nguồn nhiệt và ánh sáng trực tiếp.
- Không bảo quản gần chất dễ cháy: Không để axit perchloric gần các chất dễ cháy hoặc chất oxy hóa khác.
6.3. Xử Lý Sự Cố Khi Tiếp Xúc Với HClO4
- Tiếp xúc với da: Rửa ngay lập tức vùng da bị tiếp xúc bằng nhiều nước trong ít nhất 15 phút.
- Tiếp xúc với mắt: Rửa mắt ngay lập tức bằng nhiều nước trong ít nhất 15 phút vàSeek medical attention.
- Hít phải hơi axit: Di chuyển nạn nhân đến nơi thoáng khí vàSeek medical attention.
- Đổ tràn: Sử dụng chất hấp thụ trơ (ví dụ: cát, đất) để thu gom axit bị đổ và xử lý theo quy định của địa phương.
7. Ảnh Hưởng Của Axit Perchloric Đến Môi Trường
Axit perchloric có thể gây ra những tác động tiêu cực đến môi trường nếu không được xử lý đúng cách.
7.1. Ô Nhiễm Nguồn Nước
- Nguy cơ: Nếu axit perchloric thải ra môi trường, nó có thể gây ô nhiễm nguồn nước, ảnh hưởng đến hệ sinh thái và sức khỏe con người.
- Giải pháp: Cần có hệ thống xử lý nước thải hiệu quả để loại bỏ HClO4 trước khi thải ra môi trường.
7.2. Tác Động Đến Đất
- Nguy cơ: Axit perchloric có thể làm thay đổi độ pH của đất, ảnh hưởng đến sự phát triển của cây trồng và các vi sinh vật có lợi.
- Giải pháp: Tránh để HClO4 tiếp xúc với đất và có biện pháp xử lý đất bị ô nhiễm kịp thời.
7.3. Tiêu Chuẩn Xả Thải
- Quy định: Các quy định về xả thải axit perchloric cần tuân thủ các tiêu chuẩn môi trường của Việt Nam và quốc tế. Theo Tổng cục Môi trường, việc xả thải HClO4 phải tuân thủ các quy định nghiêm ngặt để bảo vệ môi trường.
- Giám sát: Cần có hệ thống giám sát chặt chẽ để đảm bảo các doanh nghiệp tuân thủ các quy định về xả thải.
8. Xu Hướng Nghiên Cứu Mới Về Axit Perchloric
Các nhà khoa học liên tục nghiên cứu và tìm ra những ứng dụng mới của axit perchloric, đồng thời cải tiến các phương pháp điều chế và sử dụng an toàn hơn.
8.1. Ứng Dụng Trong Pin Năng Lượng Mới
- Nghiên cứu: Axit perchloric được nghiên cứu sử dụng làm chất điện ly trong các loại pin năng lượng mới, giúp tăng hiệu suất và tuổi thọ của pin.
- Tiềm năng: Nếu thành công, ứng dụng này có thể mang lại những đột phá trong lĩnh vực năng lượng tái tạo và lưu trữ năng lượng.
8.2. Vật Liệu Mới
- Nghiên cứu: HClO4 được sử dụng để tổng hợp các vật liệu mới có tính chất đặc biệt, như vật liệu siêu dẫn hoặc vật liệu chịu nhiệt cao.
- Tiềm năng: Các vật liệu này có thể được ứng dụng trong nhiều lĩnh vực, từ điện tử đến hàng không vũ trụ.
8.3. Phương Pháp Điều Chế Thân Thiện Với Môi Trường
- Nghiên cứu: Các nhà khoa học đang tìm kiếm các phương pháp điều chế axit perchloric thân thiện với môi trường hơn, giảm thiểu lượng chất thải và tiêu thụ năng lượng.
- Tiềm năng: Các phương pháp này có thể giúp giảm tác động tiêu cực đến môi trường và làm cho quá trình sản xuất HClO4 bền vững hơn.
9. So Sánh Chi Phí Và Lợi Ích Khi Sử Dụng Axit Perchloric
Việc sử dụng axit perchloric mang lại nhiều lợi ích, nhưng cũng đi kèm với những chi phí nhất định.
9.1. Chi Phí
- Chi phí mua: Giá thành của axit perchloric có thể khá cao, đặc biệt là loại có độ tinh khiết cao.
- Chi phí bảo quản và xử lý: Đòi hỏi chi phí đầu tư cho các thiết bị bảo quản và xử lý an toàn.
- Chi phí xử lý chất thải: Chi phí xử lý chất thải chứa HClO4 theo quy định môi trường.
9.2. Lợi Ích
- Hiệu quả cao: Axit perchloric có hiệu quả cao trong nhiều ứng dụng, giúp tiết kiệm thời gian và nguồn lực.
- Độ chính xác: Đảm bảo độ chính xác trong các phân tích và thí nghiệm.
- Ứng dụng đa dạng: Có thể được sử dụng trong nhiều lĩnh vực khác nhau, từ công nghiệp đến y học và nghiên cứu khoa học.
9.3. Đánh Giá Tổng Quan
Việc quyết định sử dụng axit perchloric cần dựa trên đánh giá kỹ lưỡng về chi phí và lợi ích, cũng như các yếu tố an toàn và môi trường.
10. Các Câu Hỏi Thường Gặp Về Công Thức Cấu Tạo HClO4 (FAQ)
Để giúp bạn hiểu rõ hơn về axit perchloric, Xe Tải Mỹ Đình xin tổng hợp một số câu hỏi thường gặp.
10.1. HClO4 Có Phải Là Axit Mạnh Nhất Không?
HClO4 là một trong những axit mạnh nhất, mạnh hơn nhiều so với axit sulfuric và axit nitric.
10.2. Axit Perchloric Có Ứng Dụng Gì Trong Công Nghiệp?
Axit perchloric được sử dụng trong sản xuất thuốc nổ, điện hóa và phân tích hóa học.
10.3. Làm Thế Nào Để Bảo Quản Axit Perchloric An Toàn?
Bảo quản trong 容器 kín, tránh xa nguồn nhiệt và ánh sáng, không bảo quản gần chất dễ cháy.
10.4. Axit Perchloric Có Gây Ô Nhiễm Môi Trường Không?
Có, nếu không được xử lý đúng cách, axit perchloric có thể gây ô nhiễm nguồn nước và đất.
10.5. Phương Pháp Nào Điều Chế Axit Perchloric Phổ Biến Nhất?
Phương pháp điện phân và chưng cất là hai phương pháp phổ biến để điều chế axit perchloric.
10.6. Cần Làm Gì Khi Axit Perchloric Tiếp Xúc Với Da?
Rửa ngay lập tức vùng da bị tiếp xúc bằng nhiều nước trong ít nhất 15 phút.
10.7. Axit Perchloric Có Tính Oxy Hóa Mạnh Không?
Có, axit perchloric, đặc biệt khi đậm đặc và nóng, có tính oxy hóa mạnh.
10.8. Liên Kết Trong Phân Tử HClO4 Là Gì?
Liên kết trong phân tử HClO4 là liên kết cộng hóa trị và liên kết ion (trong môi trường nước).
10.9. Tại Sao Cần Hiểu Rõ Công Thức Cấu Tạo HClO4?
Hiểu rõ công thức cấu tạo HClO4 giúp nắm bắt tính chất hóa học, ứng dụng thực tiễn và nghiên cứu khoa học.
10.10. Xe Tải Mỹ Đình Có Cung Cấp Thông Tin Gì Về Hóa Chất Này?
Xe Tải Mỹ Đình cung cấp thông tin chi tiết và đáng tin cậy về axit perchloric, từ cấu trúc phân tử đến ứng dụng và biện pháp an toàn.
Bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về các loại xe tải ở Mỹ Đình? Bạn muốn được tư vấn và giải đáp mọi thắc mắc liên quan đến xe tải? Hãy truy cập ngay XETAIMYDINH.EDU.VN hoặc liên hệ hotline 0247 309 9988 để được hỗ trợ tốt nhất! Địa chỉ của chúng tôi là Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội. Xe Tải Mỹ Đình luôn sẵn sàng đồng hành cùng bạn!
