Công Thức Cấu Tạo Của Nitơ là gì và nó ảnh hưởng đến tính chất của khí nitơ ra sao? Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN) sẽ giúp bạn khám phá chi tiết về cấu trúc độc đáo của N2, từ đó hiểu rõ hơn về vai trò quan trọng của nó trong nhiều lĩnh vực. Hãy cùng tìm hiểu sâu hơn về cấu trúc phân tử, liên kết hóa học và những ứng dụng thú vị của nitơ.
1. Công Thức Cấu Tạo Nitơ (N2) Là Gì?
Công thức cấu tạo của nitơ (N2) mô tả cách hai nguyên tử nitơ liên kết với nhau để tạo thành một phân tử nitơ ổn định. Phân tử nitơ (N2) có liên kết ba, bao gồm một liên kết sigma (σ) và hai liên kết pi (π), giữa hai nguyên tử nitơ.
1.1. Giải Thích Chi Tiết Công Thức Cấu Tạo Của N2
Để hiểu rõ hơn về công thức cấu tạo của N2, chúng ta cần xem xét cấu hình electron của nguyên tử nitơ và cách chúng liên kết với nhau.
- Cấu hình electron của nitơ: Nguyên tử nitơ có số hiệu nguyên tử là 7, nghĩa là nó có 7 proton và 7 electron. Cấu hình electron của nitơ là 1s² 2s² 2p³. Lớp ngoài cùng (lớp thứ hai) có 5 electron, trong đó có 3 electron độc thân ở orbital 2p.
- Liên kết ba trong N2: Để đạt được cấu hình electron bền vững, mỗi nguyên tử nitơ cần thêm 3 electron. Do đó, hai nguyên tử nitơ liên kết với nhau bằng cách chia sẻ 3 cặp electron, tạo thành liên kết ba. Liên kết ba này bao gồm một liên kết sigma (σ) hình thành do sự xen phủ trục của các orbital và hai liên kết pi (π) hình thành do sự xen phủ bên của các orbital p.
- Công thức Lewis của N2: Công thức Lewis của N2 biểu diễn sự liên kết giữa hai nguyên tử nitơ bằng ba gạch ngang, mỗi gạch biểu thị một cặp electron dùng chung. Công thức này cho thấy mỗi nguyên tử nitơ đều có một cặp electron không liên kết (electron tự do).
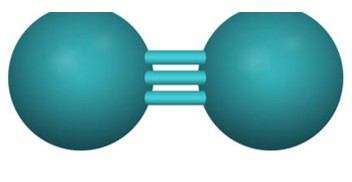 Công thức Lewis của N2
Công thức Lewis của N2
1.2. Đặc Điểm Của Liên Kết Ba Trong Phân Tử N2
Liên kết ba trong phân tử N2 có những đặc điểm quan trọng sau:
- Độ bền cao: Liên kết ba rất mạnh, đòi hỏi một lượng lớn năng lượng để phá vỡ. Điều này giải thích tại sao nitơ phân tử lại trơ về mặt hóa học ở điều kiện thường. Theo nghiên cứu của Đại học Khoa học Tự nhiên, ĐHQG Hà Nội năm 2022, năng lượng liên kết của N2 là 945 kJ/mol, cao hơn nhiều so với liên kết đơn hoặc liên kết đôi.
- Chiều dài liên kết ngắn: Liên kết ba làm cho khoảng cách giữa hai nguyên tử nitơ rất ngắn, chỉ khoảng 109,76 pm. Điều này cũng góp phần vào độ bền của liên kết.
- Tính không phân cực: Vì hai nguyên tử nitơ giống hệt nhau, liên kết giữa chúng là liên kết cộng hóa trị không phân cực. Điều này có nghĩa là các electron được chia sẻ đều giữa hai nguyên tử, và không có sự tích điện dương hoặc âm trên bất kỳ nguyên tử nào.
2. Ý Nghĩa Của Công Thức Cấu Tạo N2 Đối Với Tính Chất Của Nitơ
Công thức cấu tạo của N2 có ảnh hưởng trực tiếp đến tính chất vật lý và hóa học của nitơ.
2.1. Tính Chất Vật Lý
- Trạng thái khí: Ở điều kiện thường, nitơ tồn tại ở trạng thái khí. Điều này là do liên kết giữa các phân tử N2 rất yếu (lực Van der Waals), không đủ mạnh để giữ chúng ở trạng thái lỏng hoặc rắn.
- Không màu, không mùi, không vị: Nitơ là một chất khí không màu, không mùi và không vị. Điều này làm cho nó khó phát hiện bằng các giác quan thông thường.
- Khó hóa lỏng và hóa rắn: Do liên kết ba rất bền, cần phải làm lạnh nitơ đến nhiệt độ rất thấp (-196°C) để hóa lỏng và thấp hơn nữa (-210°C) để hóa rắn.
- Ít tan trong nước: Nitơ ít tan trong nước do tính không phân cực của phân tử N2.
2.2. Tính Chất Hóa Học
- Tính trơ: Nitơ phân tử (N2) rất trơ ở điều kiện thường. Điều này là do liên kết ba rất bền, cần một lượng lớn năng lượng để phá vỡ.
- Phản ứng ở nhiệt độ cao hoặc có xúc tác: Ở nhiệt độ cao hoặc có xúc tác, nitơ có thể tham gia phản ứng với một số chất khác. Ví dụ, nitơ phản ứng với hydro để tạo thành amoniac (NH3) trong quá trình Haber-Bosch, một quy trình quan trọng trong sản xuất phân bón.
- Phản ứng với kim loại mạnh: Ở nhiệt độ cao, nitơ có thể phản ứng với một số kim loại mạnh như lithium (Li) hoặc magnesium (Mg) để tạo thành nitride.
- Oxy hóa ở điều kiện đặc biệt: Trong điều kiện phóng điện hoặc ở nhiệt độ rất cao, nitơ có thể phản ứng với oxy để tạo thành các oxit của nitơ, như NO hoặc NO2.
3. Ứng Dụng Thực Tế Của Nitơ Dựa Trên Công Thức Cấu Tạo
Tính chất hóa học và vật lý của nitơ, bắt nguồn từ công thức cấu tạo đặc biệt, đã tạo ra nhiều ứng dụng quan trọng trong các lĩnh vực khác nhau.
3.1. Trong Công Nghiệp
- Sản xuất amoniac (NH3): Đây là ứng dụng quan trọng nhất của nitơ. Amoniac được sử dụng để sản xuất phân bón, axit nitric, và nhiều hóa chất khác. Theo số liệu của Bộ Công Thương năm 2023, ngành sản xuất phân bón chiếm khoảng 80% lượng nitơ tiêu thụ trên toàn cầu.
- Sản xuất thép: Nitơ được sử dụng để tạo ra môi trường trơ trong quá trình sản xuất thép, ngăn chặn quá trình oxy hóa và cải thiện chất lượng sản phẩm.
- Bảo quản thực phẩm: Nitơ lỏng được sử dụng để làm lạnh và bảo quản thực phẩm, giúp kéo dài thời gian sử dụng và duy trì chất lượng.
- Sản xuất linh kiện điện tử: Nitơ được sử dụng để tạo ra môi trường trơ trong quá trình sản xuất các linh kiện điện tử, ngăn chặn sự oxy hóa và đảm bảo độ tinh khiết của sản phẩm.
3.2. Trong Y Học
- Bảo quản mẫu sinh học: Nitơ lỏng được sử dụng để bảo quản các mẫu sinh học như tế bào, mô, và cơ quan ở nhiệt độ cực thấp, giúp duy trì tính toàn vẹn của chúng trong thời gian dài.
- Phẫu thuật lạnh: Nitơ lỏng được sử dụng trong phẫu thuật lạnh để phá hủy các mô bệnh, như mụn cóc hoặc khối u, bằng cách đóng băng chúng.
- Điều trị da: Nitơ lỏng được sử dụng để điều trị một số bệnh da như viêm da hoặc chàm.
3.3. Trong Nông Nghiệp
- Phân bón: Nitơ là một trong những nguyên tố dinh dưỡng quan trọng nhất cho cây trồng. Các loại phân bón chứa nitơ giúp tăng năng suất và chất lượng cây trồng.
- Bảo quản hạt giống: Nitơ được sử dụng để bảo quản hạt giống, giúp kéo dài thời gian nảy mầm và đảm bảo nguồn cung cấp hạt giống cho mùa vụ sau.
3.4. Trong Giao Thông Vận Tải
- Bơm lốp xe: Thay vì sử dụng khí nén thông thường, nhiều người chọn bơm lốp xe bằng nitơ. Nitơ giúp duy trì áp suất lốp ổn định hơn, giảm nguy cơ nổ lốp và tăng tuổi thọ của lốp.
- Hệ thống làm mát: Nitơ lỏng được sử dụng trong các hệ thống làm mát của một số loại xe đặc biệt, như xe đua, để tăng hiệu suất động cơ.
4. So Sánh Công Thức Cấu Tạo Của Nitơ Với Các Phân Tử Khí Khác
Để hiểu rõ hơn về tính độc đáo của công thức cấu tạo N2, chúng ta có thể so sánh nó với công thức cấu tạo của một số phân tử khí phổ biến khác.
4.1. So Sánh Với Oxy (O2)
- Công thức cấu tạo: Phân tử oxy (O2) có liên kết đôi giữa hai nguyên tử oxy, bao gồm một liên kết sigma (σ) và một liên kết pi (π).
- Độ bền liên kết: Liên kết đôi trong O2 yếu hơn liên kết ba trong N2.
- Tính chất hóa học: Oxy hoạt động hóa học hơn nitơ. Oxy dễ dàng tham gia phản ứng oxy hóa với nhiều chất khác nhau, trong khi nitơ trơ hơn ở điều kiện thường.
4.2. So Sánh Với Hydro (H2)
- Công thức cấu tạo: Phân tử hydro (H2) có liên kết đơn giữa hai nguyên tử hydro, chỉ bao gồm một liên kết sigma (σ).
- Độ bền liên kết: Liên kết đơn trong H2 yếu hơn nhiều so với liên kết ba trong N2.
- Tính chất hóa học: Hydro là một chất khử mạnh và dễ dàng tham gia phản ứng với nhiều chất khác, trong khi nitơ trơ hơn.
4.3. So Sánh Với Carbon Dioxide (CO2)
- Công thức cấu tạo: Phân tử carbon dioxide (CO2) có hai liên kết đôi giữa nguyên tử carbon và hai nguyên tử oxy. Mỗi liên kết đôi bao gồm một liên kết sigma (σ) và một liên kết pi (π).
- Độ bền liên kết: Liên kết trong CO2 bền hơn liên kết đơn hoặc đôi, nhưng vẫn yếu hơn liên kết ba trong N2.
- Tính chất hóa học: Carbon dioxide là một chất khí tương đối trơ, nhưng vẫn hoạt động hơn nitơ. CO2 tham gia vào quá trình quang hợp của cây xanh và có thể phản ứng với một số chất khác trong điều kiện nhất định.
| Phân tử | Công thức cấu tạo | Loại liên kết | Độ bền liên kết | Tính chất hóa học |
|---|---|---|---|---|
| N2 | N≡N | Liên kết ba | Rất bền | Trơ ở điều kiện thường, phản ứng ở nhiệt độ cao hoặc có xúc tác |
| O2 | O=O | Liên kết đôi | Bền | Hoạt động, dễ dàng tham gia phản ứng oxy hóa |
| H2 | H-H | Liên kết đơn | Kém bền | Chất khử mạnh, dễ dàng tham gia phản ứng |
| CO2 | O=C=O | Liên kết đôi | Bền | Tương đối trơ, tham gia vào quá trình quang hợp và phản ứng trong điều kiện nhất định |
5. Các Phương Pháp Xác Định Công Thức Cấu Tạo Của Nitơ
Có nhiều phương pháp khác nhau để xác định công thức cấu tạo của nitơ, từ các phương pháp thực nghiệm đến các phương pháp lý thuyết.
5.1. Phương Pháp Thực Nghiệm
- Nhiễu xạ tia X: Phương pháp này sử dụng tia X để xác định cấu trúc tinh thể của các chất. Bằng cách phân tích mô hình nhiễu xạ, các nhà khoa học có thể xác định vị trí của các nguyên tử trong phân tử và từ đó suy ra công thức cấu tạo.
- Quang phổ hồng ngoại (IR): Phương pháp này dựa trên sự hấp thụ ánh sáng hồng ngoại của các phân tử. Các nhóm chức khác nhau trong phân tử sẽ hấp thụ ánh sáng ở các tần số khác nhau. Bằng cách phân tích phổ IR, các nhà khoa học có thể xác định các loại liên kết có trong phân tử và từ đó suy ra công thức cấu tạo.
- Quang phổ Raman: Phương pháp này tương tự như quang phổ IR, nhưng dựa trên sự tán xạ ánh sáng Raman của các phân tử. Quang phổ Raman cung cấp thông tin bổ sung về các rung động phân tử và có thể được sử dụng để xác định công thức cấu tạo.
5.2. Phương Pháp Lý Thuyết
- Tính toán lượng tử: Các phương pháp tính toán lượng tử, như lý thuyết phiếm hàm mật độ (DFT) hoặc phương pháp Hartree-Fock, có thể được sử dụng để tính toán cấu trúc điện tử và năng lượng của các phân tử. Bằng cách so sánh kết quả tính toán với các dữ liệu thực nghiệm, các nhà khoa học có thể xác định công thức cấu tạo chính xác nhất của phân tử.
- Mô phỏng động lực học phân tử: Phương pháp này sử dụng các định luật vật lý cổ điển để mô phỏng chuyển động của các nguyên tử và phân tử theo thời gian. Bằng cách theo dõi chuyển động của các nguyên tử, các nhà khoa học có thể xác định cấu trúc ổn định nhất của phân tử và từ đó suy ra công thức cấu tạo.
6. Ảnh Hưởng Của Các Yếu Tố Bên Ngoài Đến Cấu Trúc Và Tính Chất Của Nitơ
Mặc dù nitơ là một chất khí tương đối trơ, nhưng cấu trúc và tính chất của nó có thể bị ảnh hưởng bởi một số yếu tố bên ngoài.
6.1. Nhiệt Độ
- Ảnh hưởng đến trạng thái: Ở nhiệt độ thấp, nitơ có thể chuyển từ trạng thái khí sang trạng thái lỏng hoặc rắn.
- Ảnh hưởng đến phản ứng: Nhiệt độ cao có thể làm tăng tốc độ phản ứng của nitơ với các chất khác.
6.2. Áp Suất
- Ảnh hưởng đến trạng thái: Áp suất cao có thể làm tăng mật độ của nitơ và thúc đẩy quá trình hóa lỏng.
- Ảnh hưởng đến phản ứng: Áp suất cao có thể làm thay đổi hằng số cân bằng của các phản ứng liên quan đến nitơ.
6.3. Xúc Tác
- Ảnh hưởng đến phản ứng: Xúc tác có thể làm giảm năng lượng hoạt hóa của các phản ứng liên quan đến nitơ, làm cho chúng xảy ra dễ dàng hơn. Ví dụ, xúc tác sắt được sử dụng trong quá trình Haber-Bosch để sản xuất amoniac.
6.4. Bức Xạ
- Ảnh hưởng đến liên kết: Bức xạ năng lượng cao, như tia cực tím hoặc tia X, có thể phá vỡ liên kết ba trong phân tử N2, tạo ra các nguyên tử nitơ tự do.
- Ảnh hưởng đến phản ứng: Các nguyên tử nitơ tự do rất hoạt động và có thể tham gia vào các phản ứng hóa học khác nhau.
7. Các Biện Pháp An Toàn Khi Sử Dụng Và Bảo Quản Nitơ
Nitơ là một chất khí không độc hại, nhưng vẫn cần tuân thủ các biện pháp an toàn khi sử dụng và bảo quản để tránh các rủi ro tiềm ẩn.
7.1. Đối Với Nitơ Khí
- Thông gió tốt: Đảm bảo thông gió tốt khi sử dụng nitơ khí trong không gian kín để tránh tình trạng thiếu oxy.
- Tránh hít phải: Tránh hít phải nitơ khí nồng độ cao, vì nó có thể gây ngạt.
- Kiểm tra rò rỉ: Kiểm tra thường xuyên các thiết bị và đường ống dẫn nitơ để phát hiện và khắc phục rò rỉ kịp thời.
7.2. Đối Với Nitơ Lỏng
- Sử dụng đồ bảo hộ: Sử dụng đồ bảo hộ như găng tay cách nhiệt, kính bảo hộ, và quần áo dài tay khi tiếp xúc với nitơ lỏng để tránh bị bỏng lạnh.
- Tránh tiếp xúc với da: Tránh để nitơ lỏng tiếp xúc trực tiếp với da, vì nó có thể gây bỏng lạnh nghiêm trọng.
- Bảo quản đúng cách: Bảo quản nitơ lỏng trong các bình chứa chuyên dụng, được thiết kế để chịu được áp suất và nhiệt độ thấp.
- Thông gió tốt: Sử dụng nitơ lỏng trong khu vực thông gió tốt để tránh tích tụ khí nitơ và gây ngạt.
8. Tương Lai Của Nghiên Cứu Và Ứng Dụng Nitơ
Nghiên cứu và ứng dụng nitơ vẫn đang tiếp tục phát triển, với nhiều hướng đi đầy hứa hẹn.
8.1. Nghiên Cứu
- Tìm kiếm xúc tác mới: Các nhà khoa học đang tìm kiếm các loại xúc tác mới hiệu quả hơn cho quá trình Haber-Bosch, nhằm giảm chi phí và năng lượng tiêu thụ trong sản xuất amoniac.
- Phát triển vật liệu mới: Nitơ được sử dụng để tạo ra các vật liệu mới với các tính chất đặc biệt, như độ cứng cao, khả năng chịu nhiệt tốt, hoặc tính siêu dẫn.
- Nghiên cứu về chu trình nitơ: Các nhà khoa học đang nghiên cứu sâu hơn về chu trình nitơ trong tự nhiên, nhằm hiểu rõ hơn về vai trò của nitơ trong các hệ sinh thái và tìm cách giảm thiểu ô nhiễm nitơ.
8.2. Ứng Dụng
- Sản xuất năng lượng: Nitơ có thể được sử dụng để sản xuất năng lượng trong các pin nhiên liệu nitơ.
- Lưu trữ năng lượng: Nitơ lỏng có thể được sử dụng để lưu trữ năng lượng trong các hệ thống lưu trữ năng lượng lạnh.
- Y học: Nitơ có thể được sử dụng để phát triển các phương pháp điều trị mới cho các bệnh khác nhau.
9. Các Câu Hỏi Thường Gặp Về Công Thức Cấu Tạo Của Nitơ (FAQ)
9.1. Tại sao nitơ lại trơ về mặt hóa học ở điều kiện thường?
Nitơ trơ do liên kết ba rất bền giữa hai nguyên tử nitơ, cần một lượng lớn năng lượng để phá vỡ.
9.2. Liên kết ba trong N2 bao gồm những loại liên kết nào?
Liên kết ba trong N2 bao gồm một liên kết sigma (σ) và hai liên kết pi (π).
9.3. Công thức Lewis của N2 là gì?
Công thức Lewis của N2 biểu diễn sự liên kết giữa hai nguyên tử nitơ bằng ba gạch ngang, mỗi gạch biểu thị một cặp electron dùng chung.
9.4. Nitơ có những ứng dụng quan trọng nào trong công nghiệp?
Nitơ được sử dụng để sản xuất amoniac, thép, bảo quản thực phẩm và sản xuất linh kiện điện tử.
9.5. Nitơ lỏng được sử dụng để làm gì trong y học?
Nitơ lỏng được sử dụng để bảo quản mẫu sinh học, phẫu thuật lạnh và điều trị da.
9.6. Tại sao nitơ được sử dụng để bơm lốp xe?
Nitơ giúp duy trì áp suất lốp ổn định hơn, giảm nguy cơ nổ lốp và tăng tuổi thọ của lốp.
9.7. Các phương pháp nào được sử dụng để xác định công thức cấu tạo của nitơ?
Các phương pháp thực nghiệm như nhiễu xạ tia X, quang phổ hồng ngoại và quang phổ Raman, cũng như các phương pháp lý thuyết như tính toán lượng tử và mô phỏng động lực học phân tử.
9.8. Những yếu tố nào có thể ảnh hưởng đến cấu trúc và tính chất của nitơ?
Nhiệt độ, áp suất, xúc tác và bức xạ.
9.9. Cần tuân thủ những biện pháp an toàn nào khi sử dụng nitơ?
Đảm bảo thông gió tốt, tránh hít phải nitơ nồng độ cao, kiểm tra rò rỉ (đối với nitơ khí); sử dụng đồ bảo hộ, tránh tiếp xúc với da, bảo quản đúng cách (đối với nitơ lỏng).
9.10. Tương lai của nghiên cứu và ứng dụng nitơ là gì?
Tìm kiếm xúc tác mới, phát triển vật liệu mới, nghiên cứu về chu trình nitơ, sản xuất năng lượng, lưu trữ năng lượng và ứng dụng trong y học.
10. Tại Sao Nên Tìm Hiểu Về Xe Tải Tại XETAIMYDINH.EDU.VN?
Bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải ở Mỹ Đình, Hà Nội? Bạn muốn so sánh giá cả, thông số kỹ thuật và tìm kiếm địa điểm mua bán uy tín? Hãy đến với XETAIMYDINH.EDU.VN, nơi bạn sẽ tìm thấy mọi thông tin cần thiết về xe tải, từ các dòng xe mới nhất đến dịch vụ sửa chữa và bảo dưỡng chất lượng.
Đội ngũ chuyên gia của Xe Tải Mỹ Đình luôn sẵn sàng tư vấn và giải đáp mọi thắc mắc của bạn, giúp bạn lựa chọn chiếc xe tải phù hợp nhất với nhu cầu và ngân sách của mình. Chúng tôi cam kết cung cấp thông tin chính xác, cập nhật và đáng tin cậy, giúp bạn đưa ra quyết định sáng suốt nhất.
Liên hệ ngay với Xe Tải Mỹ Đình để được tư vấn miễn phí:
- Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội
- Hotline: 0247 309 9988
- Trang web: XETAIMYDINH.EDU.VN
Đừng bỏ lỡ cơ hội tìm hiểu về các dòng xe tải phù hợp với nhu cầu của bạn tại XETAIMYDINH.EDU.VN!